N-(4-羟基苯基)维生素甲酰胺对肺癌H1299细胞增殖的影响
2018-07-19张玲,周青,汪渊
张 玲,周 青,汪 渊
肺癌在我国发病率高,病死率高.因早期无明显症状,就诊时往往已是中晚期,治疗难度大,因此亟需开发肺癌敏感的药物来抑制肿瘤细胞的恶性增殖,控制疾病的发展进程.N-(4-羟基苯基)维生素甲酰胺(4-HPR)是全反式维甲酸(ATRA)的衍生物,在国外乳腺癌、前列腺癌等研究中已进入了临床试验阶段[1-2],是一种强有力的化疗药物.肺癌的病理类型多,已发现的肺癌细胞株亦较多.
本课题组的前期研究中发现4-HPR显著抑制肺癌A549的增殖[3].本实验旨在观察4-HPR对肺癌H1299细胞增殖的影响,为其用于临床肺癌治疗提供一定的理论和实验依据.
1 材料和方法
1.1 主要试剂和仪器
主要试剂:DMEM培养基(美国Hyclone公司),胎牛血清(杭州四季青生物公司),胰酶、BCA试剂盒(Beyotime公司),细胞用DMSO(Appli⁃chem公司),CCK-8(南京建成生物公司),结晶紫染料(上海生工生物工程公司),4-HPR(MCE公司),ATRA(DC Chemicals公司),兔源抗人p-p38抗体(CST公司),兔源抗人p38、鼠源抗人β-actin抗体(santa cruz公司),兔来源抗鼠、羊来源抗兔IgG抗体(millipore公司),ECL试剂盒(Thermo fisher公司).
主要仪器:细胞培养箱(Thermo fisher公司),超净台(苏州净化设备有限公司),倒置显微镜(奥林巴斯有限公司),化学发光成像仪(上海勤翔仪器公司).
1.2 细胞培养
将H1299细胞株培养于25cm2培养瓶中,加入含10%胎牛血清的DMEM培养基,置37℃,5%CO2及饱和湿度的细胞培养箱中培养.细胞长至80%~90%密度时用胰酶消化传代,取处于对数生长期的细胞接种于孔板中,进行后续实验.
1.3 细胞增殖实验
按4000个/孔细胞种入96孔培养板,过夜培养,贴壁后加药处理.设置细胞对照组、溶剂对照组、1μmol 4-HPR组、5μmol 4-HPR组、10μmol 4-HPR组和50μmol 4-HPR组,每组设6个复孔,培养48h.加入CCK-8试剂,2h后用酶标仪测吸光度.根据各处理组吸光度(OD)值,计算药物对细胞增殖的抑制率:(细胞对照组OD值-各处理组OD)/细胞对照组OD值×100%,绘制抑制率对药物浓度的柱状图,分析4-HPR对细胞增殖的影响.
1.4 倒置显微镜下观察
实验分细胞对照组、溶剂对照组(0.1%DMSO)、10μmol/L 4-HPR组,共三组.待细胞长至40%~50%密度时加药处理,48h后倒置显微镜下观察,并拍照记录.
1.5 平板克隆实验
实验分组同1.4,待细胞处于对数生长期,加药处理48h,胰酶消化,分别收集各组细胞,吹打为单个细胞悬液,计数各孔细胞,稀释至相同密度,并把细胞悬浮在含10%胎牛血清的DMEM培养液中,分别接种于六孔板各孔.培养箱中培养8~10天左右.弃去上清液,用PBS浸洗,加4%多聚甲醛固定.弃去后加1%结晶紫染色,然后用流水洗去染色液,倒置,空气干燥.拍照记录.在低倍镜下计数大于50个细胞集落作为克隆数.最后计算克隆形成率:(克隆数/接种细胞数)×100%.
1.6 Western blot
收集药物处理的细胞,分组同实验1.4,加入RIPA缓冲液(Tris-HCl,pH 7.4;150mmol/LNaCl,1mmol/LEDTA,1%Triton,0.1%SDS,磷酸酶抑制剂)提取蛋白,BCA法蛋白定量.取50μg/孔蛋白上样进行SDS-PAGE电泳,电转至PVDF膜上.5%脱脂奶粉封闭2h,加鼠源抗人、兔源抗人抗体4℃孵育过夜,TBST洗涤后再加入相应浓度的兔来源抗鼠、羊来源抗兔IgG抗体室温孵育2h,洗涤后用ECL试剂盒检测,机器显影,采用Image Pro Plus软件进行灰度扫描,分析各条带的灰度值,以p-p38/p38进行比值计算作半定量分析.
1.7 统计学处理
实验重复3次,取其均值.采用SPSS 10.0统计软件进行分析,数据以-x±s表示,各组间数据比较采用单因素方差分析.P<0.05有统计学意义.
2 结果
2.1 梯度药物对H1299细胞增殖的影响
如图1结果所示,药物作用48h,与细胞对照组比较,随着4-HPR浓度增大,细胞增殖抑制率逐渐增大(P<0.05).25μmol/L抑制率已接近80%.选取10μmol/L药物浓度进行后续实验研究.溶剂对照组与细胞对照组比较无明显抑制作用.
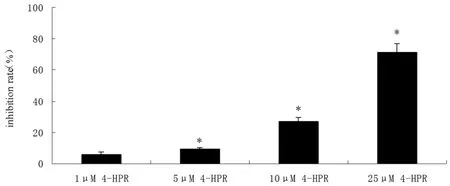
图1 梯度药物对细胞增殖抑制率与细胞对照组比较:*P<0.05
2.2 不同处理组H1299细胞生长变化
药物处理48h,显微镜下可见细胞对照组、溶剂对照组细胞密度大,光泽度好(如图2A、2B).4-HPR组细胞数明显减少,失去正常生长,细胞生长面之上漂浮有圆形死细胞(如图2C).
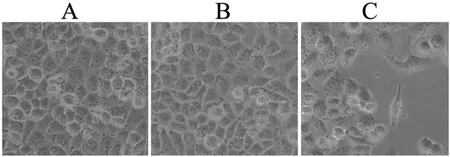
图2 不同处理对细胞生长的影响×100
2.3 不同处理组H1299细胞增殖能力变化
平板克隆实验结果表明,药物作用48h后,细胞和溶剂对照组形成细胞集落能力强,细胞克隆密集,单个克隆体积大,两组间克隆形成率没有明显差异(如图3A、3B).4-HPR组细胞克隆稀疏,单个克隆体积小,克隆形成率明显降低(P<0.05)(如图3C).


图3 药物处理细胞增殖能力的变化分组同图2,与细胞对照组比较:*P<0.05
2.4 不同处理组H1299细胞蛋白表达变化
Western Blot结果分析表明,4-HPR组可明显增加p38的磷酸化(p-p38)水平,细胞对照组与溶剂对照组中p-p38表达无明显差异(P<0.05)(如图4所示).
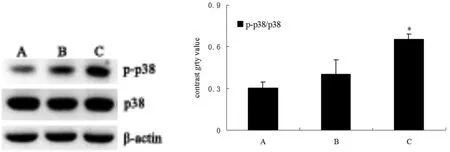
图4 药物处理细胞p-p38表达水平变化与细胞对照组比较:*P<0.05
3 讨论
肺癌是目前发病率和死亡率增长最快的恶性肿瘤之一.全国肿瘤防治办资料显示,我国肺癌发病率年增长率为26.9%,若不采取控制措施,到2025年,肺癌患者将达到100万,我国将成为世界第一肺癌大国[4].ATRA是维生素A的主要活性代谢物,作为维甲酸类药物的代表,已被用于治疗急性早幼粒细胞性白血病[5].然而ATRA使用会产生维甲酸综合症,并且长期使用会发生维甲酸抵抗,限制其在肿瘤治疗中的应用[6].4-HPR是ATRA众多衍生物中对肿瘤抑制作用较强的合成物.在本研究中发现,4-HPR可显著抑制人肺癌H1299细胞的增殖,10μmol/L的药物浓度细胞增殖抑制率已接近30%.国外将4-HPR用于儿童神经母细胞瘤的临床治疗,监测血药浓度发现,患儿血液中药物浓度可以达到12.9μmol/L[7].结合本研究中 4-HPR抑制肺癌细胞增殖的有效浓度,显示将4-HPR用于肺癌的临床治疗是有前景的.
细胞增殖是以细胞分裂方式增加细胞数量的过程,是细胞生命活动的重要特征之一.当正常细胞在多种因素的影响下,周期调节失控,获得自主生长信号,导致细胞无限增殖,就会产生肿瘤[8].增殖不受控制是肿瘤细胞的最基本特性之一.肺癌的发生发展也是肺癌细胞无限增殖的结果.因此,本研究主要从细胞增殖方面,研究了4-HPR对肺癌H1299细胞株的作用.4-HPR作用后,镜下可见H1299细胞明显减少,肺癌细胞的克隆形成能力亦明显降低.
细胞增殖失控过程中,多种蛋白及相关因子起了重要作用.通过对肿瘤细胞增殖相关的蛋白检测,可以了解肿瘤细胞的增殖情况,再结合临床检查,可对肿瘤的早期诊断和预后评估提供帮助.同时,随着分子生物学和基因工程技术的发展,以相关蛋白作为攻击靶点,已研制出了一些抑制肿瘤细胞增殖的药物,但针对某种特异性基因或蛋白的药物仍然缺乏,需要继续探索.丝裂原活化蛋白激酶(MAPK)家族是细胞内的主要信息传递系统,p38是MAPK家族成员之一,磷酸化后激活.大量研究证实,p38的活化水平对多种肿瘤细胞的增殖、凋亡、迁移等均有调控作用[9-13].亚硒酸钠抑制肺癌细胞A549增殖并促进p38磷酸化[14],索拉菲尼抑制人口腔癌细胞增殖与p38的活化相关[15],五味子乙素抑制结肠癌SW480细胞增殖和侵袭的同时p-p38蛋白水平明显增加[16].
本研究发现,4-HPR抑制细胞增殖过程中伴随p38磷酸化水平的增加,与相关研究吻合.然而国外有研究报道,药物抑制肿瘤细胞增殖、凋亡等生物学行为伴随着p38的失活[17].早前即有研究认为,MAPK家族在人不同组织肿瘤中的作用机制不同,因此所起的作用不同,甚至细胞周期的分期不同,这些酶的作用也不同[18].故进一步探讨p38信号通路在4-HPR抑制肺癌细胞增殖中的作用,对指导肺癌的防治具有重要价值.
