缺血预处理对大鼠缺血脑组织p-p38MAPK、Fas、FasL蛋白表达的影响
2018-07-18邹玉安
马 飞 邹玉安 薛 茜 张 力
(河北北方学院,河北 张家口 075000)
脑缺血预处理(CIP)可提高大鼠脑组织对缺血再灌注损伤的耐受,保护神经元功能〔1,2〕,而其机制未阐明。CIP可能诱导了抗凋亡机制,通过抑制神经元的凋亡对抗缺血再灌注损伤〔3,4〕。p38MAPK是MAPK家族中的重要成员,激活后的p38MAPK参与对脑缺血后神经细胞凋亡的调控〔5〕;脑缺血损伤后Fas、FasL表达亦明显增高〔6〕,两者都是脑缺血再灌注损伤重要通路。本研究通过观察CIP后p-p38MAPK、Fas、FasL蛋白在大鼠脑组织中的表达变化,探讨CIP对p38MAPK及其下游的Fas/FasL系统的影响及其诱导缺血性耐受的可能机制。
1 材料与方法
1.1实验动物及分组 SPF级健康雄性SD大鼠90只,体重250~280 g,购自北京华阜康生物科技有限公司〔实验动物许可证:SCXK(京)2014-0004〕。将大鼠随机分为模型组、缺血预处理组及假手术组,每组30只;各组再按观察时间点分为6 h、12 h、24 h、48 h、72 h五组,每小组6只。
1.2主要试剂及材料 2,3,5-三苯基氯化四氮唑(TTC)染料(美国Ameresco公司产品)。4%多聚甲醛(天津市光复精细化工研究所产品)。p-p38MAPK一抗体(Bioworld公司产品)。兔抗大鼠Fas、FasL一抗体及相应二抗(武汉博士德生物工程有限公司)。TUNEL原位细胞凋亡检测试剂盒(美国Roche公司产品)。栓线(北京西浓科技有限公司)。
1.3实验仪器 电脑生物组织摊烤片机(浙江金华科迪);自动脱水机、电脑生物组织包埋机、石蜡切片机、光学显微镜均为德国LEICA 公司产品,真彩病理图文分析系统(德国 LEICA LAS4.0.0)。
1.4动物模型的制备 模型组:采用Longa等〔7〕的大脑中动脉线栓法制备大鼠大脑中动脉局灶性脑缺血再灌注模型。缺血预处理组:大鼠用10%水合氯醛(3.5 ml/kg)腹腔注射麻醉,分离暴露右颈总动脉、颈外动脉及颈内动脉,结扎颈外动脉的远端,将栓线从颈外动脉残端迅速轻柔插入,经颈总动脉分叉部进入颈内动脉,阻断大脑中动脉血流。10 min后从颈外动脉轻轻抽出栓线,完成预缺血。3 d后再次麻醉大鼠,步骤同模型组。假手术组:仅分离右颈总动脉。
1.5神经功能缺损评分 根据文献〔8〕提供方法进行评分,两位协作者在大鼠脑梗死后各观察时间点分别双盲进行评分取均值,评分标准:0分:无神经功能缺损症状;1分:轻度局灶性神经功能缺损,不能完全伸展左前肢;2分:中度神经功能缺损,向左转圈;3分:重度神经功能缺损,向左倾倒;4分:不能自发行走,意识丧失。
1.6脑梗死体积测定 大鼠再灌注24 h后,各组随机选取6只,处死后断头取脑,切除额极与枕极,沿冠状面等分切成5片,脑片浸入2% TTC磷酸盐缓冲液中(放入37℃水浴箱避光孵育)染色30 min,继续4%多聚甲醛中4℃固定24 h,照相测得各层梗死面积。
1.7p-p38MAPK、Fas、FasL蛋白检测 造模成功后在各观察时间点处死各组大鼠,麻醉大鼠,暴露胸腹腔,灌注针从心尖部刺入直至主动脉,剪开右心耳,首先用生理盐水心脏灌注,待冲出的液体变清亮、大鼠四肢苍白后立即换用4%多聚甲醛灌注固定,大鼠全身抽搐僵硬后迅速断头取脑,切片,4%多聚甲醛4℃固定24 h。常规梯度浓度乙醇脱水,二甲苯透明,浸蜡,包埋。蜡块切片厚度5 μm,采用免疫组织化学(SABC法,按说明操作)检测p-38MAPK、Fas、FasL蛋白表达。
1.8细胞凋亡检测 TUNEL法检测神经细胞凋亡:石蜡包埋的切片常规脱蜡脱水,严格按照TUNEL法原位细胞凋亡检测试剂盒说明操作。光镜下(1×400)在梗死边区随机选取5个互不重叠视野,计数神经元凋亡细胞,计算凋亡指数(AI)=阳性细胞/(阳性细胞+阴性细胞)×100%。
1.9统计学分析 采用SPSS17.0软件进行单因素方差分析及独立样本t检验。
2 结 果
2.1神经功能缺损评分 假手术组大鼠无神经功能缺损症状,评分为0分;模型组大鼠反应差,体重下降,对侧前肢屈曲收缩、不能完全伸展,行走时向左转圈或、倾倒,神经功能缺损评分均>2分;缺血预处理组各时间点神经功能评分显著低于模型组(P<0.05)。见表1。
2.2脑梗死体积测定 模型组大鼠脑梗死体积百分比〔(39.8±2.64)%〕较缺血预处理组明显增大〔(22.2±2.32)%,t=12.322,P<0.05〕。
2.3大鼠脑组织 p-p38MAPK蛋白表达 p-p38MAPK蛋白免疫组化染色显示细胞质及细胞核着色为棕黄色。与假手术组比较,模型组及缺血预处理组p-p38MAPK蛋白表达水平均明显上调(P<0.05);缺血预处理组较模型组表达明显下降(P<0.05)。见表2,图1。
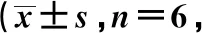
表1 各组脑缺血后各时间点神经功能评分分)

表2 各组大鼠不同时间脑组织p-p38MAPK蛋白表达(%,
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05,下表同
2.4大鼠脑组织Fas蛋白表达 Fas阳性细胞主要分布在细胞质,着色为棕黄色。与假手术组比较,模型组、缺血预处理组Fas蛋白表达水平均明显上调(P<0.05);缺血预处理组Fas蛋白表达明显低于模型组(P<0.05)。见图2,表3。
2.5大鼠脑组织 FasL蛋白表达 FasL蛋白免疫组化染色显示细胞质着色为棕黄色。与假手术组比较,模型组、缺血预处理FasL蛋白表达水平均明显上调(P<0.05)。缺血预处理组 FasL蛋白表达明显低于模型组(P<0.05)。见表4,图3。
2.6大鼠脑组织凋亡细胞TUNEL法结果 假手术组大脑皮层及海马区偶见凋亡细胞,缺血预处理组及模型组凋亡细胞显著增多。缺血预处理组与模型组比较凋亡细胞数明显减少(P<0.05)。见图4,表5。
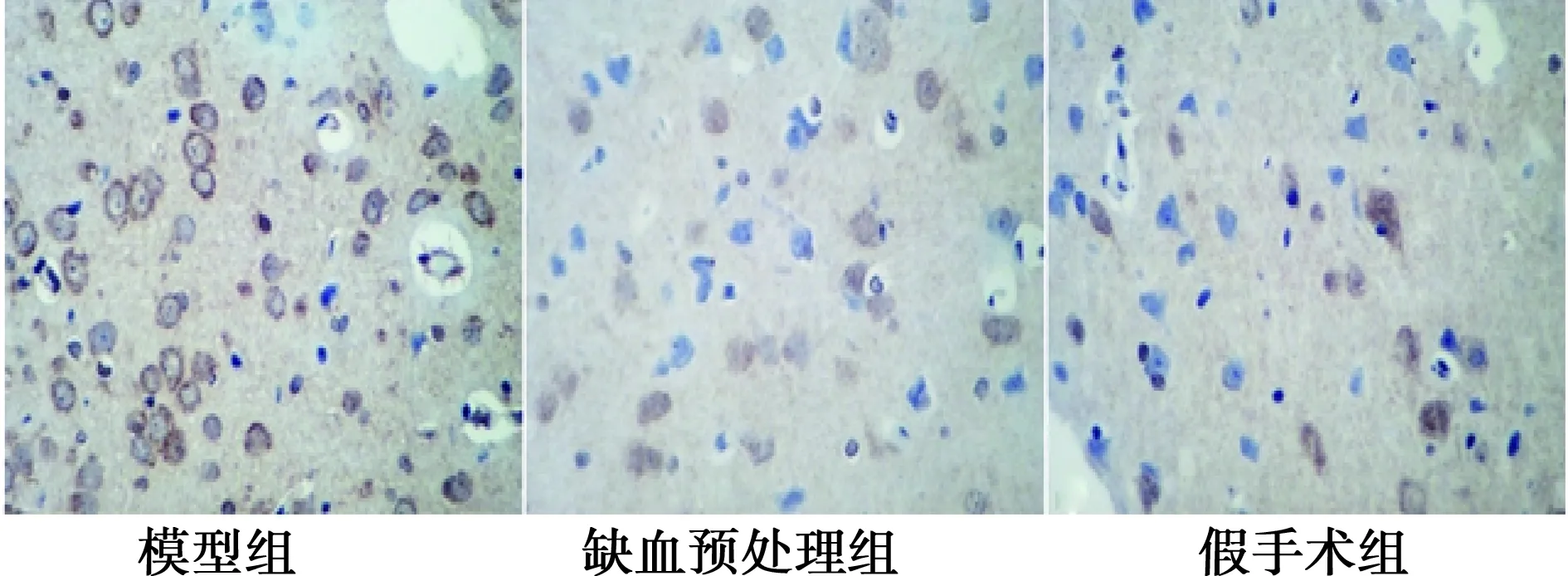
图1 各组脑组织p-p38MAPK蛋白表达(DAB,×400)

图2 各组脑组织Fas蛋白表达(DAB,×400)

组别6 h12 h24 h48 h72 h假手术组7.50±1.0511.67±1.8614.171)±2.3213.00±2.379.67±2.16模型组32.33±1.371)34.67±2.161)35.67±2.161)34.33±1.751)33.50±1.381)缺血预处理组18.33±2.801)2)21.17±2.321)2)22.83±2.711)2)21.50±1.871)2)19.50±1.521)2)

表4 各组大鼠不同时间脑组织 FasL蛋白表达(%,
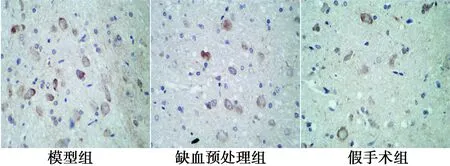
图3 各组脑组织FasL蛋白表达(DAB,×400)
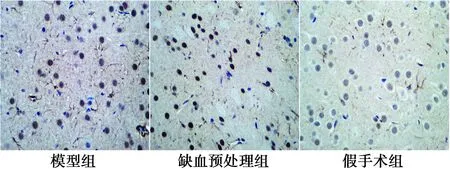
图4 各组脑组织凋亡情况(TUNEL,×400)

组别6 h12 h24 h48 h72 h假手术组9.50±2.0710.33±1.6311.75±1.3714.58±1.7411.92±1.74模型组37.75±2.231)39.25±2.721)40.58±1.721)45.67±1.081)38.92±2.331)缺血预处理组20.42±1.741)2)21.58±1.911)23.25±1.131)2)28.92±1.561)2)21.58±2.461)2)
3 讨 论
缺血预处理是Murry等〔9〕于1986年在犬心肌缺血模型中发现的。Kitagawa等〔10〕首次提出了缺血预处理的概念,阐明了脑缺血耐受现象,即给予轻微的短暂性非致死性脑缺血可以产生确切的脑保护效应,对此后严重的持续脑缺血/再灌注损伤产生耐受,起到减少脑梗死后神经元死亡、促进神经功能恢复等作用。脑缺血再灌注损伤可激活p38MAPK信号通路促进脑神经元凋亡〔11〕。p38MAPK信号通路的活化与Fas、FasL通路关系密切,在脑缺血损伤、细胞凋亡的过程中发挥重要作用〔12,13〕。抑制p38MAPK磷酸化是高压氧预处理诱导神经保护作用的重要机制,与p38MAPK抑制剂(SB203580)诱导的神经保护作用相当〔14〕。缺血后适应可以降低心肌梗死患者血清FasL峰值、减少细胞凋亡〔15〕,提示Fas/FasL系统可能参与脑缺血耐受的机制。以往研究证实CIP可通过抑制p38MAPK磷酸化、减少p-p38MAPK表达而抑制p38MAPK通路活化,从而抑制神经元凋亡〔16~18〕。也有研究发现肢体缺血预处理对肝缺血再灌注有延迟性保护作用,抑制缺血再灌注肝组织p38MAPK的磷酸化是其重要机制之一〔19〕。本研究表明,CIP能提高脑组织对急性缺血性脑损伤的抵抗力,促进神经功能恢复,减少梗死面积,提示缺血预处理可能通过有效抑制p38MAPK磷酸化,抑制Fas、FasL通路的激活,抑制神经元凋亡,从而发挥脑保护作用,抑制p38MAPK的磷酸化及Fas、FasL信号通路的激活可能是脑缺血耐受机制之一。
4 参考文献
1Kazunori T,Masatoshi K,Mikito H,etal.Acute reperfusion therapy and stroke care in Asia after successful endovascular trials〔J〕.Stroke,2015;46(6):1474-81.
2Wang M,Qi DS,Zhou C,etal.Ischemic preconditioning protects the brain against injury via inhibiting CaMKⅡ-nNOS signaling pathway〔J〕.Brain Res,2016;1634(1):140-9.
3Ding ZM,Wu B,Zhang WQ,etal.Neuroprotective effects of ischemic preconditioning and postconditioning on global brain ischemia in rats through the same effect on inhibition of apoptosis〔J〕.Int J Mol Sci,2012;13(5):6089-101.
4Liu X,Zhao S,Liu F,etal.Remote ischemic postconditioning alleviates cerebral ischemic injury by attenuating endoplasmic reticulum stress-mediated apoptosis〔J〕.Translat Stroke Res,2014;5(6):692-700.
5欧 回,韩雨杉,赵宏斌,等.P38MAPK在脑梗死和骨质疏松中表达的研究进展〔J〕.中国老年学杂志,2015;35(13):3766-9.
6赵 红,张国峰,张 华,等.氟伐他汀对大鼠脑缺血再灌注损伤后Fas和FasL表达的研究〔J〕.神经解剖学杂志,2015;31(1):49-53.
7Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
8Lou Z,Ren KD,Tan B,etal.Salviaolate protects rat brain from ischemia-reperfusion injury through inhibition of NADPH oxidase〔J〕.Planta Med,2015;81(15):1361-9.
9Murry CE,Teachings RB,Reimer KA.Preconditioning with ischemia:a delay of lethal cell injury in ischemic myocardium〔J〕.Circulation,1986;74(5):1124-36.
10Kitagawa K,Matsumoto M,Tagaya M,etal.Ischemic tolerance phenomenon found in the brain〔J〕.Brain Res,1990;528(1):21-4.
11Muhammad Imtiaz A,Matthias E,Christoph W,etal.A p38MAPK/MK2 signaling pathway leading to redox stress,cell death and ischemia/reperfusion injury〔J〕.Cell Commun Sign,2014;12(1):1-13.
12王晓天,李向阳,秦苏萍,等.p38MAPK介导的Fas/FasL凋亡信号通路在大鼠抗GBM肾炎中的作用〔J〕.中国免疫学杂志,2012;28(11):979-85.
13王晓天,刘晓梅,尤红娟,等.p38MAPK介导的Fas/FasL凋亡通路在缺血性脑损伤中的作用研究〔J〕.中国医药指南,2014;12(31):1-2.
14Yamashita S,Hirata T,Mizukami Y,etal.Repeated preconditioning with hyperbaric oxygen induces neuroprotection against forebrain ischemia via suppression of p38 mitogen activated protein kinase〔J〕.Brain Res,2009;1301:171-9.
15马 燚,尚小明.缺血后适应对急性心肌梗死介入治疗的影响〔J〕.中国老年学杂志,2010;30(16):2265-7.
16李 军,曹 红,连庆泉.p38MAPK在沙土鼠前脑缺血再灌注损伤及缺血预处理中的作用〔J〕.中华麻醉学杂志,2007;27(5):467-71.
17李建民,赵雅宁,陈长香,等.脑缺血预处理对沙鼠脑缺血再灌注损伤p38MAPK活化的作用〔J〕.中华神经外科杂志,2011;27(7):741-5.
18修丽梅,李光来,张晓敏,等.p38MAPK信号通路在肢体缺血预处理脑保护中的作用〔J〕.中华临床医师杂志(电子版),2015;9(9):1637-43.
19曹丽君,袁贵秀,王亚平,等.延迟相肢体缺血预处理抑制MAPKs磷酸化减轻兔肝缺血再灌注损伤〔J〕.中南大学学报(医学版),2012;37(6):591-7.
