轻型颅脑损伤患者血清标志物GFAP-BDPs、UCH-L1、NSE水平与预后的相关性
2018-07-18赵艳晶李莲娣
赵艳晶 李莲娣 王 莹 刘 卓
(牡丹江医学院第二附属医院急诊科,黑龙江 牡丹江 157011)
目前,临床中常使用格拉斯哥昏迷量表(GCS)对颅脑损伤的患者进行评估,评分在13~15分之间的患者归分为轻度颅脑损伤(mTBI)〔1〕。在过去的30年中,重型颅脑损伤是临床研究的主要方向,但据统计〔2〕,mTBI患者所占比例明显高于重型颅脑损伤患者。与中、重型颅脑损伤患者相比,mTBI患者预后较好,但该疾病患者若无法得到有效治疗,常会留下头痛、失眠、记忆力下降等后遗症,给患者及家属带来沉重负担〔3〕。该疾病无特异表现,多数患者影像学表现正常,早期的临床诊断困难较大,故寻找一种方便、创伤小的检测方法是近年来诸多学者共同探讨的话题。胶质细胞纤维酸性蛋白(GFAP)是从胶质瘤中分离得到的纤维酸性蛋白〔4〕。研究发现〔5〕,GFAP为星型胶质瘤的中间丝,是胶质细胞骨架的主要成分。因该物质仅于星型胶质细胞中出现,故一旦于患者脑脊液中发现该物质时,常代表星型胶质瘤细胞受到损伤。因此,GFAP及其分解物质有望作为mTBI临床诊断的标准。研究表明GFAP用于鉴别颅脑损伤具有较高特异性〔6〕。本文探讨mTBI患者血清GFAP-BDPs、泡素C末端水解酶L1(UCH-L1)、神经元特异性烯醇化酶(NSE)的水平及其与预后的关系。
1 资料与方法
1.1一般资料 选取2015年1月至2016年3月于牡丹江医学院第三附属医院治疗的创伤性颅脑损伤患者56例为实验组,同时依据患者颅脑CT表现将其分为A组(颅脑CT阴性,26例)及B组(颅脑CT阳性,30例),另选30例健康体检者作为对照组。实验组A组:男14例,女12例,年龄31~64〔平均(46.83±5.73)〕岁;实验组B组:男16例,女14例,年龄32~67〔平均(48.13±6.03)〕岁;对照组:男17例,女13例,年龄31~65〔平均(47.77±5.92)〕岁。各组于性别、年龄、体重指数(BMI)等一般资料方面对比差异无统计学意义(P>0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准。

表1 各组一般资料对比
1.2入组及排除标准 入组标准:mTBI者GCS评分12~15分;无其他组织器官损伤伴发者;无心、肝、肾疾病伴发者;无精神疾病伴发,依从性较好者;患者本人及家属知情且同意入组观察者。排除标准:伴发其他心、脑系统重大疾病者;伴发精神疾病,依从性较差者;既往存在手术史者;入组后病情加重,GCS评分降低者;患者本人或家属不知情或知情后反对入组观察者。
1.3方法 采用荷兰飞利浦公司制造的Philips 64排螺旋CT对患者进行扫描,设定扫描管电压为125 kV,管电流125 mA,时间2~3 s,矩阵512×512,窗宽85~100 HU,窗位30~55,基准线为OM线,对患者行常规轴位扫描,层厚10 mm、层距10 mm,后于重点位置行薄层扫描,层厚5 mm,层距5 mm。
采用酶联免疫吸附试验(ELISA)检测患者血清GFAP-BDPs、UCH-L1、NSE浓度,试剂盒由罗氏公司提供。实验组于受伤12 h时采取外周静脉血,对照组于清晨空腹时抽取,将血液置于EDTA-K2试管中,于室温下进行离心(3 000 r/min,10 min),后取上清液置于-70℃环境中保存〔7〕。6个月后采用电话或者门诊随访对实验组进行格拉斯哥预后量表(GOS-E)预后分析。
1.4GOS-E评价标准 GOS-E预后评分〔8〕共分为5级:5级:恢复良好(恢复正常生活,可存在轻度缺陷);4级:轻度残疾(残疾但可独立生活,可于保护下工作);3级:重度残疾(清醒、残疾,日常生活需要照料);2级:植物生存(仅有最小反应如随着睡眠/清醒周期,眼睛可随之闭合/张开);1级:死亡。
1.5统计学方法 采用SPSS16.0软件进行Mann-WhitneyU非参数检验,采用Spearman分析血清GFAP-BDPs、UCH-L1、NSE浓度及GOS-E评分。采用受试者工作特征(ROC)曲线分析法对比实验组血清各指标浓度及颅脑CT关系。
2 结 果
2.1血清GFAP-BDPs浓度比较 实验组A组与B组GFAP-BDPS浓度分别为(0.713±0.179)μg/L和(1.314±0.563)μg/L,均较对照组显著增高〔(0.052±0.012)μg/L,P<0.01〕,A组较B组显著降低(P<0.05)。
2.2GFAP-BDPs浓度ROC曲线同颅脑CT的关系 血清GFAP-BDPs浓度对颅脑CT阴性及阳性的判断具有较高的准确率(GFAP-BDPs浓度=0.563 μg/L时,曲线下面积(AUC)=0.801,敏感性83.47%,特异性75.34%)。
2.3各组UCH-L1、NSE浓度比较 实验组A组与B组的UCH-L1与NSE浓度均明显高于对照组(t=6.796,7.012;6.993,7.041,均P<0.01),且B组UCH-L1与NSE浓度显著高于A组(t=5.423,4.162,均P<0.05),见表2。
2.4UCH-L1、NSE浓度ROC曲线同颅脑CT的关系 血清UCH-L1浓度对颅脑CT阴性及阳性的判断具有较高的准确率(UCH-L1浓度=0.606 g/L时,AUC=0.847,敏感性85.78%,特异性82.89%。血清NSE浓度对颅脑CT阴性及阳性的判断具有较高的准确率,NSE浓度=27.789 g/L时,AUC=0.859,敏感性83.32%,特异性79.63%。
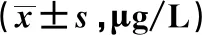
表2 各组UCH-L1、NSE浓度比较
与对照组比较:1)P<0.01;与B组比较:2)P<0.05
2.5实验组各项指标同6个月后GOS-E评分的关系 B组血清GFAP-BDPs、UCH-L1及NSE浓度水平越高,患者预后越差(r=-0.64;-0.78,-0.72,均P<0.01);A组血清GFAP-BDPs及NSE浓度水平越高,患者预后越差(r=-0.63,-0.58,均P<0.01),而血清UCH-L1浓度与患者预后不存在明显相关性(r=-0.42,P>0.05),说明UCH-L1浓度判断患者预后仍需联系患者颅脑CT情况作出判断,见表3。
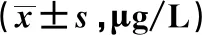
表3 实验组GFAP-BDPs、UCH-L1及NSE浓度同6个月后GOS-E评分的关系
与同组GOS-E评分<5级比较:1)P<0.01
3 讨 论
虽然与中、重型颅脑损伤患者相比,mTBI患者临床预后较好,但该疾病具有如下特点〔9〕:早期临床诊断困难,综合征主要由患者主管倾诉,无明显特异性;多数患者可治愈,利于早期诊断的持续综合征、神经生物紊乱、认知障碍等临床表现可能完全消失;该类型疾病患者死亡率、致残率较少,但遗留的行为紊乱、认知功能障碍等后遗症极为常见〔10〕。因此,找出一种特异性较高的诊断方法及准确性较高的预测方法显得极为重要〔11〕。以往有学者研究了颅脑损伤患者血清中S100B、心脏型脂肪酸结合蛋白(H-FABP)及UCH-L1等浓度与患者病情及预后间的关系,结果表明,其间存在相关性,但特异性及灵敏性均较低,无法满足临床需要〔12〕。
GFAP是一种长丝蛋白,由星形细胞表达,一旦星形细胞骨架因神经细胞损伤等情况分解后,GFAP会大量产生,于中度预后差的TBI患者脑脊液中,GFAP浓度升高极为明显〔13〕。以往有学者进行研究发现〔14〕,GFAP于体外极易被蛋白水解,体内存在可能是因GFAP分解产物存在,因此对其的研究受到了极大的限制。TBI患者脑脊液中GFAP-BDPs可能为钙蛋白酶过度激活产生,由受到损伤的胶质细胞所释放。故,GFAP-BDPs不仅为神经胶质细胞增生的产物,也是TBI患者神经胶质细胞损伤的结果,可以用作TBI的标志物〔15〕。
UCH-L1、NES为近年来新发现的脑损伤生物学标志物,研究发现〔16〕,该物质的含量可反映患者脑损伤程度,对TBI临床诊治意义重大。UCH-L1由223个氨基酸构成,又名蛋白基因产物9.5,是泛素蛋白酶中的重要组成,几乎所有神经组织中有该物质存在〔17〕。以往研究表明〔18〕,该物质活性变化与机体神经退行性病变间关系密切,帕金森病及亨廷顿舞蹈病等患者血清UCH-L1含量均明显增加。NSE是糖酵解过程中的关键蛋白,本质为大分子物质,该物质于神经元及内分泌细胞中特异性存在〔19〕。国外研究发现,重度TBI患者受伤3 d后血清内该物质水平明显上升,可依据TBI患者血清内NSE含量对其进行预后分析〔20〕。
本研究表明mTBI患者GFAP-BDPs、UCH-L1、NSE浓度是较好的颅脑损伤伤情判断、预后预测的指标,结合标志物水平和影像学结果,有利于帮助分析颅脑损伤的病理、生理机制,为治疗提供较高的参考价值。
4 参考文献
1薛 龙,尧荣凤,葛 岭,等.轻型颅脑损伤后患者血清生物标志物GFAP-BPDs的相关性研究〔J〕.外科研究与新技术,2014;3(1):24-8.
2余 万,黄保胜,陆晓诚,等.创伤性脑损伤患者血清泛素羧基末端水解酶L1和神经元特异性烯醇化酶含量测定及临床意义〔J〕.江苏医药,2014;40(7):771-6.
3沈远望.急性路脑损伤中CT与MRI诊断价值比较〔J〕.中国实用神经疾病杂志,2014;17(18):70-3.
4葛 岭,薛 龙,黄晓伟,等,轻型颅脑损伤患者血清UCH-L1变化的临床意义和患者预后关系〔J〕.医学研究杂志,2014;43(7):116-20.
5曲志峰,陈文理,温志强,等.87例重型颅脑损伤患者临床治疗有效性及安全性综合研究〔J〕.中国医学前沿杂志(电子版),2014;6(10):138-41.
6丁涟沭.创伤性脑损伤后标志物的研究进展〔J〕.中华神经创伤外科电子杂志,2015;1(1):42-4.
7Forde CT,Karri SK,Young AM,etal.Predictive markers in traumatic brain injury:opportunities for a serum biosignature〔J〕.Br J Neurosurg,2014;28(1):8-15.
8Han K,Mac Donald CL,Johnson AM,etal.Disrupted modular organization of resting-state cortical functional connectivity in U.S.military personnel following concussive ‘mild’ blast-related traumatic brain injury〔J〕.Neuroimage,2014;84:76-9.
9王 杨,温明哲,马延斌.创伤性脑损伤生物学标志物的研究进展〔J〕.医学研究杂志,2014;43(9):158-61.
10Lei J,Gao G,Jiang J.Acute traumatic brain injury:is current management evidence based? An empirical analysis of systematic reviews〔J〕.J Neurotrauma,2013;30(7):529-37.
11Diaz-Arrastia R,Wang KK,Papa L,etal.Acute biomarkers of traumatic brain injury:relationship between plasma levels of ubiquitin C-terminal hydrolase-L1 and glial fibrillary acidic protein〔J〕.J Neurotrauma,2014;31(1):19-25.
12Thelin EP,Johannesson L,Nelson D,etal.S100B is an important outcome predictor in traumatic brain injury〔J〕.J Neurotrauma,2013;30(7):519-28.
13徐 静,王绪山,李学忠,等.颅脑损伤的生化检测标志物研究进展〔J〕.中国卫生检验杂志,2016;26(2):298-300.
14吴 杰.颅脑外伤后血糖水平与预后的相关性分析〔J〕.中国实用神经疾病杂志,2014;8(19):71-2.
15饶亚华,蒋 冰,陈 馨.脑梗死患者血清同型半胱氨酸和S100β的检测及意义〔J〕.国际医学检验杂志,2014;35(13):1782-4.
16吴光辉,高如生,刘 明,等.急性颅脑损伤患者血清NSE和S-100B水平的变化及临床意义〔J〕.中国伤残医学,2014;22(1):24-6.
17邓健平,孙晓川,刘 科.严重颅脑损伤后血清GFAP、UCH-L1与CT表现及预后的关系〔J〕.重庆医学,2013;42(34):4117-9.
18Kochanek PM,Berger RP,Fink EL,etal.The potential for bio-mediators and biomarkers in pediatric traumatic brain injury and neurocritical care〔J〕.Front Neurol,2013;5(8):40.
19Berger RP,Hayes RL,Richichi R,etal.Serum concentrations of ubiquitin C-terminal hydrolase-L1 and alpha Ⅱ-spectrin braskdown product 145 kDa correlate with outcome after pediatric TBI〔J〕.J Neurotrauma,2013;29(1):162-7.
20邓引生,焦 磊,吴 旻,等.D-二聚体和C反应蛋白在脑外伤后的表达变化及临床意义〔J〕.江苏医药,2013;39(16):1906-8.
