磷酸二氢钾对苜蓿幼苗体内根瘤菌 运移及定殖的影响
2018-07-17张运婷师尚礼苗阳阳康文娟张翠梅白逸伟
张运婷,师尚礼,苗阳阳,康文娟,张翠梅,周 彤,白逸伟
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业 可持续发展研究中心,甘肃 兰州 730070)
根瘤菌-豆科植物共生体系的共生固氮作用具有较大的经济和社会效益,人工接种根瘤菌在提高经济作物和牧草的质量和产量、改良土壤肥力、改善生态环境等方面具有重要意义[1]。生产中常以增施根瘤菌剂来提高苜蓿品质和产量[2-4],但根瘤菌剂存在质量不稳定、活菌数少、占瘤率低、专一性强、接种工作繁琐等问题[5],使根瘤菌剂的应用处于徘徊不前的状态。因此,急需探寻促使优良根瘤菌在植物生长过程中运移至种子并稳定传代,免除根瘤菌的接种环节的方法。张淑卿,李剑峰,等[6-10]研究发现,根瘤菌存在于苜蓿体内,在根系中数量较大并可向上运移并定殖于茎、叶、花等组织,但运移及定殖效果不佳。添加外源物质对根瘤菌的侵染、结瘤固氮和运移与定殖有促进作用[11-14],目前仅对有限的几种外源促进剂进行研究,且效果仍不理想,探寻促进根瘤菌运移和定殖的外源物质,对促使优良根瘤菌在植株生长过程中侵染根系进入其内部、运移并定殖于种子器官内,形成目标根瘤菌与苜蓿种子共生体具有重要的意义。
磷酸二氢钾(KH2PO4)在农业上被作为高效磷钾复合肥,广泛用于作物栽培。苗淑杰等[15]研究表明磷是影响豆科作物结瘤固氮的一个非常重要的因素。姚玉波[16]在对大豆根瘤固氮特性的研究中发现,磷素营养对大豆根瘤固氮有明显影响,砂培条件下,大豆植株根瘤固氮量和固氮率随着磷素水平的提高均呈单峰曲线变化,大豆根瘤固氮率随着磷肥施用量的增加整体呈上升趋势。李富宽[17]研究发现,施磷肥和接种根瘤菌显著改善了紫花苜蓿根瘤的结瘤,施磷后,紫花苜蓿结瘤率明显提高,单株根瘤数和根瘤重均显著增加,根瘤共生固氮的效果提高。增施磷钾肥料和接种根瘤菌均可提高豆科作物根瘤固氮能力[18-20]。众多研究发现,磷元素可使根瘤增大[21]、提高根瘤菌活性[22],刺激根瘤菌繁殖,促使根瘤菌鞭毛运动,有利于根瘤菌接近和侵入根毛,形成根瘤[23]。近年来,有关KH2PO4对根瘤菌的影响研究主要集中在菌株活性、结瘤固氮等方面,而KH2PO4对根瘤菌在苜蓿体内运移和定殖有何影响尚不清楚。因此,试验通过添加不同浓度KH2PO4并接种不同来源的荧光标记根瘤菌,研究KH2PO4对根瘤菌在苜蓿体内运移及定殖的影响,以期为促进根瘤菌运移和定殖至种子提供依据。
1 材料和方法
1.1 试验材料
供试菌株:草业生态系统教育部重点实验室提供青色荧光标记根瘤菌RzhizobiumLH3436f(3436f,其原始菌株分离自WL343HQ紫花苜蓿)[24]、Ensifermeliloti12531f(12531f,其原始菌株为购自中国科学院微生物保藏中心的中华苜蓿根瘤菌)和RzhizobiumGN5f(gn5f,其原始菌株分离自甘农5号紫花苜蓿)。
供试种子:试验材料购自美国Monsanto 公司的WL343HQ紫花苜蓿种子(Medicagosativacv.WL343HQ),发芽率为84.5%。
KH2PO4:购自国药集团化学试剂有限公司,纯度等级为分析纯。
培养基:采用TY培养基(胰蛋白胨5 g,酵母粉3 g,CaCl2·2H2O 0.872 6 g,蒸馏水1 L;pH 7.0,固体培养基加琼脂16 g),进行菌株的保存、活化、培养和根瘤菌数量检测。
营养液:Hoagland有氮营养液和Hoagland无氮营养液[25-26]。
1.2 试验方法
1.2.1 培养液及菌液制备 将KH2PO4置于无菌三角瓶中,无菌水溶解并过3次无菌滤膜(0.22 μm),浓度设置为0(CK1)、50、100、200、400、600 mg/L,在无菌操作台内按浓度梯度加入TY液体培养基中,定量分装于50 mL三角瓶内并用无菌封口膜封口,同时将保存的3株标记根瘤菌活化后接入TY液体培养基,用无菌液体培养基调制成D600nm=0.5的菌液。
1.2.2 KH2PO4标记根瘤菌菌液制备 将3株标记根瘤菌菌液按照每瓶1 mL分别加入装有不同浓度的KH2PO4液体培养基内,每处理重复4次,28℃、180 r/min 摇床内培养7 d(未添加KH2PO4的3436f菌液为CK1,未添加KH2PO4的12531f菌液为CK2,未添加KH2PO4的gn5f菌液为CK3)。
1.2.3 幼苗的培育 沙培法栽培苜蓿幼苗[13],选取健康、饱满的WL343HQ紫花苜蓿种子20 g,在无菌操作台内医用碘伏消毒2 min后用无菌水清洗3~4次,无菌滤纸吸干水分待用。细沙洗净烘干,121℃、102.9 kPa、26 min灭菌3次后装入底部扎有网眼的塑料杯(直径10 cm,深12 cm,500 g/杯)[13],放入水培盒。每杯播种45粒已消毒的种子,表面覆盖已灭菌干沙1 cm。每处理水培盒内加有氮营养液1 L,使沙杯内沙子完全湿润,发芽前以无菌水补充水分。
1.2.4 幼苗根系接菌 待苜蓿幼苗长出真叶后,将3株标记根瘤菌分别等量接种于添加不同浓度KH2PO4(2.1筛选出的每株标记根瘤菌对应的3个浓度和0浓度)的液体培养基内制成菌液(表1),28℃、180 r/min条件下摇床内培养24 h,分别用针管向苜蓿沙培杯的沙子里注射30 mL菌液,确保除幼苗根系以外其他部位不接触菌液,以单独添加无菌水处理为对照(CK4)。接种后每个水培盒每隔10 d浇灌无氮营养液500 mL,无菌水补充水分,至60 d苜蓿植株收获。

表1 试验处理
1.3 测定指标与方法
1.3.1 3株标记根瘤菌适宜生长的KH2PO4浓度筛选 紫外分光光度计测定第1、2、3、4、5和6 d菌液D600nm值。根据吸光度值选择出每株标记根瘤菌适宜生长的3个KH2PO4浓度,用于苗期试验。
1.3.2 苜蓿幼苗体内标记根瘤菌运移与定殖状况的检测 参考文献[14]的根瘤菌运移及定殖的检测。随机挖取3株幼苗,前15 d每隔5 d检测1次,分离为根、茎、叶,后30 d每隔10 d检测1次,分离为根、下部茎、下部叶、上部茎、上部叶(从第4个真叶处分上部和下部),称取1 g。无菌操作台内医用碘伏消毒1~2 min,放入已灭菌的5 mL离心管中,加2 mL无菌水和3~5粒小钢珠,高通量组织研磨器研磨后离心(4 000 r/min,5 min),依次吸取0.2 mL均匀涂布于TY固体培养基中,28℃培养48 h。暗室内用手提紫外灯(波长336 nm)观察记录荧光标记根瘤菌落个数。
1.3.3 苜蓿幼苗单株结瘤数、根瘤等级检测 最后1次检测苜蓿体内标记根瘤菌运移与定殖状况时(即接种第45 d),各处理随机选取5株,测定其单株结瘤数、根瘤等级,根瘤等级划分采用5分制法既1分为中空的死亡根瘤;2分为横切面呈灰白色的无效根瘤;3分为直径小于0.5 mm的粉色根瘤;4分为直径处于0.5~1 mm的粉色根瘤;5分为直径大于1 mm的粉色根瘤[27]。
1.3.4 苜蓿幼苗生长指标测定 最后1次检测苜蓿体内标记根瘤菌运移与定殖时(即接种第45 d),各处理随机选取5株完整植株,测定其单株叶片数(复叶);数每株幼苗的叶片数;株高、根长采用直尺直接测量,地上鲜重、根鲜重,滤纸吸干表面水分后电子天平上称鲜质量。
1.4 数据处理
采用IBM SPSS Statistics 19.0进行数据处理和方差分析,对同一生长时间同一部位不同处理进行单因素方差分析,并用Duncan法对各测定数据作多重比较;采用Excel 2010制图。
2 结果与分析
2.1 3株标记根瘤菌适宜生长的KH2PO4浓度筛选
适宜浓度的KH2PO4可促进标记根瘤菌生长。随着培养天数的延长,3436f,12531f和gn5f菌液的OD值均呈现先增加后降低的趋势。
3436f菌液培养1和3 d,添加各浓度KH2PO4的3436f菌液D600nm值与CK1差异不显著(P>0.05)。2 d和6 d时,除添加600 mg/L KH2PO4外,其他浓度处理的菌液D600nm值均显著高于CK1,其中,菌液D600nm值最高的处理均为添加100 mg/L KH2PO4,分别显著高出CK134.16%、47.36%(P<0.05)。4 d时,添加100 mg/L KH2PO4的菌液D600nm值显著高出CK121.61%(P<0.05),其他浓度处理与CK1差异不显著(P>0.05)。5 d时,添加50、100、200 mg/L KH2PO4的菌液D600nm值显著高于CK1,其中,在100 mg/L浓度下达到最大值,显著高出CK130.31%(P<0.05)(图1)。
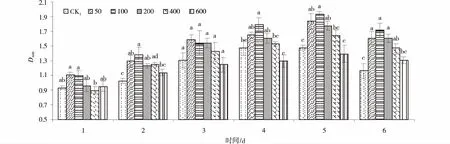
图1 不同浓度KH2PO4处理下的3436f菌液D600nm值Fig.1 Effects of different concentrations of KH2PO4 on D600nm values of 3436f 注:同一天不同小写字母表示差异显著(P<0.05),下同
12531f菌液培养1 d时,添加50 mg/L KH2PO4的菌液D600nm值最高,但与CK2差异不显著(P>0.05)。2 d添加100 mg/L KH2PO4的菌液D600nm值最高,显著高出CK215.06%(P<0.05)。3 d时,添加100、400 mg/L KH2PO4的菌液D600nm值显著高于CK2(P<0.05),分别高出12.74%、15.79%。4~6 d时,添加50,100和400 mg/L KH2PO4的菌液D600nm值均显著高于CK2(P<0.05),其中,5 d时添加400 mg/L KH2PO4的菌液D600nm值达到最大值,显著高出CK234.13%(P<0.05)(图2)。
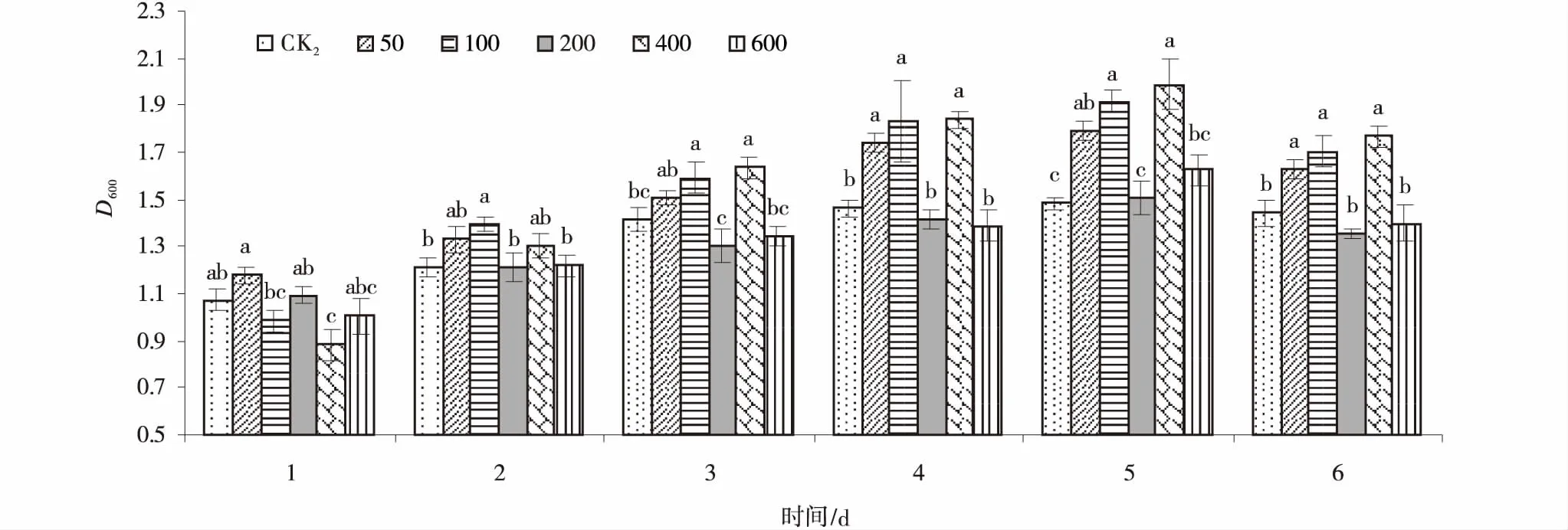
图2 不同浓度KH2PO4处理下的12531f菌液D600nm值Fig.2 Effects of different concentrations of KH2PO4 on D600nm values of 12531f
gn5f菌液培养1~2 d时,各浓度KH2PO4处理的菌液D600nm值未显著高于CK3。3~5 d时,添加50,100和200 mg/L KH2PO4的菌液D600nm值均显著高于CK3(P<0.05),其中,5 d添加50 mg/L KH2PO4的菌液D600nm值达最大,显著高出CK 41.25%(P<0.05)。6 d时,除添加600 mg/L KH2PO4外,其他浓度处理的菌液D600nm值均显著高于CK3,其中菌液D600nm值最高的处理均为添加100 mg/L KH2PO4,显著高出CK329.31%(P<0.05)(图3)。
促进3株标记根瘤菌生长的适宜KH2PO4浓度不同,分别选出3个适宜浓度进行苗期试验,其中,3436f生长的KH2PO4适宜浓度为50,100和200 mg/L,12531f为50,100和400 mg/L,gn5f为,50,100和200 mg/L。
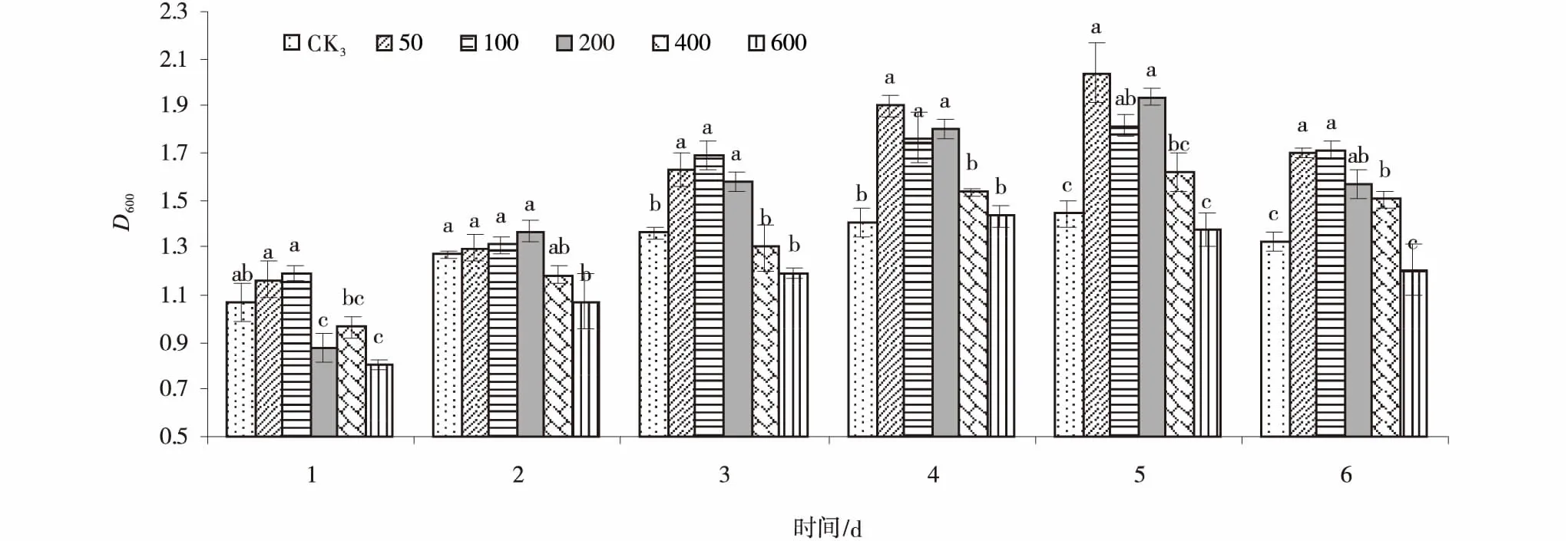
图3 不同浓度KH2PO4处理下的gn5f菌液D600nm值Fig.3 Effects of different concentrations of KH2PO4 on D600nm values of gn5f
2.2 KH2PO4对标记根瘤菌在WL343HQ紫花苜蓿体内的运移及定殖
接种5 d时,3株标记根瘤菌均可在苜蓿根系定殖,其中12531f添加100 mg/L KH2PO4接种检测到的标记根瘤菌数量显著高于其他处理,高出单独接种12531f处理202.01%(P<0.05)。试验10 d时,苜蓿根系检测到大量标记根瘤菌,3436f添加50 mg/L KH2PO4试验接种的苜蓿根系标记根瘤菌定殖数量达到最大值27 075.12 cfu/g,显著高出单独接种3436f处理1 457.84%(P<0.05),12531f添加50 mg/L KH2PO4接种的定殖数量显著高出单独接种12531f处理179.85%(P<0.05),Rzhizobium(gn5f)添加100 mg/L KH2PO4接种的定殖数量显著高出单独接种gn5f处理213.95%(P<0.05)。试验进行到15~45 d时,苜蓿根系内各标记根瘤菌仍然可以定殖,但是定殖数量逐渐减少(图4)。

图4 KH2PO4处理下WL343HQ紫花苜蓿根系内标记根瘤菌的数量Fig.4 Effect of KH2PO4 on the number of labeled rhizobia in WL343HQ alfalfa root
接种5 d时,3436f,12531f和gn5f均可运移至苜蓿茎部,CK未检测到标记根瘤菌。10 d时,运移并定殖至茎部的标记根瘤菌数量增加,3436f添加50 mg/L KH2PO4接种的苜蓿茎部标记根瘤菌定殖数量达到最大值674.55 cfu/g,显著的高出单独接种3436f处理71.23%(P<0.05),12531f添加50 mg/L KH2PO4接种的定殖数量显著高出单独接种数量12531f处理848.87%(P<0.05),gn5f添加200 mg/L KH2PO4接种的定殖数量显著高出单独接种gn5f处理498.27%(P<0.05)。15 d时,茎部标记根瘤菌定殖数量较少,在69.51 cfu/g。25 d时3436f添加50 mg/L KH2PO4接种的苜蓿体内标记根瘤菌首先运移至上部茎,定殖数量为19.20 cfu/g,35 d时12531f添加50 mg/L KH2PO4接种的苜蓿体内标记根瘤菌也运移至上部茎。45 d时,除gn5f添加200 mg/L KH2PO4接种外,其他处理和CK均未在茎内检测到标记根瘤菌(图5)。

图5 KH2PO4处理下WL343HQ紫花苜蓿茎内标记根瘤菌的数量Fig.5 Effect of KH2PO4 on the number of labeled rhizobia in WL343HQ alfalfa
5 d时,标记根瘤菌未运移至苜蓿叶部。10 d时,3436f,12531f和gn5f均可在苜蓿体内运移至叶部,其中,3436f添加50 mg/L KH2PO4接种的苜蓿叶部标记根瘤菌定殖数量为149.97 cfu/g,显著高于其他处理(P<0.05)。15 d时,gn5f添加200 mg/L KH2PO4接种的苜蓿叶部标记根瘤菌定殖数量显著高于单独接种gn5f和其他,高出单独接种gn5f处理323.99%(P<0.05)。25 d时,仅在gn5f添加200 mg/L KH2PO4接种的苜蓿下部叶内检测到标记根瘤菌。35 d时,3436f添加50 mg/L KH2PO4接种的苜蓿上部叶有根瘤菌定殖,其他处理和CK未检测到。45 d时,叶部未检测到标记根瘤菌(图6)。
标记根瘤菌运移及定殖高峰期在10 d。10 d时,3436f添加50 mg/L KH2PO4接种的苜蓿体内标记根瘤菌定殖数量在根系内为27 075.12 cfu/g,运移至茎部为674.44 cfu/g,运移至叶部为149.972 cfu/g,均显著高于其他浓度处理(P<0.05),12531f添加50 mg/L KH2PO4接种的苜蓿体内标记根瘤菌定殖数量在根系内为19 193.63 cfu/g,运移至茎部为435.53 cfu/g,均显著高于单独接种12531f处理(P<0.05),gn5f添加200 mg/L接种的茎内标记根瘤菌数量为630.01 cfu/g,显著高于其他浓度处理(P<0.05)。

图6 KH2PO4处理下WL343HQ紫花苜蓿叶内标记根瘤菌的数量Fig.6 Effect of KH2PO4 on the number of labeled rhizobia in WL343HQ alfalfa leaf
由此表明,3株标记根瘤菌均可在WL343HQ紫花苜蓿根系内定殖,添加KH2PO4有利于标记根瘤菌运移和定殖于茎、叶部。3436f在苜蓿体内运移速度较快,定殖数量较大,12531f在添加KH2PO4接种后35 d也可运移定殖于上部茎,gn5f在添加KH2PO4接种后45 d可运移定殖于上部茎,表明3株标记根瘤菌在苜蓿体内的运移及定殖规律不同。
2.3 标记根瘤菌添加KH2PO4接种对苜蓿单株结瘤数及根瘤等级
3株标记根瘤菌添加适宜浓度KH2PO4后接种可增加苜蓿幼苗单株结瘤数,提高根瘤等级(表2)。当3436f添加50 mg/L KH2PO4接种的苜蓿单株结瘤数和根瘤等级分别显著高出CK4279.04%、111.16%(P<0.05),分别显著高出单独接种3436f处理245.90%、73.85%(P<0.05),12531f添加50 mg/L KH2PO4接种的苜蓿根瘤等级显著高出CK493.13%(P<0.05)。

表2 3436f,12531f和gn5f添加KH2PO4接种处理下苜蓿 幼苗单株结瘤数及根瘤等级
注:数据为平均值±标准误,同列不同小写字母表示差异显著(P<0.05),下同
2.4 标记根瘤菌添加KH2PO4接种对苜蓿幼苗的生长
添加适宜浓度KH2PO4不仅可以促进根瘤菌在苜蓿体内的运移及定殖,还可促进幼苗生长。3436f添加50 mg/L KH2PO4接种的苜蓿单株叶片数分别显著高出CK和单独接种3436f处理75.49%、72.63%(P<0.05),株高分别显著高出CK4和单独接种3436f处理79.19%、75.32%(P<0.05),根长分别显著高出CK4和单独接种3436f处理55.23%、45.11%(P<0.05),12531f添加50 mg/L KH2PO4接种的苜蓿单株叶片数分别显著高出CK4和单独接种的12531f处理75.28%、69.50%(P<0.05),株高显著高CK452.43%(P<0.05),gn5f添加100 mg/L KH2PO4接种的苜蓿单株叶片数分别显著高出CK4和单独接种gn5f处理82.73%、103.81%(P<0.05),gn5f添加200 mg/L KH2PO4接种的苜蓿根长显著高出CK463.21%(P<0.05)(表3)。

表3 3436f,12531f和gn5f 添加KH2PO4接种处理下 苜蓿幼苗的单株叶片数、株高和根长
3株标记根瘤菌添加适宜浓度KH2PO4接种可增加苜蓿幼苗的生物量。3436f添加50 mg/L KH2PO4接种的苜蓿幼苗地上鲜重显著高出CK4和单独接种3436f处理214.29%、175.00%(P<0.05),根鲜重显著高出CK4和单独接种3436f处理238.89%、165.22%(P<0.05)。12531f添加50 mg/L KH2PO4接种的苜蓿地上鲜重显著高CK4128.57%(P<0.05),根鲜重有所增加但差异不显著(P>0.05),gn5f添加200 mg/L KH2PO4接种的苜蓿地上鲜重显著高出CK4和单独接种gn5f处理176.19%、123.08%(P<0.05),根鲜重显著高出CK4和单独接种gn5f处理222.22%、190.00%(P<0.05)。
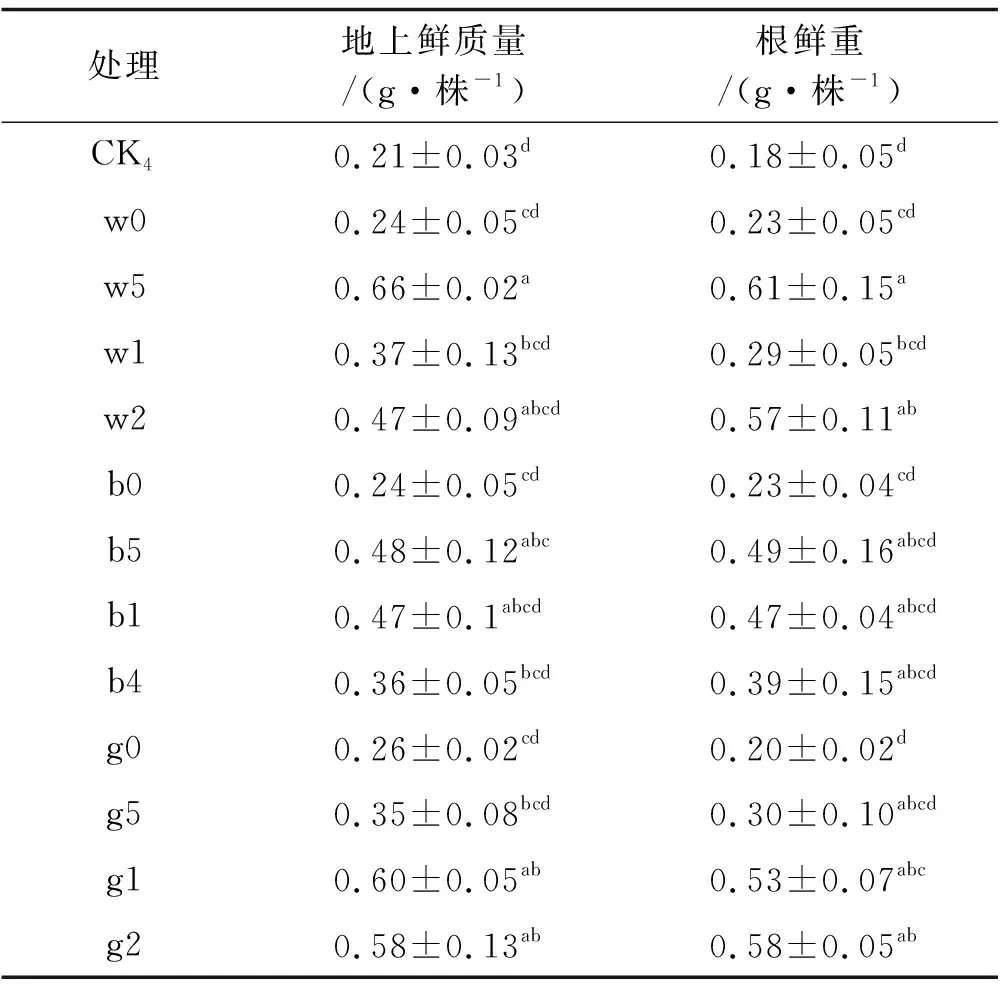
表4 3436f,12531f和gn5f 添加KH2PO4接种 处理下苜蓿的生物量
3 讨论
3.1 KH2PO4对标记根瘤菌生长及在苜蓿幼苗体内运移和定殖
磷对根瘤菌在豆科植物根际的生长、繁殖以及侵染根系、结瘤和与豆科植物共生固氮都有重要作用,曹景勤[28]在进行某些土壤因素对根瘤菌存活影响的研究发现,土壤中有效磷含量高可促进根瘤菌的存活和繁殖。试验发现,KH2PO4可促进记根瘤菌的生长,但适宜浓度不同,适宜3436f和gn5f生长的KH2PO4浓度为50,100和200 mg/L,12531f为50、100、400 mg/L,说明不同菌株对KH2PO4的敏感程度不同,这与周可等[22]进行的添加KH2PO4的培养基材料对苜蓿根瘤菌活性的影响研究结果相似。
对于根瘤菌在苜蓿幼苗体内运移及定殖的影响,已有研究表明,豆科植物与根瘤菌的共生固氮过程中必须有磷素的参与[29-32],且磷可调控根瘤菌群体感应系统,从而影响根瘤菌与根毛的识别依附,促进二者信号交流,促进根毛变形和共生结瘤[33-34]。苗阳阳等[12]在研究硼、赤霉素对根瘤菌运移与定殖的影响中发现,适宜浓度硼、赤霉素可促进幼苗体内根瘤菌的运移及定殖,同时可提高幼苗单株结瘤数、根瘤重,促进幼苗生长,但不同浓度硼、赤霉素对苜蓿各部位的根瘤菌运移及定殖影响不同,且对内生根瘤菌和外源根瘤菌的影响也不同,认为菌株不同,对硼、赤霉素的敏感性不同,生长和在促进运移时需要的硼、赤霉素浓度也不同。试验中3436f 添加50 mg/L KH2PO4后可长期大量定殖于苜蓿根系,并快速运移至茎和上部叶中;12531f 添加50 mg/L KH2PO4后可大量定殖于根系,并可运移至上部茎;gn5f添加200 mg/L KH2PO4后可稳定定殖于根系和茎内。试验结果证实菌株不同,对KH2PO4的敏感性不同,生长和在促进运移时需要的KH2PO4浓度也不同,试验中KH2PO4对根瘤菌运移和定殖的促进作用可能由于添加KH2PO4调控了根瘤菌群体感应系统,提高根瘤菌的存活和侵染能力,从而促进根瘤菌的结瘤和在苜蓿体内的运移和定殖。
3.2 标记根瘤菌添加KH2PO4接种对苜蓿幼苗生长的影响
在磷对大豆结瘤固氮和接种根瘤菌大豆的共生固氮与磷素营养的关系的研究中表明,磷可增加大豆植株的根瘤数[35-36],在大豆结瘤固氮对磷素的需求试验表明,在大豆生长初期,随着磷浓度的增加,根瘤数、根瘤干重均增加[15]。在氮、磷、钾对异果山绿豆结瘤固氮特性的研究中发现,有磷处理的植株结瘤多、根瘤大[37]。在磷与苜蓿固氮能力研究中发现,磷在苜蓿的生长和结瘤固氮过程中发挥着重要作用[38],在对不同磷水平对接种根瘤菌紫花苜蓿生长特性的试验中表明,接种根瘤菌并添加磷可促进苜蓿生长[39]。试验中标记根瘤菌添加KH2PO4接种可增加苜蓿单株结瘤数和根瘤等级,提高苜蓿的固氮能力,进而促进植株生长,提高苜蓿单株叶片数、株高、根长和生物量,其中,3436f添加50 mg/L KH2PO4接种苜蓿的处理效果最佳。
适宜浓度的KH2PO4对根瘤菌在苜蓿幼苗体内运移及定殖、苜蓿结瘤和生长均有一定的促进作用。但须正确搭配菌株种类和KH2PO4浓度。试验初步探索了KH2PO4对3株荧光标记根瘤菌在苜蓿幼苗体内运移、定殖及对幼苗生长的影响,今后继续探索KH2PO4对根瘤菌在田间苜蓿生殖生长阶段体内运移及定殖的影响,为确定利于根瘤菌在苜蓿体内运移及定殖的外源物质提供依据。
4 结论
KH2PO4可作为一种外源物质添加于根瘤菌液中,促进根瘤菌侵染结瘤,提高苜蓿单株结瘤数、根瘤等级,促进根瘤菌侵入苜蓿体内并刺激运移和定殖,其中,50 mg/L KH2PO4促使3436f长期稳定的大量定殖于苜蓿根系,并快速运移至茎和上部叶中;50 mg/L KH2PO4促使12531f大量定殖于根系,并可运移至上部茎;200 mg/L KH2PO4促使gn5f稳定定殖于根系和茎内。根瘤菌添加KH2PO4接种也可促进苜蓿生长,增加叶片数、株高、根长和生物量。结合根瘤菌运移、定殖与幼苗生长状况,筛选出标记根瘤菌株与KH2PO4浓度的最优组合为3436f+50 mg/L,12531f+50 mg/L和gn5f+200 mg/L KH2PO4。
