酶法合成右旋糖酐过程规律的研究
2018-07-17黄双霞相萍萍齐鹏翔蓝尉冰王帅静陈玉颖陈山
黄双霞,相萍萍,齐鹏翔,蓝尉冰,王帅静,陈玉颖,陈山,3*
(1.广西大学 轻工与食品工程学院,南宁 530004;2.糖业及综合利用教育部工程研究中心,南宁 530004;3.广西蔗糖产业协同创新中心,南宁 530004)
右旋糖酐(Dextran)是一种经右旋糖酐蔗糖酶催化蔗糖而产生的葡聚糖,主链由α-(1,6)糖苷键链接,同时伴有α-(1,2)、α-(1,3)或α-(1,4)糖苷键链接的侧链[1,2]。右旋糖酐的生物活性与其分子量大小及分布紧密相关,被广泛地应用于食品、医药、轻化工等领域,具有广阔的市场前景[3]。其中,大分子质量的右旋糖酐(Mw>106Da)可用作色谱柱填充剂;在食品行业中,中等分子质量的右旋糖酐(105Da<Mw<106Da)作为饮料和糕点制作中的乳化剂、稳定剂、保湿剂和增稠剂,应用于复合调味品中以提高食品的口感与风味[4,5]。此外,在烘焙食品中使用右旋糖酐可增加面包的柔软度及膨胀度,并改善面包的质地;添加到果糖糖浆以及糖果中可以阻止蔗糖结晶;并且还可以作为部分麦芽糖代替品,制作软心巧克力的填充物[6];低分子质量的右旋糖酐(104Da<Mw<105Da)适合在临床上用作血浆替代品[7,8];小分子质量的右旋糖酐(Mw<104Da)还可以用来制备右旋糖酐衍生品,作为益生元组分提高肠道内益生菌,如双歧杆菌、乳酸杆菌[9]。
目前,右旋糖酐的工业制备方法为传统的菌体发酵法,经酸水解及乙醇分级沉淀后获得不同分子量的右旋糖酐粗品,然而该法普遍存在操作步骤复杂、产物得率低及均一度不高等问题[10,11]。此外,发酵体系中含有大量菌体及其他培养基成分,致使其合成过程的规律及机理研究较难进行。酶法反应体系简单且具有专一性,可获得高含量的目标产物,副产物少并易于纯化,避免大量有机试剂的使用,广泛应用于食品添加剂、香精、香料、表面活性剂及抗生素等物质的生物合成与转化[12]。且相对于菌体发酵过程,酶法合成体系有利于对其合成过程的调控及聚合规律进行研究[13,14]。此外,作为一种糖苷水解酶,右旋糖酐酶可以专一地识别和随机地切割右旋糖酐糖链中的α-(1,6)糖苷键,因此在单酶体系中引入右旋糖酐酶,可进一步探索双酶法制备低聚右旋糖酐的过程规律[15]。本实验通过构建单酶体系和双酶体系,对酶法催化蔗糖制备不同分子量右旋糖酐的过程规律进行探索和讨论,为促进不同分子质量右旋糖酐在相关领域的应用提供理论基础和实验数据。
1 材料与方法
1.1 材料与试剂
实验所用菌株:为本实验室驯化、保藏的肠膜明串珠菌Glu-L.M.[16];右旋糖酐酶:产于细丽毛壳菌,分子量59kDa,日本田野酶制剂有限公司。
右旋糖酐系列标准品(色谱纯):美国Polymer Laboratories Ltd.;果糖、蔗糖、葡萄糖、磷酸氢二钠、磷酸二氢钾、氢氧化钠、醋酸钠、冰醋酸、硫酸、氯化钙、3,5-二硝基水杨酸(均为分析纯):国药集团化学试剂有限公司;聚乙二醇(PEG)6000(分析纯):广东光华科技股份有限公司;牛肉膏、蛋白胨、琼脂、酵母膏(生物试剂):北京陆桥技术有限责任公司。
1.2 仪器与设备
HPGFC色谱仪Aglient 1100(配有示差折光检测器 Agilent G1362A 及 Agilent GPC 数据分析软件) 美国Aglient公司;LS-B50L立式压力蒸汽灭菌器 上海华线医用核子仪器有限公司;ZHJH-1115C垂直流超净工作台、ZHWY-211B全温度恒温培养振荡器 上海智城分析仪器制造有限公司;SHP-150生化培养箱 上海精宏实验设备有限公司;Avanti J-E高效离心机 美国贝克曼库尔特有限公司;Stat Fax 2100酶标仪 美国Awareness公司;Barnstead Easy Pure LF超纯水机 美瑞泰克科技(天津)有限公司。
1.3 方法
1.3.1 右旋糖酐蔗糖酶的制备和分离纯化
复活保存在-80℃超低温冰箱的肠膜明串珠菌,接种于斜面培养基中,25℃,24h恒温培养;平板划线接种于基础固体培养基中,25℃培养24h;挑取单菌落至种子培养基中,25℃,150r/min摇床培养;对数期接种2%(V/V)至产酶培养基中(摇床培养条件同上);培养20h后将发酵液取出装入离心管中,4℃,12000r/min转速离心20min,上清液即右旋糖酐蔗糖酶粗酶液。
右旋糖酐蔗糖酶粗酶液采用课题组前期研究的双水相法进行纯化[17]。向20mL右旋糖酐蔗糖酶粗酶液中加入50%(W/W)的PEG 6000溶液,然后用无菌水补足至双水相体系的终质量为40g,充分震荡混合后放于4℃冰箱,静置12h后,4℃,12000r/min转速下离心20min,除去双水相上相中的液体,下相即为纯化后的右旋糖酐蔗糖酶酶液。
1.3.2 右旋糖酐蔗糖酶和右旋糖酐酶的酶活测定
右旋糖酐蔗糖酶是一种糖基转移酶,能催化蔗糖产生等量的D-吡喃葡萄糖基和果糖,D-吡喃葡萄糖基转移到右旋糖酐链上,而果糖分子游离于体系中。因此,酶活单位(U)定义为:在25℃催化单底物蔗糖1min内生成1μmol果糖所需的右旋糖酐蔗糖酶酶量。通常采用3,5-二硝基水杨酸(DNS法)来测定果糖含量,根据吸光度与还原糖含量的线性关系获得酶活[18]。
右旋糖酐酶能专一性地水解大分子右旋糖酐中的α(1,6)糖苷键,生成小分子还原糖。通过Hens法测定小分子还原糖含量,以此间接计算右旋糖酐酶酶活力[19]。25 ℃ 条件下,1min 内右旋糖酐酶催化Dextrant-70产生与1μmol硫代硫酸钠还原力相当的还原糖所需酶量,定义为1个酶活力单位(U)。
1.3.3 单酶体系合成右旋糖酐的建立
实验以右旋糖酐蔗糖酶和蔗糖溶液接触时开始计时,以果糖峰开始下降的前一个取样点作为聚合反应的终点[20]。底物蔗糖溶液(0.1~0.8mol/L),右旋糖酐蔗糖酶(0.1~0.6U/mL),构建反应体系的终体积为50mL,25℃,150r/min摇床培养,利用 HPGFC跟踪检测底物浓度、右旋糖酐蔗糖酶添加量对右旋糖酐的分子量及其分布、分子量片段所占比例、右旋糖酐产量及蔗糖转化率的影响规律。在两者反应18,20,22,24,26,28,30h分别对各个系列的样品进行取样。发酵产物经沸水浴灭活后,用超纯水稀释100倍,过0.45μm微孔膜,待测。
1.3.4 双酶体系合成右旋糖酐的建立
选取蔗糖浓度0.6mol/L、右旋糖酐蔗糖酶添加量0.4U/mL,在右旋糖酐酶添加量0.06U/mL时考察不同右旋糖酐酶的加入时间(0,4,8,12,16h)对反应体系中右旋糖酐的聚合影响规律;并研究右旋糖酐酶和右旋糖酐蔗糖酶的酶活比(0.08∶1,0.09∶1,0.10∶1,0.11∶1,0.12∶1)对右旋糖酐的分子量及分子量片段的调控效果,反应2,4,6,8,10,20,30h分别对各个系列的样品进行取样,样品处理方法见1.3.3。
1.3.5 HPGFC双柱串联检测下各标准曲线的绘制
色谱柱:KS-guard+KS-805+KS-801;色谱条件:安捷伦1100系统配RID示差检测器,流动相为超纯水,流速1.0mL/min,检测器温度33℃,柱温箱温度65℃,进样20μL。将分子质量分别为5900,22800,47300,112000,212000,404000,778000Da的右旋糖酐标准品,配成10mg/mL的标准品溶液,经0.45μm的微孔膜过滤,进样量20μL,每个样品平行操作3次。精确配制蔗糖、葡萄糖和果糖溶液的系列浓度,按上述色谱条件进行测样,分别获得标准曲线的拟合方程,计算相关系数R2值。
2 结果与分析
2.1 HPGFC双柱串联检测下的各拟合方程
根据右旋糖酐系列标准品的HPGFC检测结果,得到下式右旋糖酐分子量校正曲线的拟合方程:
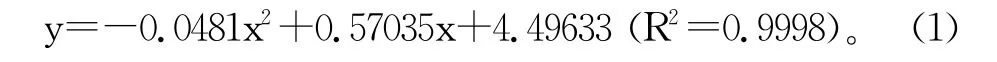
式中:y为右旋糖酐分子量的对数,x为洗脱体积(mL),R2值为0.9998。表明 HPGFC双柱串联使用能够很好地实现对产物中各个分子量右旋糖酐的测定。
蔗糖、葡萄糖及果糖标准曲线的拟合方程见表1。

表1 蔗糖、葡萄糖及果糖标准曲线的拟合方程Table 1Fitting equations of standard curves of sucrose,glucose and fructose
由表1可知,三者的R2值均大于0.99,线性相关性较好,表明蔗糖、葡萄糖及果糖浓度的定量可以有效地根据HPGFC双柱串联进行跟踪检测。
2.2 底物浓度及右旋糖酐蔗糖酶添加量对右旋糖酐分子量及分子量分布的影响
不同底物浓度(0.1~0.8mol/L)及右旋糖酐蔗糖酶加入量(0.1~0.6U/mL)对各反应体系中右旋糖酐分子量及其分布、各分子量片段所占百分比例的影响见表2。
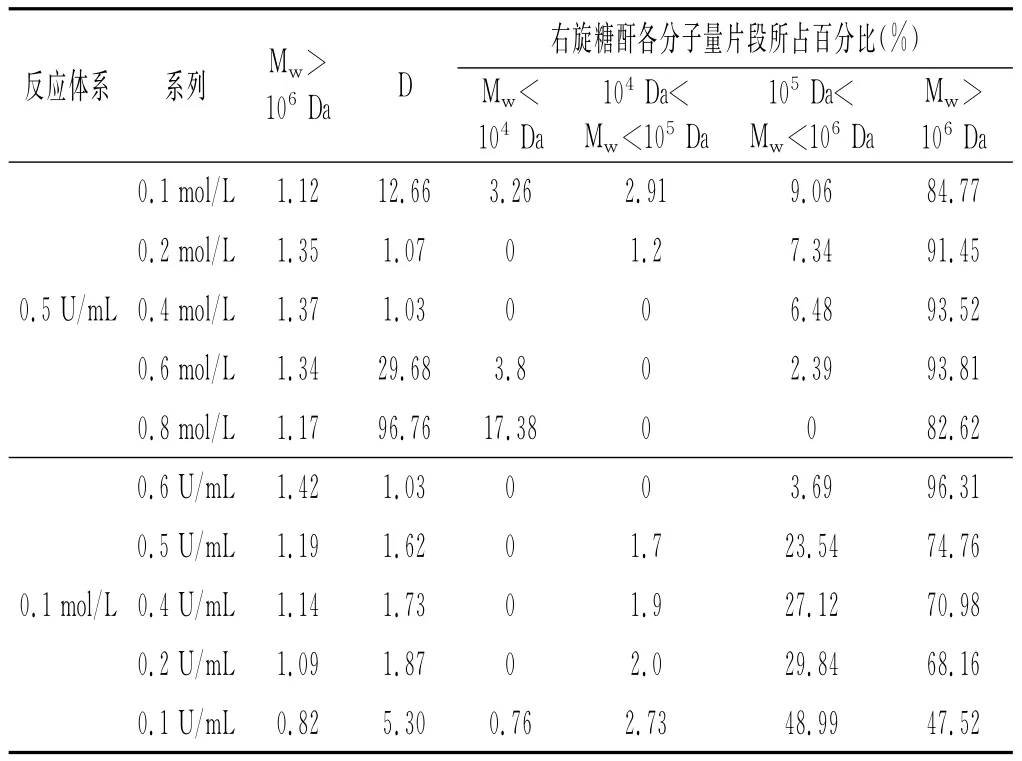
表2 不同蔗糖浓度下右旋糖酐分子量及其分布情况Table 2Molecular weight and its distribution of dextran with different sucrose concentration
同一右旋糖酐蔗糖酶添加量,右旋糖酐的分子量随着蔗糖浓度的增加先增大后减小,且分子量大小均在100万以上;Mw>106Da分子量片段所占比例较高,均在80%以上;在低蔗糖浓度(0.1~0.4mol/L)时,酶量不变,随着蔗糖浓度的升高,体系中有足够的蔗糖分子与酶分子的活性位点接触,催化产生的葡萄糖基不断链接到糖链上合成大分子量的右旋糖酐;但当高蔗糖浓度较高时(0.6~0.8mol/L),右旋糖酐分子量随蔗糖浓度的升高而降低,仅有少量Mw<104Da分子量片段合成。可能的原因是高浓度蔗糖溶液会改变合成酶活性位点的构象[21],使酶催化蔗糖聚合生成高分子量右旋糖酐的反应受到抑制,促进受体反应合成低聚糖,这与前期研究单酶耦合两级膜制备右旋糖酐反应过程中底物浓度对右旋糖酐分子量的影响规律一致。
同一底物蔗糖浓度(0.1mol/L),右旋糖酐的分子量随着右旋糖酐蔗糖酶加入量的增大而增大,其中Mw>106Da高分子量片段所占的比例随着酶加入量的增加而增加,104Da<Mw<105Da和105Da<Mw<106Da分子量片段所占比例随着酶加入量的增加而不断减少,体系几乎不产生Mw<104Da低分子量片段。可能是由于本实验蔗糖浓度相对较低,随着右旋糖酐蔗糖酶量的增加,反应体系中酶活性位点增多,使得酶催化蔗糖产生葡萄糖基的速率加快,葡萄糖基不断被转移到正在增长的右旋糖酐糖链上,使右旋糖酐分子质量不断加大,因此体系主要聚合成高分子质量的右旋糖酐[22]。
2.3 底物蔗糖浓度及右旋糖酐蔗糖酶添加量对右旋糖酐产量及蔗糖转化率的影响
分别研究不同底物浓度下(0.1~0.8mol/L)和不同右旋糖酐蔗糖酶的加入量(0.1~0.6U/mL)对反应体系中蔗糖转化率及右旋糖酐产量的影响规律,见表3。
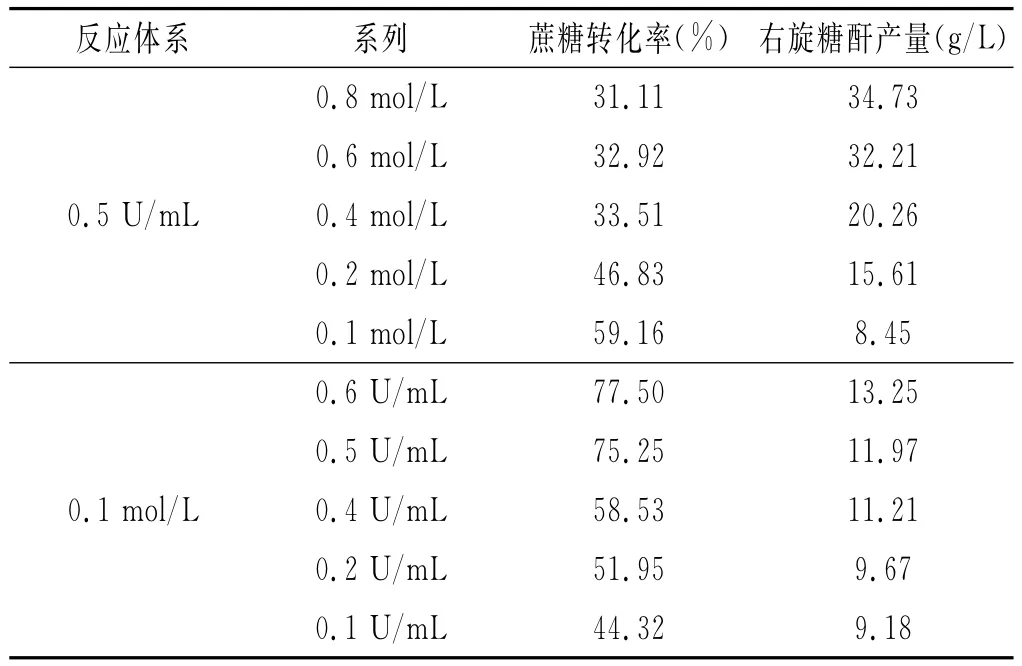
表3 不同右旋糖酐蔗糖酶加入量及蔗糖浓度条件下蔗糖转化率和右旋糖酐得率的变化Table 3Effect of dextransucrase additive amount and sucrose concentration on the conversion rate of sucrose and yield of dextran
在右旋糖酐蔗糖酶加入量不变的情况下,当蔗糖浓度从0.1mol/L增大至0.8mol/L时,蔗糖的转化率随底物蔗糖浓度的增大整体呈下降趋势,而右旋糖酐产量随底物蔗糖浓度的增大而逐渐上升。可能是因为底物浓度较低时,体系内右旋糖酐蔗糖酶加入量(0.5U/mL)相对充足,酶分子能催化大部分底物蔗糖而使其转化率高,但继续增大底物浓度时,相对酶分子量减少,酶催化速率降低,并且高浓度蔗糖溶液抑制右旋糖酐的合成,因此使蔗糖转化率也降低。此外,在一定范围内,右旋糖酐的产量与底物浓度呈正相关,适应增加底物浓度有助于提高右旋糖酐的产量。所以通过增加底物浓度并不能提升蔗糖的转化率,但相对于低浓度底物蔗糖溶液,增加底物浓度可以相对地提高产量。
在底物蔗糖溶液不变的情况下,蔗糖的转化率与右旋糖酐产量均随着右旋糖酐蔗糖酶加入量的增加而增加,呈现正相关关系。由酶促反应机制可知,酶浓度与反应速率成正比,酶加入量越多,体系中相对的酶活性位点也越多,催化蔗糖的能力越强。底物蔗糖溶液不变时,增加酶量使合成反应持续进行且反应相对完全,则蔗糖的转化率和右旋糖酐的产量也越大。但由于体系中蔗糖浓度(0.1mol/L)较低,因此聚合而成的右旋糖酐含量也相对较少。
2.4 右旋糖酐酶的介入时间对右旋糖酐分子量及分子量片段的调控作用
由2.1研究可知,单酶体系中合成的产物右旋糖酐分子量均在百万级别(Mw>106Da),在一定范围内通过设置不同的参数变化也很少获得中小分子量的右旋糖酐,因此单酶体系难以有效地调节右旋糖酐的分子量及其分布,同时也看出单酶法制备特定分子量右旋糖酐的瓶颈。因此,在单酶反应体系的基础上引入右旋糖酐酶(分解酶),通过右旋糖酐酶的特性达到调控产物右旋糖酐聚合过程的目的,更深一步探讨双酶合成过程中两种酶对右旋糖酐聚合过程的影响规律。
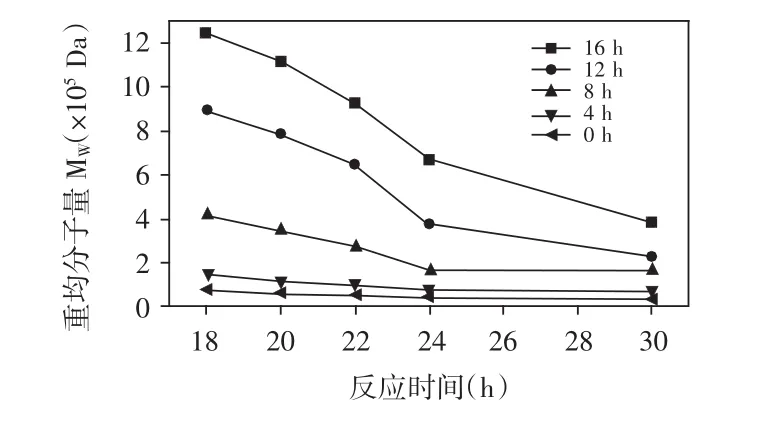
图1 不同时间下加入右旋糖酐酶对右旋糖酐分子量的影响Fig.1Effect of dextranase at different intervention time on the molecular weight of dextran
由图1可知,随着介入时间的增大,双酶体系各系列聚合的右旋糖酐分子量呈现不断升高的趋势,但总体上产物右旋糖酐分子量要小于单酶法合成的右旋糖酐分子量。由于样品数量较多,右旋糖酐酶介入时间最长为16h,为了更好地研究右旋糖酐酶不同介入时间对反应过程的影响规律,以18h之后取样为代表。右旋糖酐蔗糖酶和右旋糖酐酶同时间加入时,反应中产物右旋糖酐的整体平均分子质量最低,随着反应的进行分子质量降低趋势平缓;而同一反应时间下,随着右旋糖酐酶介入时间的延长,最终合成的右旋糖酐分子质量不断增加。同时将两种酶加入体系对右旋糖酐的分子质量控制最明显,适合制备分子量小于105Da的代血浆用品及益生元;而加入时间为4~16h时主要合成分子量在105~106Da范围内的右旋糖酐产品,主要作为食品调味品、添加剂使用。在反应过程中,右旋糖酐蔗糖酶和右旋糖酐酶两者共同作用,右旋糖酐蔗糖酶发挥聚合作用合成高分子质量右旋糖酐后,右旋糖酐酶则利用分解能力立即对其进行降解,使体系中大分子右旋糖酐的分子质量不断降低。因此,右旋糖酐酶从反应一开始就发挥了分解作用,中断了右旋糖酐多链不断延伸的过程,体系中糖链混合物的平均分子量整体处于较低水平且变化平缓,趋向于合成低聚右旋糖酐。
分子量变化曲线的斜率也可以间接地反映右旋糖酐酶的分解催化速率,右旋糖酐酶加入到单酶体系中的时间越晚,体系中右旋糖酐蔗糖酶催化蔗糖生成的右旋糖酐分子量越大,而右旋糖酐酶切断右旋糖酐糖链的α-(1,6)糖苷键的速率越快,因此右旋糖酐酶对右旋糖酐的亲和性与其分子量呈正相关;同时,曲线的变化说明后加入右旋糖酐酶的反应体系降解作用不完全。但是因为右旋糖酐蔗糖酶合成过程中除了生成产物右旋糖酐,体系中还有底物蔗糖、副产物葡萄糖、果糖,由单酶实验可知反应进行到一定阶段时,右旋糖酐蔗糖酶作为一种复合酶不再专一的聚合葡萄糖单元,而会聚合果糖单元形成低聚果糖,所以不适合延长反应时间。由于右旋糖酐酶的降解作用,双酶法合成的右旋糖酐平均分子质量比单酶合成的降低了一个数量级以上,改变了反应体系中不断聚合形成大分子量片段右旋糖酐的途径。
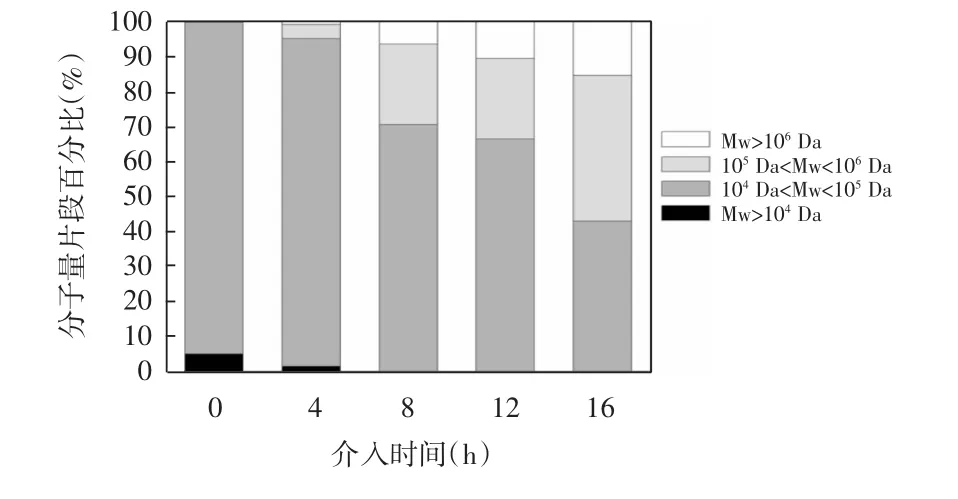
图2 不同时间下加入右旋糖酐酶对右旋糖酐分子量片段的影响Fig.2Effect of dextranase at different intervention time on the molecular weight distribution of dextran
由图2可知,右旋糖酐酶加入到体系中的时间越晚,中等分子量片段(105Da<Mw<106Da)和大分子量片段(Mw>106Da)所占比例越大,低分子量片段(Mw<105Da)所占比例越小;当反应体系同时加入两种酶时,低分子量片段(104Da<Mw<105Da)的比例占94.76%,且仅存在少量大于105Da和小于104Da的分子量片段,证明双酶同时作用时更有利于合成低分子量右旋糖酐。随着介入时间的缩短,中等分子量片段(104Da<Mw<105Da)和大分子量片段(Mw>106Da)所占比例不断减少,说明右旋糖酐蔗糖酶催化蔗糖聚合产生的大分子量右旋糖酐释放到体系后,会被优先地随机切割,降解为小分子量片段。根据2.1可知,单酶体系的中小分子量片段右旋糖酐所占比例极少,但引入右旋糖酐酶后其所占比较逐渐增加,证明通过调控右旋糖酐酶的作用时间可制备不同分子量的右旋糖酐。
2.5 双酶酶活比对右旋糖酐分子量及分子量片段的影响

图3 双酶酶活比对右旋糖酐分子量的影响Fig.3Effect of different enzyme activity ratios on the molecular weight of dextran
由图3可知,整体上右旋糖酐分子量随着双酶酶活比的增大而减小。体系中的右旋糖酐酶优先对产物大分子量右旋糖酐进行酶降,从而使其分解为小分子量右旋糖酐;而右旋糖酐酶的添加量越多,对右旋糖酐糖链的降解机会也就越多,因此整体上产物右旋糖酐分子量减小。同时,在不同双酶酶活比的反应体系中,合成的右旋糖酐分子量在反应前8h均不断上升,之后分子量开始呈现下降趋势,说明双酶体系中反应前期以右旋糖酐蔗糖酶的聚合作用为主,而反应后期以右旋糖酐酶分解作用为主。因此,双酶法合成右旋糖酐可获得分子量比单酶法小一个数量级以上的右旋糖酐,实现了对右旋糖酐总体分子质量的控制。
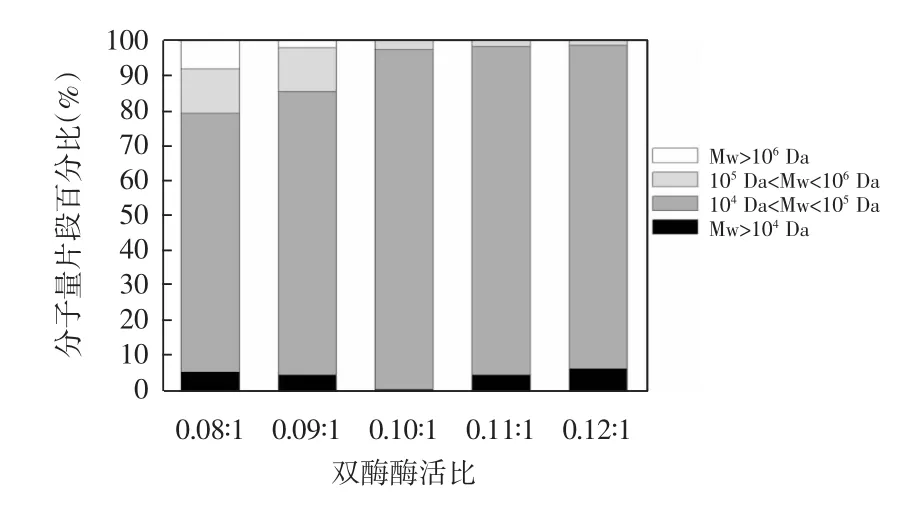
图4 双酶酶活比对右旋糖酐各分子量片段的影响Fig.4Effect of different enzyme activity ratios on the molecular weight distribution of dextran
由图4可知,随着双酶酶活比的增加,中等分子量片段(105Da<Mw<106Da)右旋糖酐逐渐降低,而低分子量片段(104Da<Mw<105Da)右旋糖酐先增加后降低。当双酶酶活比为0.08∶1时,体系存在较多中大分子量片段和小分子量片段右旋糖酐。在双酶酶活比为0.10∶1时,低分子量片段右旋糖酐(104Da<Mw<105Da)所占比例最大,达到96.63%,此时样品中大分子质量右旋糖酐在右旋糖酐酶的酶解作用下大部分被随机切割,而小分子质量右旋糖酐链不断延长,体系向104Da<Mw<105Da分子量片段这一区域集中。但双酶酶活比超过0.10∶1后,右旋糖酐酶分解能力增加,体系中小分子质量右旋糖酐(Mw<104Da)所占比例上升。因为酶活比增大使反应体系的降解能力加强,右旋糖酐酶接触右旋糖酐链的机会变多,使右旋糖酐链不断被分解成低分子量质量右旋糖酐。对比单酶体系反应结果可知,产物右旋糖酐的分子量片段在104Da<Mw<105Da这一区间集中的原因是右旋糖酐蔗糖酶与右旋糖酐酶共同作用的结果,两者相互竞争和促进作用使高分子质量右旋糖酐实现了聚合物降解和生物功能化,制备出利用价值高和经济效益好的右旋糖酐产品。
3 结论
通过构建单酶体系及双酶体系合成产物右旋糖酐,以探索酶法合成不同分子量右旋糖酐的过程规律。结果表明:在单酶体系中,右旋糖酐分子量随着底物蔗糖浓度的增加先增大后减小,随着右旋糖酐蔗糖酶加入量的增大而增大;且右旋糖酐产量与蔗糖浓度和右旋糖酐蔗糖酶添加量呈正相关;蔗糖转化率随蔗糖浓度增大而减小,随着右旋糖酐蔗糖酶加入量的增加而增大;但单酶法合成的右旋糖酐分子量较大,大多集中100万以上,低分子量片段右旋糖酐所占比例极少,主要适合大分子质量右旋糖酐的合成。在此基础上引入右旋糖酐酶构建双酶体系,发现随着右旋糖酐酶介入时间的缩短,整体上聚合的右旋糖酐分子质量呈现不断降低的趋势,同时间加入右旋糖酐酶和右旋糖酐蔗糖酶更有利于合成低聚右旋糖酐;随着右旋糖酐酶加入时间的延长,中等分子量片段(105Da<Mw<106Da)和大分子量片段(Mw>106Da)右旋糖酐所占比例越大,而低分子量片段(104Da<Mw<105Da)右旋糖酐所占比例降低。在蔗糖浓度0.6mol/L、双酶酶活比为0.10∶1时,分子量片段(104Da<Mw<105Da)右旋糖酐所占比例最大,达到96.63%。实验表明右旋糖酐蔗糖酶与右旋糖酐酶的竞争与协同作用可有效地调控产物右旋糖酐分子量,为合成符合食品调味品、添加剂及医药等不同领域需求的右旋糖酐产品奠定了理论基础。
