饲料组胺水平对黄颡鱼生长性能、血清生化指标和胃肠道黏膜结构的影响
2018-07-16吴代武叶元土蔡春芳罗其刚浦琴华
何 杰 吴代武 叶元土* 蔡春芳 吴 萍 罗其刚 浦琴华
(1.苏州大学基础医学与生物科学学院,苏州 215123;2.浙江一星实业股份有限公司,海盐 314300)
鱼粉与其他陆生动物蛋白质、植物蛋白质原料的主要差异之一就是含有较多的生物胺(biogenic amine)。鱼粉中生物胺含量一直以来被作为新鲜度的控制指标之一[1]。组胺(histamine)是生物胺中的一种,组胺是游离的组氨酸经微生物的组胺脱羧酶作用而产生[2],其在鱼粉中含量的高低,是评价鱼粉新鲜度质量的重要指标[3]。有报道称,海产鲭科鱼类中含量最多且最主要的生物胺是组胺,金枪鱼作为红色肌肉种类,金枪鱼鱼粉组胺含量较白鱼粉高[4-5],Takagi等[6]发现红鱼粉中的组胺含量相比于白鱼粉中的组胺含量更高。有研究表明,在毒性剂量下组胺可引起鸡[7]、猪[8]、水貂[9]、小鼠[10]等的毒性反应,尤其是对胃黏膜有损伤作用。在水产动物饲料中,组胺对不同养殖种类生长、生理代谢等的作用有较大的差异,尤其是对胃肠道黏膜的作用、并是否引起“吐料”一直是关注的重点内容之一。黄颡鱼(Pelteobagrusfulvidraco)是一种有胃的肉食性鱼类,其体色也容易受到多种因素的影响而发生变化。本试验以黄颡鱼为研究对象,研究饲料组胺水平对黄颡鱼生长性能、血清生化指标和胃肠道黏膜结构的影响,旨在为饲料组胺的适宜添加水平提供理论依据。
1 材料与方法
1.1 饲料原料与试验饲料
试验用的金枪鱼鱼粉为厄瓜多尔生产的金枪鱼鱼粉,其主要营养组成(干物质基础)为:粗蛋白质74.97%、粗脂肪7.88%、粗灰分11.04%、水分7.54%、组胺226.8 mg/kg;白鱼粉为俄罗斯白鱼粉,其主要营养组成(干物质基础)为:粗蛋白质67.18%、粗脂肪9.07%、粗灰分20.31%、水分7.44、组胺39.6 mg/kg。
以白鱼粉为对照,参照黄颡鱼的营养需要和实用饲料营养指标,选用组胺二盐酸盐(C5H9N3·2HCl,组胺含量60.30%,美国Sigma公司产品)为组胺原料,设置白鱼粉饲料(H0)、金枪鱼鱼粉饲料(TFM)和白鱼粉饲料中分别添加5个水平组胺的试验饲料(H1、H2、H3、H4、H5),共7种试验饲料。饲料组胺水平分别为53.20、4.30、18.00、56.20、84.60、103.50、158.90 mg/kg。试验饲料组成及营养水平见表1。
各饲料原料粉碎过60目筛,采取逐级稀释法将组胺等混合均匀,用饲料机制成粒径为1.5 mm,长2~3 mm的颗粒饲料,空气干燥,4 ℃冰箱中保存备用。各组饲料等氮、等脂(粗蛋白质含量为40.28%~40.32%,粗脂肪含量为8.21%~8.23%)。各组饲料生物胺种类和含量由新希望六和测试中心采用液相色谱法分析,饲料的尸胺、精胺、亚精胺、腐胺和组胺含量的实测值见表1。
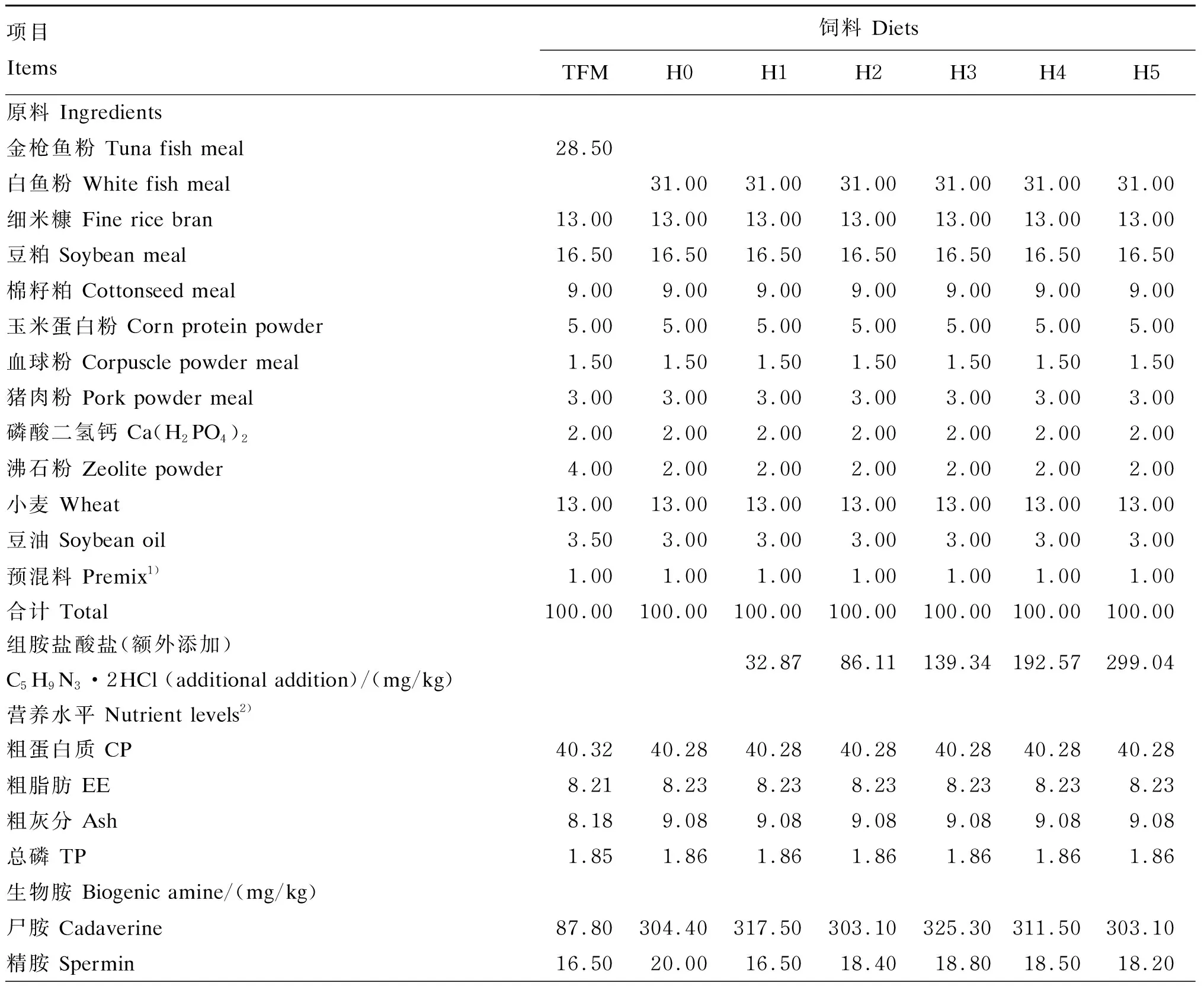
表1 试验饲料组成及营养水平(干物质基础)
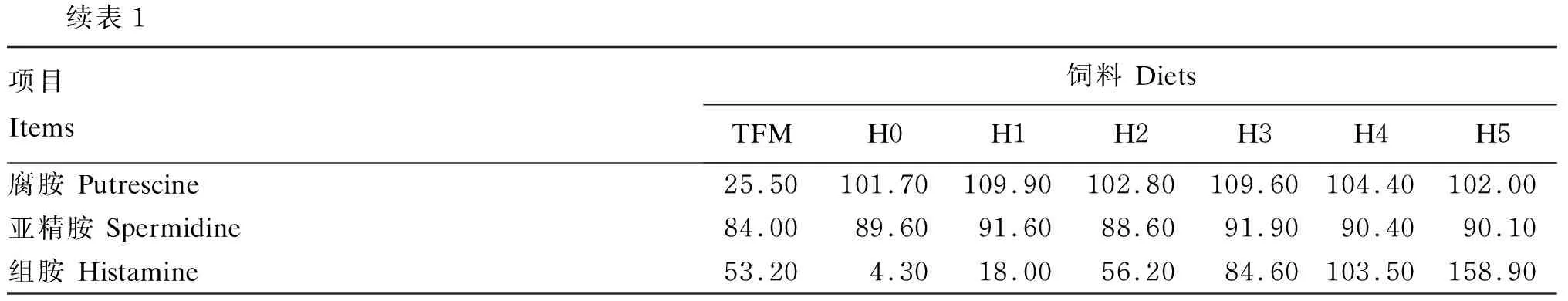
续表1项目 Items饲料 DietsTFMH0H1H2H3H4H5腐胺 Putrescine25.50101.70109.90102.80109.60104.40102.00亚精胺 Spermidine 84.0089.6091.6088.6091.9090.4090.10组胺 Histamine 53.204.3018.0056.2084.60103.50158.90
1)预混料为每千克饲料提供 The premix provided the following per kg of diets:Cu 25 mg,Fe 640 mg,Mn 130 mg,Zn 190 mg,I 0.21 mg,Se 0.7 mg,Co 0.16 mg,Mg 960 mg,K 0.5 mg,VA 8 mg,VB18 mg,VB28 mg,VB612 mg,VB120.02 mg,VC 300 mg,VD33 mg,VK35 mg,泛酸钙 calcium pantothenate 25 mg,烟酸 niacin 25 mg,叶酸 folacin 5 mg,肌醇 inositol 100 mg
2)营养水平为实测值。Nutrient levels were measured values.
1.2 试验设计及饲养管理
选取浙江一星养殖基地池塘培育的1冬龄、规格整齐、健康、体质量为(30.08±0.35) g的黄颡鱼鱼种420尾,随机分成7组,每组3个重复,每个重复(网箱)20尾鱼,各组分别投喂金枪鱼鱼粉饲料(TFM组)、白鱼粉饲料(H0组,作为对照组)以及白鱼粉饲料中分别添加5个组胺水平的试验饲料(H1、H2、H3、H4和H5组)。试验期60 d。
养殖试验在浙江一星养殖基地池塘网箱中进行,在面积为40 m×60 m的池塘中设置试验网箱(规格为1.0 m×1.5 m×1.5 m),以海盐县长山河为水源,池塘中设置1台1.5 kW的叶轮式增氧机,每天运行12 h。试验鱼网箱驯化适应2周后开始正式投喂。日投喂2次(07:00、16:00),日投喂量为鱼体质量的3%~5%,每10 d估算1次鱼体增重量并调整饲料投喂量。养殖期间池塘水温24.1~36.0 ℃,溶解氧浓度>7.0 mg/L,pH 8.0~8.4,氨氮浓度<0.10 mg/L,亚硝酸盐浓度<0.005 mg/L,硫化物浓度<0.05 mg/L。
1.3 样品采集与分析
养殖试验结束时,禁食24 h后,记录每个网箱鱼尾数、总重,计算成活率(survival rate,SR)、特定生长率(specific growth rate,SGR)。每个重复随机取3尾鱼作为全鱼样品,用于全鱼体成分的测定。
每个网箱随机取5尾鱼,自尾柄静脉采血待自然凝固后,3 000 r/min、4 ℃条件下离心10 min,取上层血清,每个网箱的血清混合为1个样品,液氮速冻后于-80 ℃冰箱保存,用于血清指标的测定。
每个网箱随机取5尾鱼解剖后称量内脏团、肝胰脏用于计算肥满度(condition factor,CF)、肝体比(hepatosomatic index,HSI)、脏体比(viscero-somatic index,VSI)。每个试验组选取6尾鱼体取体侧皮肤,用于类胡萝卜素和叶黄素的测定;同时取黄颡鱼的胃黏膜(胃底部)、肠道黏膜(肠道1/2处的黏膜),用鱼用生理盐水清洗,戊二醛固定,用于扫描电镜和透射电镜,观察胃黏膜表面特征和肠道黏膜细胞之间细胞连接结构。
样品鱼经绞碎机绞碎后,用LGJ-18B型冷冻干燥机干燥至恒重测定水分,得到冷冻干燥样品;采用凯氏定氮法(GB/T 5009.5—2010)测定粗蛋白质含量;采用索氏抽提法(GB/T 14772—2008)测定粗脂肪含量;采用GB/T 5009.4—2010中方法测定粗灰分含量;血清谷草转氨酶(AST)、谷丙转氨酶(ALT)活性及高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总蛋白(TP)、白蛋白(ALB)、总胆汁酸(TBA)、总胆固醇(TC)和甘油三酯(TG)含量采用雅培C800全自动生化分析仪测定。皮肤类胡萝卜素和叶黄素含量的测定参考AOAC 970.64的方法测定。胃黏膜表面结构采用扫描电镜观察,肠道黏膜细胞之间紧密连接结构采用透射电镜观察。
1.4 计算方法
特定生长率(%/d)=100×(lnWt-lnWi)/t;
饲料系数(feed conversion ratio,FCR)=
Wa/(W1-W0);
蛋白质沉积率(protein retention rate,PRR,%)=
100×(P1-P0)/Wp;
脂肪沉积率(fat retention rate,FRR,%)=
100×(F1-F0)/Wf;
肥满度(%)=100×W/L3;
肝体比(%)=100×Wh/W;
脏体比(%)=100×Wv/W;
类胡萝卜素含量(mg/kg)=(A×K×V)/(E×G);
叶黄素含量(mg/kg)=A474×1000×f/236×b×d。
式中:Wt、Wi分别为终末均重(g)、初始均重(g);t为饲养天数(d);W1、W0分别为终末总体质量(g)、初始总体质量(g);Wa为投喂饲料总质量(g);P1、P0分别为终末体蛋白质质量(g)、初始体蛋白质质量(g);Wp为蛋白质摄入总质量(g);F1、F0分别为终末体脂肪质量(g)、初始体脂肪质量(g);Wf为脂肪摄入总质量(g);W为鱼体质量(g);Wv为鱼体内脏团质量(g);Wh为鱼体肝胰脏质量(g);L为鱼体长(cm);A为吸光度;K为稀释倍数;V为提取液体积(mL);E为摩尔消光系数;G为样品重量(g);b为比色池的长度(cm);f为仪器误差;A474为被观察的波长474 nm下的光密度值;d为稀释系数。
1.5 数据处理与分析
采用SPSS 18.0对所得数据用one-way ANOVA程序进行单因素方差分析,用Duncun氏法多重比较分析组间差异。试验数据结果均以样本平均值±标准误表示,显著性水平设置为0.05。
2 结果与分析
2.1 饲料组胺水平对黄颡鱼生长性能、体成分和形体指标的影响
由表2可见,各组黄颡鱼初均重无显著差异(P>0.05)。H1组黄颡鱼的末均重、特定生长率显著高于H0、H2、H3和H4组(P<0.05),而其他各组之间无显著差异(P>0.05)。H1组黄颡鱼的的蛋白质沉积率和脂肪沉积率高于其他各组(P<0.05),其他各组之间的蛋白质沉积率和脂肪沉积率无显著差异(P>0.05)。在黄颡鱼的成活率方面,TFM、H3、H4和H5组与H0、H1和H2组相比,显著下降了19.17%~24.17%(P<0.05)。由于养殖试验是在池塘网箱中进行的,无法收集残饵,所以黄颡鱼的FCR结果的是按照实际投喂量计算的,导致本试验结果中的FCR与实际生产的数据有一定的差异。
各组黄颡鱼的肥满度无显著差异(P>0.05)。H1组黄颡鱼的脏体比显著高于TFM、H2、H3、H4、H5组(P<0.05),但是TFM、H2、H3、H4和H5组之间无显著差异(P>0.05)。H0组黄颡鱼的肝体比显著高于TFM组(P<0.05),其余各之组间无显著差异(P>0.05)。
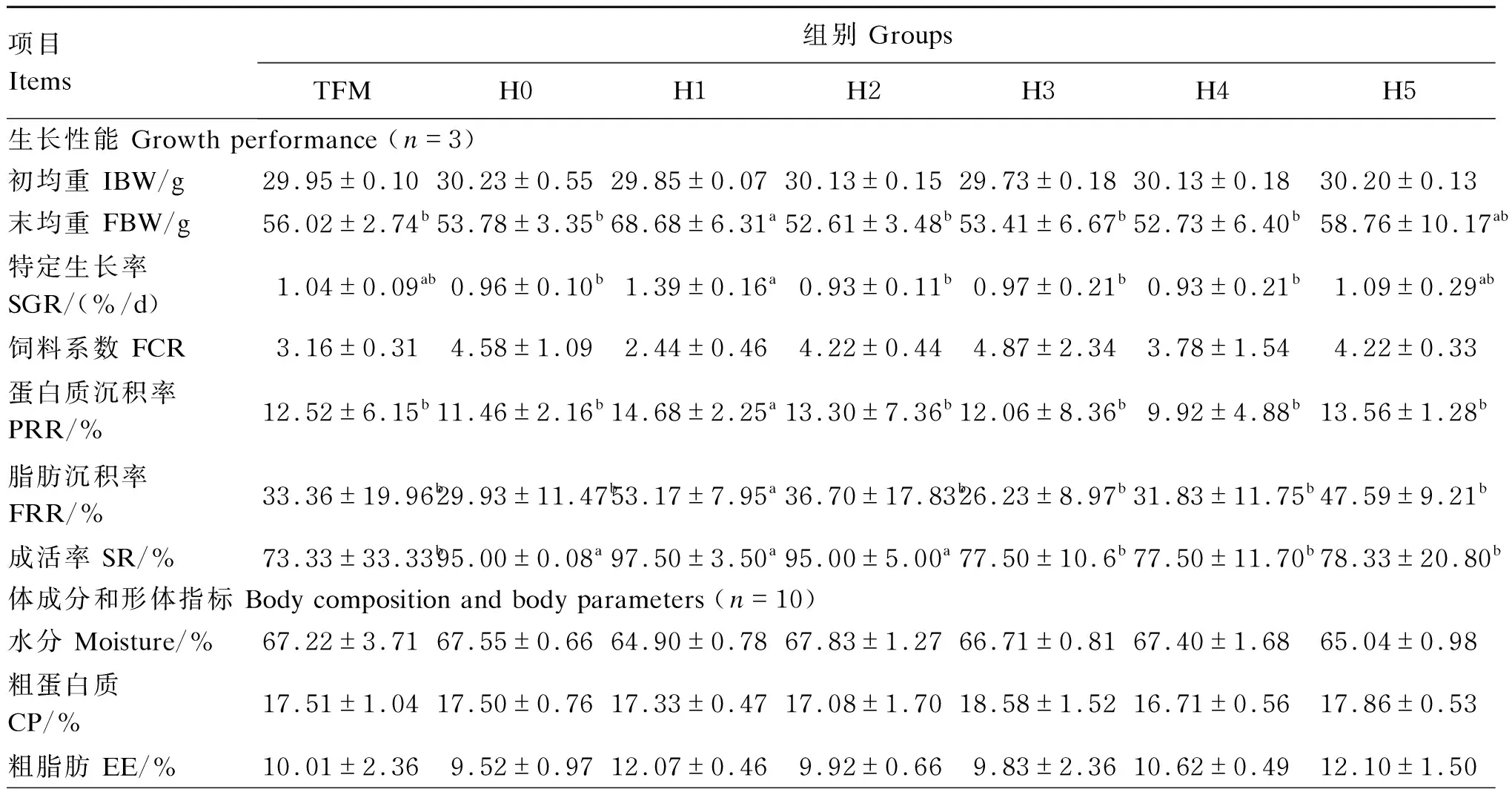
表2 饲料组胺水平对黄颡鱼生长性能、体成分和形体指标的影响
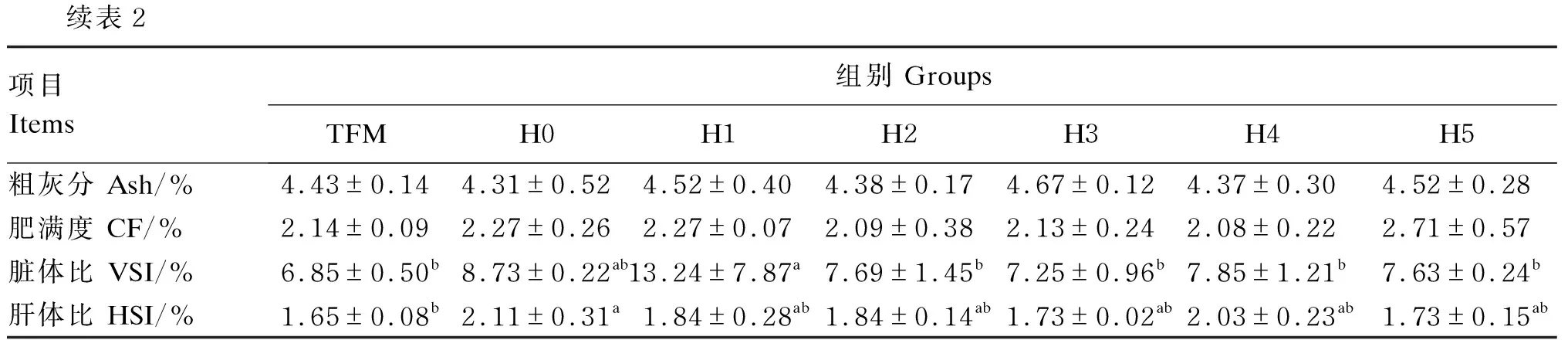
续表2项目 Items组别 GroupsTFMH0H1H2H3H4H5粗灰分 Ash/%4.43±0.144.31±0.524.52±0.404.38±0.174.67±0.124.37±0.304.52±0.28肥满度 CF/%2.14±0.092.27±0.262.27±0.072.09±0.382.13±0.242.08±0.222.71±0.57脏体比 VSI/%6.85±0.50b8.73±0.22ab13.24±7.87a7.69±1.45b7.25±0.96b7.85±1.21b7.63±0.24b肝体比 HSI/%1.65±0.08b2.11±0.31a1.84±0.28ab1.84±0.14ab1.73±0.02ab2.03±0.23ab1.73±0.15ab
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
将黄颡鱼特定生长率与饲料组胺水平作图(图1),黄颡鱼特定生长率与饲料组胺水平显示出二次函数关系的变化趋势。
上述结果表明,与白鱼粉比较,金枪鱼鱼粉对黄颡鱼的生长速度和饲料效率没有显著差异;而饲料组胺水平对黄颡鱼的生长速度和饲料效率显示出二次函数变化趋势,在低饲料组胺水平(18.00 mg/kg)条件下具有较好的生长速度,而较高饲料组胺水平条件下显示出对生长的抑制作用。饲料组胺水平对黄颡鱼的体成分没有显著影响。
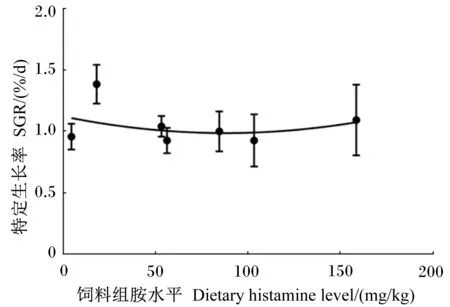
图1 黄颡鱼特定生长率与饲料组胺水平的关系
2.2 饲料组胺水平对黄颡鱼血清生化指标的影响
由表3可见,各组黄颡鱼的血清总蛋白和高密度脂蛋白含量无显著差异(P>0.05)。H3组黄颡鱼的血清葡萄糖含量显著高于TFM、H4和H5组(P<0.05);H1和H2组黄颡鱼的血清葡萄糖含量略微低于H3组,但差异不显著(P>0.05)。H0组黄颡鱼的总胆汁酸含量显著高于其他各组(P<0.05),H4和H5组黄颡鱼的总胆汁酸含量显著低于其他各组(P<0.05)。各组黄颡鱼的血清总胆固醇含量无显著差异(P>0.05)。TFM、H3、H4组黄颡鱼的血清低密度脂蛋白含量显著高于H0、H1、H5组(P<0.05)。
上述结果表明,各组黄颡鱼血清内环境显示出一定的差异,天门冬氨酸氨基转移酶活性、低密度脂蛋白含量有增加的趋势,显示肝胰脏结构和功能可能受到饲料组胺水平的一定影响;值得注意的是血清总胆汁酸含量随饲料组胺水平增加而显著下降,表明鱼体胆汁酸的肠-肝循环可能受到损伤性影响。
2.3 饲料组胺水平对黄颡鱼皮肤色素含量的影响
由表4可见,各组黄颡鱼体侧皮肤2种色素含量没有显著性差异(P>0.05)。这表明,金枪鱼鱼粉、饲料组胺含量并未对黄颡鱼的体色产生显著性的影响。
2.4 黄颡鱼胃黏膜细胞的扫描电镜观察
各组黄颡鱼胃黏膜的扫描电镜观察结果如图2。扫描电镜观察到的是胃黏膜的表面结构,从图中可以观察到,H0和H1组的黄颡鱼胃黏膜细胞正常,细胞界线清晰,细胞排列紧密;H2和H3组在图中箭头处有少数细胞破裂,其他部位较为完整;TFM、H4和H5组的胃黏膜细胞损伤严重。
上述结果显示,饲料高组胺水平(大于103.50 mg/kg)对黄颡鱼胃黏膜表面结构有较为严重的损伤,损伤程度随饲料中组胺水平增加而加重。饲料组胺水平较高的TFM组虽然生长速度与H0组无显著差异,但鱼体胃黏膜细胞则受到较为明显的损伤。
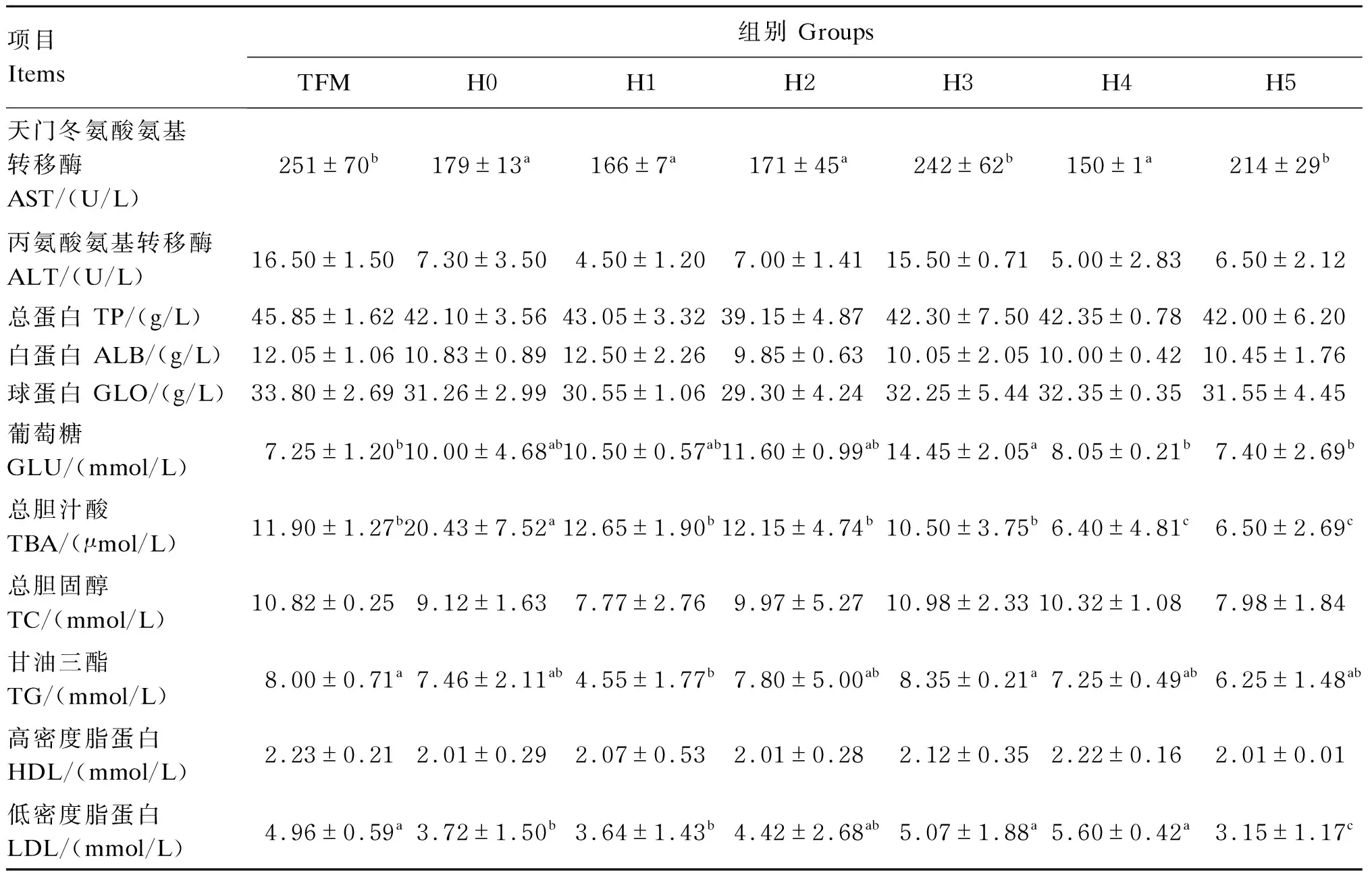
表3 饲料组胺水平对黄颡鱼血清生化指标的影响
表4 饲料组胺水平对黄颡鱼皮肤色素含量的影响(干物质基础)
2.5 黄颡鱼肠道黏膜细胞之间紧密连接结构的透射电镜观察
各组黄颡鱼肠道黏膜细胞之间紧密连接结构的透射电镜观察结果见图3。肠道黏膜细胞之间的连接有紧密连接、缝隙连接等结构,在靠近微绒毛端的细胞之间的连接为紧密连接结构,而靠近黏膜基底层端的连接为缝隙连接结构。从图中可以观察到,以白鱼粉为蛋白质源的H0组,黏膜细胞之间的连接结构较为紧密,细胞之间没有出现缝隙;H1组的细胞之间的连接结构与H0组基本一致;从H2组开始,在微绒毛端和基底层端逐渐出现细胞之间的缝隙,显示黏膜细胞之间的连接结构受到损伤,且这种损伤的程度即缝隙的间隙大小随饲料组胺水平的增加有逐渐增大的趋势。
上述结果显示,饲料组胺水平对黄颡鱼肠道黏膜细胞之间的紧密连接结构有一定的损伤作用,损伤程度与饲料组胺水平有一定的线性关系。

A:H0组;B:H1组;C:H2组;D:H3组;E:H4组;F:H5组;G:TFM组。下图同。←示意细胞损伤。放大倍数均为×1 500,最小刻度(右下)30.0 μm。
A: H0 group; B: H1 group; C: H2 group; D: H3 group; E: H4 group; F: H5 group; G: TFM group. The same as below. The ← indicated the cell damage. The magnification was ×1 500, and the minimum scale (lower right) was 30.0 μm.
图2黄颡鱼胃黏膜细胞的扫描电镜观察
Fig 2Scanning electron microscope observation of gastric mucosa cells of yellow catfish

示意微绒毛端连接,示意靠近黏膜基底层端连接。放大倍数均为20 000×,最小刻度200 nm。
The indicated the junctions of microvill end, and theindicated the junctions near the base layer of the mucous membrane. The magnification was 20 000×, and the minimum scale was 200 nm.
图3黄颡鱼肠道黏膜细胞之间紧密连接结构的透射电镜观察
Fig.3Transmission electron microscope observation of tight junction between intestinal mucosa cell of yellow catfish
3 讨 论
3.1 饲料组胺水平对黄颡鱼生长性能、血清生化指标及皮肤色素含量的影响
组胺是游离组氨酸在脱羧酶作用下脱去羧基后的产物。捕捞的鱼类与其他动物一样,在死亡之后有一个僵硬、软化、自溶、腐败的过程。鱼体的软化、自溶主要依赖体内消化系统和细胞溶酶体中的酶水解蛋白质,产生较多的游离氨基酸,也可以得到游离的组氨酸。不同种类的鱼组织中组氨酸含量有较大的差异,如红肉鱼与白肉鱼相比较,红肉鱼含丰富的组氨酸,可以达到7~18 mg/g,而白肉鱼只有0.1 mg/g。在腐败过程中,微生物得到繁殖,并产生脱羧酶作用于游离的组氨酸,由此产生较多的组胺,组胺的产生主要是在腐败过程中由于微生物的作用而产生的。由于鱼体组氨酸含量的基础差异,导致经过加工生产的白鱼粉中组胺的含量低于红鱼粉,本试验中,白鱼粉、金枪鱼鱼粉中组胺含量分别为39.6、226.8 mg/kg。饲料中添加的组胺二盐酸盐中组胺含量为60.3%,饲料中的一些物质可能干扰了饲料组胺的检测,表1中检测到的组胺含量低于了配方设计时的理论计算值。
组胺是具有多种生物活性的一种生物胺,饲料中的组胺对养殖动物会产生一定的不良生理反应并影响动物的生长和健康状态。现有的研究结果显示,不同的养殖动物对饲料组胺的生理反应有较大的差异,对养殖动物生长的影响也出现较大的差异;重要的是,在低水平下,组胺对养殖动物显示出很好的生长效果,而在高于一定水平后会产生不良的生理反应,对动物生长造成负面的影响。
Cruz-Suarez等[11]研究发现,饲料中100 mg/kg以上的生物胺(尸胺、腐胺、组胺)会降低凡纳滨对虾(Litopenaeusvannamei)的摄食率、增重率和成活率。在饲料中添加4 000 mg/kg组胺会降低家禽[12]和糠虾[13](NeomysisawatschensisandN.japonicaNakazawa)的成活率。罗其刚等[14]在鱼溶浆对草鱼(Ctenopharyngodonidella)的生长影响试验中发现,组胺对草鱼的成活率没有显著影响,认为草鱼属于无胃鱼类,也就不具备组胺发挥作用的受体,从而降低组胺对于草鱼的毒性作用,低剂量的生物胺能促进草鱼的生长。有报道表明,在肉鸡饲粮中添加4 000 mg/kg组胺时可以抑制肉鸡生长,并且引发肉鸡肌胃糜烂综合征[12];猪饲粮中添加4 000 mg/kg组胺可以降低猪的摄食量和体增重率,但对其FCR没有显著影响[15]。本研究中,在投喂组胺水平超过84.60 mg/kg的试验饲料(H3、H4、H5)时,黄颡鱼的成活率显著降低,这可能是由于黄颡鱼属于有胃鱼类,对组胺的刺激更敏感,高水平的组胺对黄颡鱼产生了毒性作用,降低了其成活率;而投喂金枪鱼粉饲料的黄颡鱼的成活率也显著降低,其可能的原因是红鱼粉与白鱼粉在一般情况下相比,其高过氧化值更容易导致鱼体损伤,从而导致成活率下降[5],其具体原因还有待进一步研究。
有结果显示,饲料中低水平的组胺对养殖动物的生长具有正向的促进作用,表明饲料组胺水平是关键点。Tapia-Salazar等[16]在对细角滨对虾(Litopenaeusstylirostris)的研究中发现,在基础饲料中添加适量的组胺与不添加组胺的对照组相比,细角滨对虾获得了更好的生长效果;Opstvedt等[17]在给鲑(Salmosalar)投喂添加不同水平的混合生物胺饲料时,对其生长具有一定的促进作用,这与鱼溶浆中生物胺对草鱼影响的研究结果[14]也类似。在大西洋鲽[18](Hippoglossushippoglossus)、大菱鲆[19](Scophthalmusmaximus)、金头鲷[20](Sparusaurata)等养殖鱼类饲料中,用高新鲜度、含低剂量的生物胺的鱼粉,其生长高于用中、低等新鲜度且含较高剂量生物胺的鱼粉。在本试验中,TFM、H0、H2、H3、H4和H5的组黄颡鱼的特定生长率显著低于H1组,此结果也表明,饲料中适宜水平(18.00 mg/kg)的组胺有助于提高黄颡鱼的生长性能。
研究表明,生物胺对核酸功能的调节、蛋白质的合成具有重要作用[21]。Watanabe等[22]在饲料中添加70 mg/kg组胺时观察到了虹鳟蛋白质效率的提高。饲料中添加不同水平的组胺对黄颡鱼的蛋白质沉积率、脂肪沉积率以及主要的鱼体营养成分没有造成显著性差异,但H1组即饲料的组胺含量为18.00 mg/kg的黄颡鱼的蛋白质效率和脂肪沉积率最高,这说明在饲料中添加适量的组胺能够促进黄颡鱼对饲料中蛋白质和脂肪的利用,从而促进黄颡鱼的生长。
肝体比和脏体比是评价鱼体健康的一类指标,饲料中的营养物质通常对肝胰脏的生长发育产生影响[23]。在本试验结果中,饲料组胺水平对黄颡鱼的肥满度没有显著影响,H1组黄颡鱼的脏体比相比于H2、H3、H4、H5组显著增高,而这5组的肝体比没有显著差异,这可能是由于H1组较高的脂肪沉积导致黄颡鱼内脏重和内脏脂肪的增加。
血清总蛋白和白蛋白的含量与鱼体的健康以及营养状况密切相关[24]。本试验中,各组黄颡鱼血清总蛋白和白蛋白的含量差异不显著,但是从变化的趋势来看,H1组的血清白蛋白含量最高,这有可能是因为适量水平的组胺加强了黄颡鱼体内的蛋白质合成代谢。
甘油三酯和胆固醇都是血清的主要脂类,它们在一定程度上能反映全身的脂类代谢状况[25]。胆固醇代谢是脂质代谢的重要部分,血清中胆固醇含量的升高说明肝脏细胞功能发生障碍,机体脂质代谢出现紊乱。高密度脂蛋白和低密度脂蛋白是一种血脂蛋白,低密度脂蛋白易引起胆固醇在血管中沉积,并与其他物质一起堵塞血管;高密度脂蛋白能将肝脏外的胆固醇运输到肝脏分解排出体外。本试验中,各组黄颡鱼的血清高密度脂蛋白含量差异不显著,血清总胆固醇、甘油三酯和低密度脂蛋白含量有差异,其中H1组的血清总胆固醇和总甘油三酯含量较低,血清低密度脂蛋白含量也较低,这说明适量添加组胺有可能对提高黄颡鱼机体脂质代谢能力、降低血脂含量具有促进作用。血清胆汁酸是由肝脏合成,当肝细胞发生病变或患胆管疾病时可引起胆汁的代谢障碍,使血清胆总汁酸含量升高,血清总胆汁酸含量与肝细胞损伤程度呈正比[26]。本试验结果表明,TFM、H0、H2、H3、H4组的血清总胆汁酸含量相比于H1组显著升高,这表明黄颡鱼的肝脏可能有一定程度的损伤。
血液中葡萄糖的来源主要是营养的消化吸收和糖原的分解,据相关报道可知,葡萄糖是反映体内碳水化合物代谢的重要生理指标[27]。本试验中,对于白鱼粉饲料中添加组胺的黄颡鱼,随着组胺添加水平的提高,其血清葡萄糖含量呈先升高后降低的趋势,猜测低水平的组胺可能会使黄颡鱼维持相对较高的代谢水平。
黄颡鱼是一种体侧具有黄色色斑、腹部为黄色的鱼类,其皮肤色素主要为类胡萝卜素和叶黄素。本试验分析了各组黄颡鱼体侧皮肤的类胡萝卜素和叶黄素含量,各组之间没有显著差异。由此可见,本试验条件下的饲料组胺水平并未对黄颡鱼的体色产生显著影响。
因此,综合上述分析,本试验结果表明,饲料中低水平(18.00 mg/kg)的组胺对黄颡鱼的生长速度、饲料效率、鱼体健康等具有正向的促进作用,而高于这个剂量的饲料组胺水平对黄颡鱼的生长速度、饲料效率、鱼体健康具有负面的不良影响。本试验条件下饲料组胺未对黄颡鱼的皮肤色素含量产生影响。
3.2 饲料组胺水平对黄颡鱼的胃黏膜表面结构、肠道黏膜细胞之间紧密连接结构的影响
一般认为,饲料中组胺对养殖动物的作用是通过胃肠道黏膜中的组胺受体(histamine receptor,HR)而产生的生理代谢作用。组胺通过与组胺受体结合发挥广泛的生理或病理作用[28],组胺所带来的毒性影响因子可能会影响黄颡鱼的重要组织的结构和功能。从本试验对各组黄颡鱼胃黏膜扫描电镜观察结果看,饲料添加高水平的组胺(H4、H5组)对黄颡鱼的胃黏膜细胞造成了明显的损伤,黏膜表面出现细胞微绒毛缺失等现象。Fairgrieve等[29]和Watanabe等[22]用组胺含量2 000 mg/kg以上的鱼粉饲喂虹鳟时发现其胃产生了严重的生理病变。本试验中,在饲料组胺水平达到103.50 mg/kg时就观察到了胃黏膜的明显损伤,这可能是由于鱼的种类不同而导致其对组胺的耐受性有较大的差异。黄颡鱼胃黏膜的损伤可能导致胃酸分泌、呕吐(吐料)的情况,本试验过程中,没有观察到明显的吐料情况,但显微观察结果显示,高饲料组胺水平组的鱼体胃黏膜表面结构有较为严重的损伤。
组胺对肠道黏膜影响的研究报告不多。肠道黏膜屏障中,主要依赖黏膜细胞之间的紧密连接结构、缝隙连接结构等形成完整的物理性结构屏障,这是肠道黏膜通透性保持的物理性结构基础。本文通过透射电镜观察了黄颡鱼肠道黏膜细胞之间的紧密连接结构。结果表明,饲料组胺水平对黄颡鱼肠道黏膜细胞之间的连接结构有一定程度的损伤作用,损伤程度与饲料组胺水平有一定的线性关系。在H4、H5组黄颡鱼肠道黏膜细胞间的连接结构出现明显的损伤状态,这2组饲料中组胺水平大于103.50 mg/kg。段甦等[30]观察到组胺可以降低人皮肤角化上皮细胞的屏障功能,与本文的结果有相似之处。有研究表明,合适剂量的外源性精胺可在肠腔内快速被小肠黏膜上皮细胞吸收[31],在微颗粒饲料中添加0.10%(1 000 mg/kg)的精胺对半滑舌鳎稚鱼(CynoglossussemilaevisGünther)肠道发育有促进作用,能够增加其小肠微绒毛长度和黏膜厚度[32]。本试验饲料生物胺检测结果显示,饲料精胺含量最高为20.00 mg/kg,远远低于对肠道发挥促进作用的0.10%(1 000 mg/kg)精胺添加量,且本试验各组饲料精胺含量无显著差异,因此本试验中低含量的饲料精胺可能不足以减轻组胺带来的肠道损伤或者并未起到对肠道的保护作用。
综合上述结果和分析,表明饲料中低于103.50 mg/kg的组胺水平没有对黄颡鱼的胃黏膜表面结构、肠道黏膜细胞之间的连接结构造成损伤作用,而大于这个水平则表现出了对胃黏膜细胞、肠道黏膜细胞之间紧密连接结构的损伤作用。
4 结 论
① 饲料组胺水平对黄颡鱼生长性能、鱼体健康的影响具有剂量效应,饲料中低剂量的组胺对黄颡鱼生长速度、饲料效率、鱼体健康等没有显著影响。
② 饲料组胺水平达到103.50 mg/kg及以上时,黄颡鱼的胃黏膜细胞、肠道黏膜细胞之间的紧密连接结构出现损伤。
③ 血清总胆汁酸含量随饲料组胺水平的增加而下降,饲料组胺水平未对黄颡鱼的体色产生不良影响。
