多糖类凝胶灭菌方式的研究
2018-07-16蒋丽霞董冰冰
赵 晶 蒋丽霞 董冰冰
(上海其胜生物制剂有限公司,上海 201106)
近年来,多糖类凝胶的研究热点集中在透明质酸钠、几丁糖等,二者临床应用广泛。目前市场上多糖类凝胶多采用预灌封注射器(玻璃注射器+橡胶锥头帽、胶塞)或西林瓶联合丁基橡胶灌装,必须达到无菌要求。法规对三类医疗器械的要求逐渐提高,2015年《中国药典》灭菌法规定只要物品允许,应尽可能选用最终灭菌法灭菌,所以未来无菌产品的灭菌趋势仍是终端灭菌。医疗器械常用的终端灭菌方法主要有干热、湿热、环氧乙烷(EO)、电离γ或β辐射[1]。这些方法通过物理或化学方式对细菌起到杀灭的效果,但在灭菌的同时可能导致这些生物高分子结构的不可逆变化,并最终影响产品的功能。
现今对于多糖类凝胶灭菌方式的研究报道较少。其中San Juan研究了几丁糖凝胶的γ辐射灭菌,研究结果表明剂量为15 kGy时可使几丁糖凝胶分子量降低80%[2],而透明质酸钠凝胶终端灭菌多集中在湿热灭菌法。由此可见目前还没有关于多糖类凝胶灭菌方式的系统研究,为此采用三种常规灭菌方式考察其对多糖类凝胶产品性能的影响,为该类产品的终端灭菌方式探索提供一定试验基础。
1 材料与方法
1.1 材料:几丁糖凝胶(上海其胜生物制剂有限公司)、透明质酸钠凝胶(上海其胜生物制剂有限公司)。
1.2 方法
1.2.1 湿热灭菌:取上述几丁糖凝胶、透明质酸钠凝胶样品适量,取10支2.0×106孢子数/单位蒸汽灭菌生物指示剂(ATCC 7953;ACE test)装在空注射器内,分别按照121 ℃、F0=8.0和F0=9.0参数进行湿热灭菌。灭菌后,培养生物指示剂,观察指示剂颜色变化。将试验组和对照组分别检测重均分子量。
1.2.2 环氧乙烷(EO)灭菌:本灭菌法主要考察灭菌的有效性和环氧乙烷的残留量。
取上述几丁糖凝胶、透明质酸钠凝胶样品适量,环氧乙烷灭菌参数分别选择48 ℃灭菌18 h、54 ℃灭菌18 h;同时将10支EO灭菌生物指示剂置于空注射器内,另将10支1.5×106孢子数/单位EO灭菌生物指示剂(ATCC9372;ACE test)置于注射器外泡罩内,作为灭菌效果对照。灭菌后,培养生物指示剂,观察指示剂颜色变化,检测灭菌后重均分子量,检测灭菌后初始、解析14 d、解析44 d环氧乙烷残留量。
1.2.360Co-γ射线辐射灭菌:本灭菌法主要考察灭菌的有效性和样品的外观变化。根据ISO11137.2-2013 Sterilization of health care products-Radiation-Part 2:Establishing the sterilization dose选择60Co-γ辐射灭菌最低剂量3 kGy(平均生物负载=1.0时达到SAL=10-2所需的辐照剂量)和常用的辐射灭菌吸收剂量25 kGy。生物指示菌分别采用102孢子数/单位和106孢子数/单位的金黄色葡萄球菌放置在空注射器内。
取上述几丁糖凝胶、透明质酸钠凝胶样品适量,按照产品包装方式包装分别进行既定参数辐射灭菌。灭菌结束后,检查样品外观,检测重均分子量和生物指示菌的情况。
1.3 测定方法
1.3.1 重均分子量:将色谱柱通过激光散射仪与示差检测器双机连接,用0.1 mol/L的硝酸钠-0.2‰叠氮化钠溶液流动相清洗后的进样器抽取用流动相稀释的样品,通过进样环进样,在规定的流速下检测样品的分子量。
1.3.2 环氧乙烷残留量[3]
1.3.2.1 色谱条件:采用GC7890A气相色谱仪Agilent J&W DB-624柱,柱温:50 ℃,保持2 min,以10 ℃/min的速率升至120 ℃,后运行160 ℃。进样口温度:250 ℃,检测器温度:250 ℃。G1888 A顶空进样器,进样器炉温60 ℃;定量环温度70 ℃;传输线温度80 ℃。样品平衡时间:40 min。
1.3.2.2 样品处理。锥头帽:对解析完成后的样品进行取样,将样品剪为5 mm长左右的碎块(或10 mm2片状物),称取1.0 g放入20 mL顶空瓶中,精密加入10 mL水,密封萃取。
环氧乙烷残留量:将1支几丁糖凝胶样品完全挤出至20 mL顶空瓶中,精密加入10 mL水,密封萃取。
1.3.2.3 检测:采用外标定量法检测,顶空进样,待环氧乙烷色谱峰流出后,记录环氧乙烷峰的面积值,得出标准曲线和供试液相应的浓度。
2 结果与分析
2.1 湿热灭菌:两种湿热灭菌条件下,生物指示剂经培养后呈阴性,阳性对照生物指示剂正常生长,灭菌效果有效;几丁糖凝胶重均分子量下降幅度较大,跌幅均在20%以上;透明质酸钠凝胶重均分子量相对较小,在15%~20%(表1)。可见,湿热灭菌对多糖类凝胶的重均分子量影响不同。
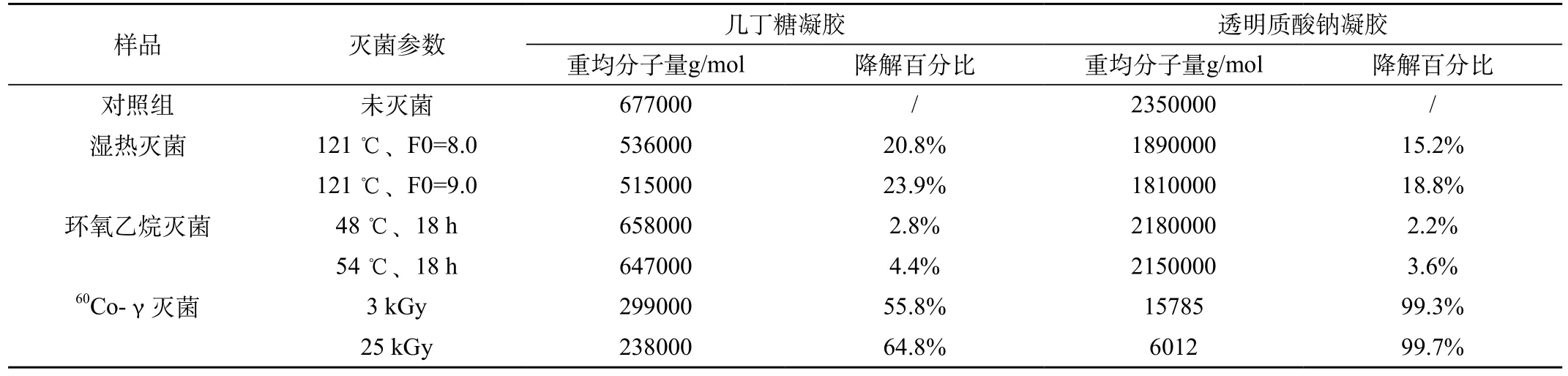
表1 三种终端灭菌方式对多糖类凝胶重均分子量的影响
2.2 环氧乙烷灭菌:两种环氧乙烷灭菌参数下,泡罩内的生物指示剂经培养后均呈阴性,注射器内的生物指示剂经培养后均呈阳性,阳性对照指示菌正常生长,说明环氧乙烷气体未能全部进入注射器内,不能有效地达到终端灭菌的效果。灭菌后凝胶含有大量的EO残留,经过44 d解析后,48 ℃18 h灭菌样品EO残留在12 μg/支左右,54 ℃ 18 h灭菌样品EO残留则在22 μg/支左右(图1)。
2.360Co-γ射线辐射灭菌:生物指示菌完全杀灭,灭菌有效;3 kGy辐射后的注射器呈浅棕色,25 kGy辐射后的注射器呈深棕色,可见60Co-γ射线辐射严重影响注射器的颜色。灭菌前后凝胶的外观变化显著,几丁糖凝胶由液体凝胶状变成半固体凝胶,透明质酸钠凝胶由液体凝胶变成稀溶液,同时,二者重均分子量均出现显著降低,几丁糖降低50%以上,透明质酸钠降低99%以上(表1)。显然这种灭菌方式也不适合注射器类多糖凝胶的终端灭菌。
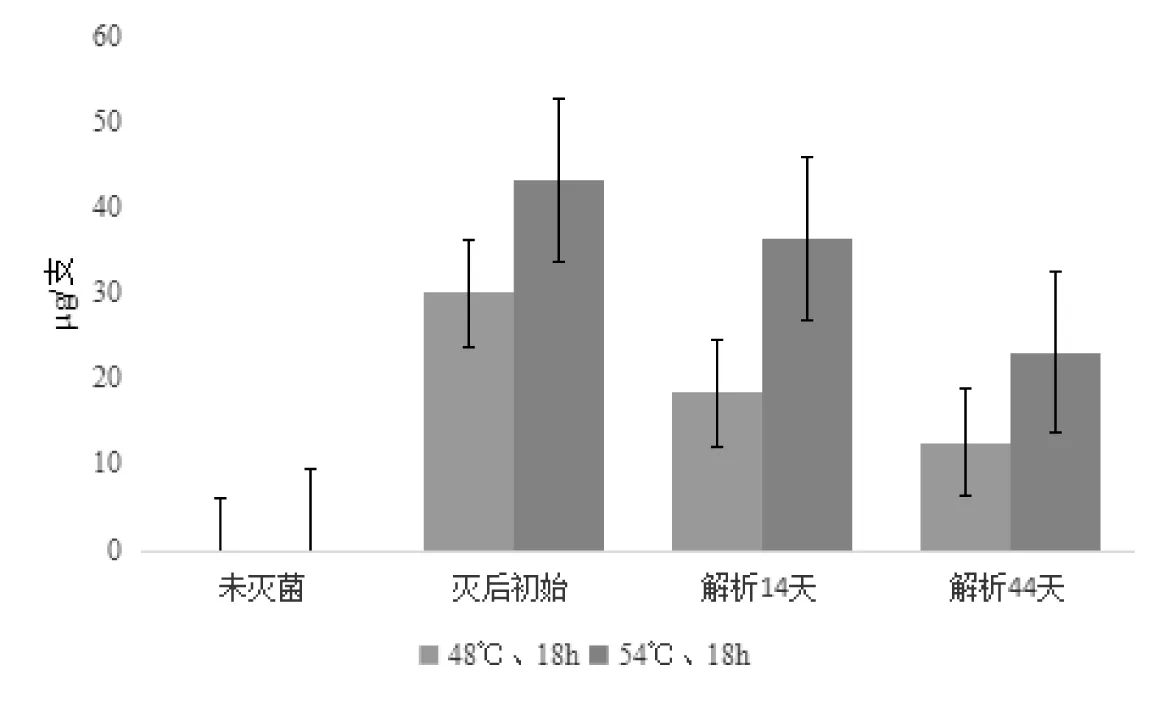
图1 EO灭菌样品环氧乙烷残留量检测结果(μg/支)
3 讨 论
湿热灭菌的参数选择主要依据物品本身的热稳定性和初始污染菌数量,由于多糖类凝胶的生产环境均是过程无菌,初始污染菌不得检出,湿热灭菌提高无菌保证水平达到10-6。因此对于多糖类凝胶湿热灭菌的选择主要取决于该物品的热稳定性。几丁糖凝胶属于天然可降解的多糖产品,其稳定性比较差,采用湿热灭菌作为最终灭菌方式时,高温加热可使几丁糖降解[4],重均分子量骤降。2015年版中国药典灭菌法规定对于热不稳定性物品的F0值一般不低于8 min。本研究即使采用最低灭菌时间121 ℃ F0=8.0,几丁糖灭菌后的重均分子量降低20%以上,且动力黏度与重均分子量存在一定的正相关性,重均分子量的降低,势必影响凝胶重要的性能动力黏度的降低。而透明质酸钠凝胶经湿热灭菌,重均分子量的降低较小,可保证产品没有发生较大的热降解,能达到临床应用的要求。说明湿热灭菌的选择依赖于产品本身的热稳定性,以及临床需求。因此,多糖类凝胶可以根据产品本身的性质以及临床需要选择湿热灭菌方式进行终端灭菌。
采用EO灭菌,预灌封注射器的玻璃材质EO无法穿透,EO只能通过橡胶材质的锥头帽和胶塞进入制品,穿透性差,注射器内产品杀灭值达不到SAL≤10-6,灭菌效果不理想;而且橡胶制品材质易吸附EO气体,灭菌后凝胶内存在大量的EO残留,按照贮存要求在2~8 ℃条件下存放44 d后,凝胶仍有较多残留,解析缓慢,超过GBT 16886.7-2001医疗器械生物学评价第7部分:环氧乙烷灭菌残留量要求的安全标准(1.25 μg/支)。另外,多糖类凝胶主要成分为有效成分和生理缓冲液,含水和氯离子,残留EO易与水反应生成次乙二醇(EG),与氯反应生成2-氯乙醇(ECH),其中ECH属中等毒性物质,不易降解,具有致突变性,容易会造成急性中毒事故,特别是造成严重中枢神经损伤和脑水肿[5]。据此分析,在产品贮存条件下,环氧乙烷的残留量的下降并非是环氧乙烷真正从产品中解析出去,而是与产品中的氯离子和水发生化学反应所致。总体来说,环氧乙烷灭菌对于预灌封注射器产品的灭菌既存在不易穿透进去达不到预期的灭菌效果,又存在进入到注射器内不易解析出来而产生临床使用安全性的问题。因此,考虑到灭菌的有效性和临床使用的安全性,EO灭菌不适用于多糖类凝胶的最终灭菌。
采用60Co-γ射线辐射灭菌,即使采用最低剂量3 kGy,依然导致注射器颜色发生显著变化,凝胶的重均分子量下降50%以上。几丁糖分子本身拥有大量的羟基,60Co-γ的穿透性很强,在高剂量的γ辐射条件下,很容易介导几丁糖中的氨基、羧基基团间的交联反应,且这种交联反应大多发生在分子间,交联后的几丁糖凝胶空间网络极为致密,致使产品由液体凝胶转变为半固体凝胶,弹性提高,而黏性急剧下降,这也就改变了几丁糖原来的分子结构,失去了与预期用途相关的基本性质。而透明质酸钠凝胶经60Co-γ辐射灭菌变成液体,学术上尚未有相关报道,可能因为高剂量的γ辐射导致主链断裂,失去原有的凝胶性质。显然这种灭菌方式也不适合多糖凝胶的终端灭菌。
通过以上对产品理化性质和灭菌方法的研究分析,环氧乙烷灭菌和辐照灭菌终端灭菌方式均不适用于多糖类凝胶的终端灭菌,而湿热灭菌的选择则取决于多糖类凝胶本身的性质和临床用途。
