贵州山慈菇及混伪品ITS序列分析
2018-07-16牛宪立魏妮娜姬可平
牛宪立,魏妮娜,姬可平,谢 奎
(遵义医学院 珠海校区生化教研室,广东 珠海 519041)
山慈菇IphigeniaindicaKunth为兰科植物杜娟兰、独蒜兰Rolfe或云南独蒜兰P.yunnansisRolfe的干燥假鳞茎。《本草纲目》记载了山慈菇的功效:“主疔肿,攻毒破皮。山慈菇具有清热解毒、化痰、散结消肿之功,临床上中医常用山慈菇治疗疔疮肿毒、淋巴结核,乳腺增生、食道癌等疾病[1-3]。由于近几年对山慈菇的有效成分的深入研究,作为药用的山慈菇得到了广泛的开发和利用,使得市场对山慈菇的需求急剧增加,加上药材的采集比较困难,而且野生数量也在不断减少,市场价格就比较高。目前市场上除了正品山慈菇外,还存在大量的伪品和混淆品。常见的有白及Bletillastriata、金果榄Tinosporacapillipe等,它们的根茎在外形上与山慈菇较为相近,但在药效方面相差甚远[4-6]。因此,准确地鉴别山慈菇药材对于保障人们用药安全意义重大。本研究主要从山慈菇的ITS序列进行测序分析,比较这些易混品在遗传上的差异,从而为山慈菇的真品鉴定在分子水平上提供更科学的方法。
1 材料与方法
1.1材料与仪器供试材料山慈菇S5(1号)及其伪品S1、S2、S3、S4(对应序号2、3、4、5号,S5真品山慈菇,S1、S2、S3、S4分别为园叶金果榄)野外采集于贵州桐梓、凤岗、湄潭、习水、正安等地。其它伪品及其同源品的ITS序列来源GenBank数据库,形态学鉴定由广东省珠海市食品药品监督管理局药检所完成。详细信息见表1。
表1山慈菇及其混伪品材料信息
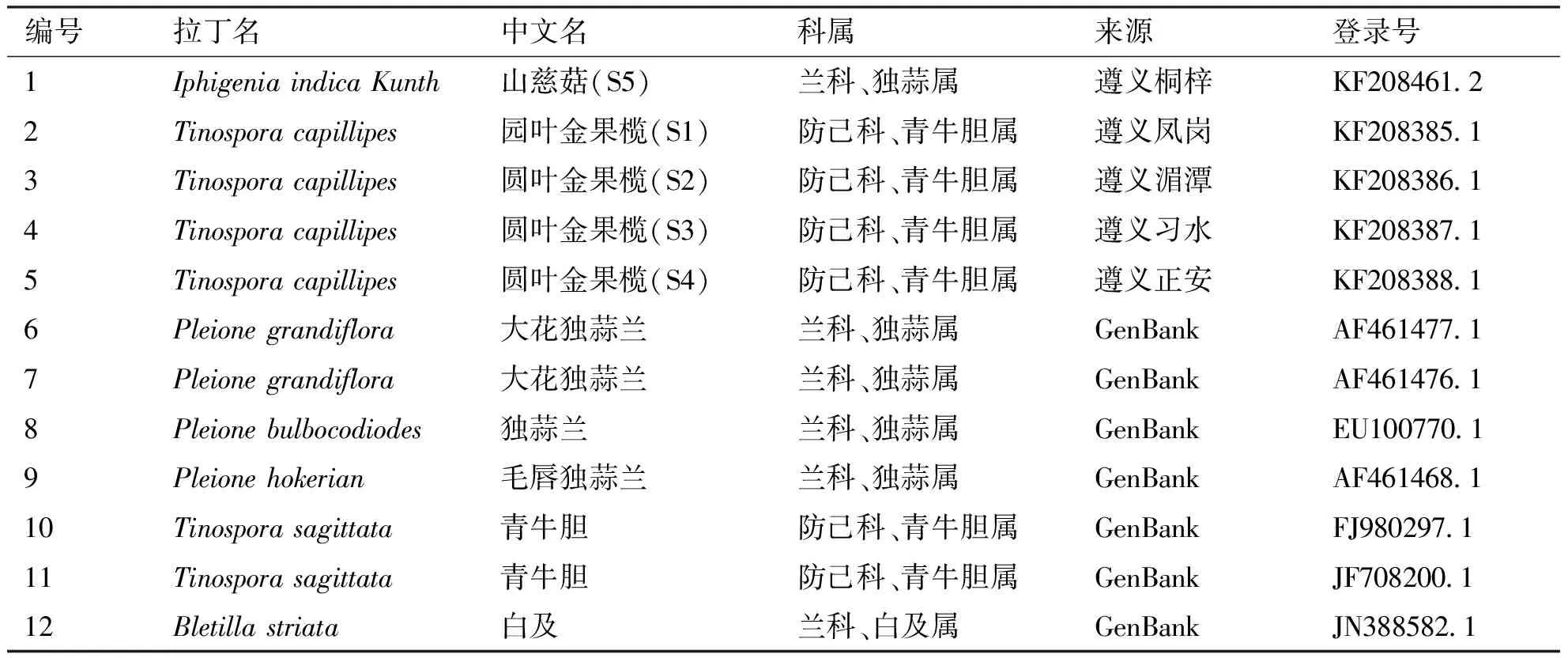
编号拉丁名中文名科属来源登录号1Iphigenia indica Kunth 山慈菇(S5)兰科、独蒜属遵义桐梓KF208461.22Tinospora capillipes园叶金果榄(S1)防己科、青牛胆属遵义凤岗KF208385.13Tinospora capillipes圆叶金果榄(S2)防己科、青牛胆属遵义湄潭KF208386.14Tinospora capillipes圆叶金果榄(S3)防己科、青牛胆属遵义习水KF208387.15Tinospora capillipes圆叶金果榄(S4)防己科、青牛胆属遵义正安KF208388.16Pleione grandiflora大花独蒜兰兰科、独蒜属GenBank AF461477.17Pleione grandiflora大花独蒜兰兰科、独蒜属GenBankAF461476.18Pleione bulbocodiodes独蒜兰兰科、独蒜属GenBankEU100770.19Pleione hokerian毛唇独蒜兰 兰科、独蒜属GenBankAF461468.110Tinospora sagittata青牛胆防己科、青牛胆属GenBankFJ980297.111Tinospora sagittata青牛胆防己科、青牛胆属GenBankJF708200.112Bletilla striata白及兰科、白及属GenBankJN388582.1
主要试剂有Tris 、EDTA-Na2.H2O、 CTAB 购于上海生工公司,苯酚、氯仿、异戊醇购于成都科龙化工试剂公司。主要仪器有UV-2550型紫外分光光度计(日本岛津公司)、Hema-8000型PCR仪(珠海黑马仪器厂)、DYC型电泳仪(北京六一仪器厂)、5810R型冷冻高速离心机(Eppendorf)。
1.2实验方法
1.2.1DNA提取(改良CTAB法)分别称取5个样品植物叶片0.2 g,用液氮研成粉末,移入2.0 mL离心管,加入1 mL 65 ℃预热的CTAB提取缓冲液,充分摇匀,65 ℃水浴60 min,期间混匀3次。然后10 000 rpm离心15 min后取上清液,加入与上清等体积的氯仿:异戊醇(20∶1),加盖颠倒数次混匀。于离心机中8 000 rpm离心15 min,取上清转移至另一新的2.0 mL离心管中,用氯仿∶异戊醇(24∶1)再抽提1次。获得的上清液加入约2/3体积异丙醇和1/5体积5 mol/L NaAc,加盖轻混后,8 000 rpm,离心10 min,弃去上清液。用70%乙醇700 μL洗涤沉淀1次,12 000 rpm离心1 min,风干。加100 μL TE液溶解,低温保存。
1.2.2DNA纯度的检测DNA样品100倍稀释后,在紫外分光光度计UV-2550上测定其在260 nm、280 nm处吸光度值,根据吸光度OD260、OD260/OD280的值计算DNA的浓度和纯度。
DNA浓度(μg/mL)=OD260×稀释倍数×200
然后在1.5%的琼脂糖凝胶电泳,检测 DNA片段长度,观察并记录。
1.2.3ITS扩增和测序采用通用引物扩增山慈菇ITS完整序列,引物P1位于18S上(5’-CGAAGTAAAAGTCGTAACAAGG-3’),引物P2位于26S上(5’-TCCTCCGCTTATTGATATGC-3’),由深圳华大基因科技有限公司合成。基因组DNA 1 μL、引物P1和P2各1 μL、dNTPs、 0.2 mmol/L、Pfu DNA聚合酶1.5 μL,加无菌水补充共50 μL反应体系。PCR反应条件:94 ℃预变性5 min; 94 ℃变性1 min,56 ℃退火2 min,72 ℃延伸3 min,共30个循环;72 ℃延伸5 min。PCR产物通过1.0%琼脂糖凝胶电泳, 初步鉴定筛选后, 分别送深圳华大基因科技有限公司测序。
1.2.4ITS序列分析将测序的结果进行手工校正,对测序峰图使用Codon Code Aligner 3.71进行序列拼接,去除引物序列,获得ITS区序列。用MEGA 5.0软件对所有序列分析比对并进行种内、种间遗传距离的计算; 用NJ(neighbour-2-joiningmethod,NJ)邻接法构建系统发育树。
2 结果
2.1DNA的浓度由表2得知,S5(真品山慈菇)、S1、S2、S3、S4(S1~S4分别为贵州不同地方的园叶金果榄)所提取的DNA样品经过紫外分光光度计浓度检测:OD260/OD280的比值为1.6~1.8,说明污染比较少,符合做PCR扩增模板。
表2不同来源山慈菇提取的DNA浓度
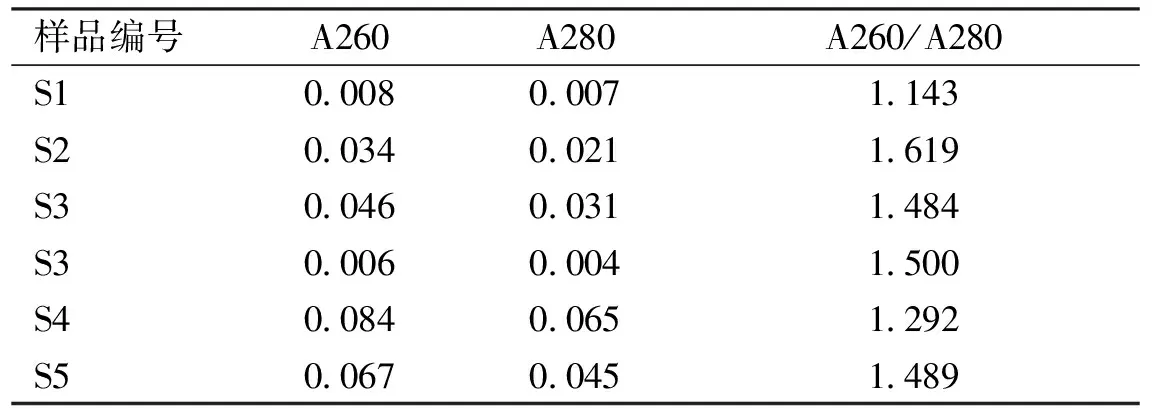
样品编号A260A280A260/A280S10.0080.0071.143S20.0340.0211.619S30.0460.0311.484S30.0060.0041.500S40.0840.0651.292S50.0670.0451.489
2.2总DNA电泳图由图1可知,提取的植物基因组DNA条带明亮清晰完整,大小均在15 000 bp左右。可以用来进行PCR扩增,获得其植物rDNA的ITS序列。

M:DNA标准参照物(DL15000); S1~S5:供试材料详细信息见表1。图1 基因组DNA琼脂糖凝胶电泳图
2.3PCR扩增ITS序列图经改良CTAB法提取所有样品总DNA,PCR扩增ITS序列后,在750 bp处得到预期产物,条带亮度高且清晰(见图2),送深圳华大基因科技有限公司测序。
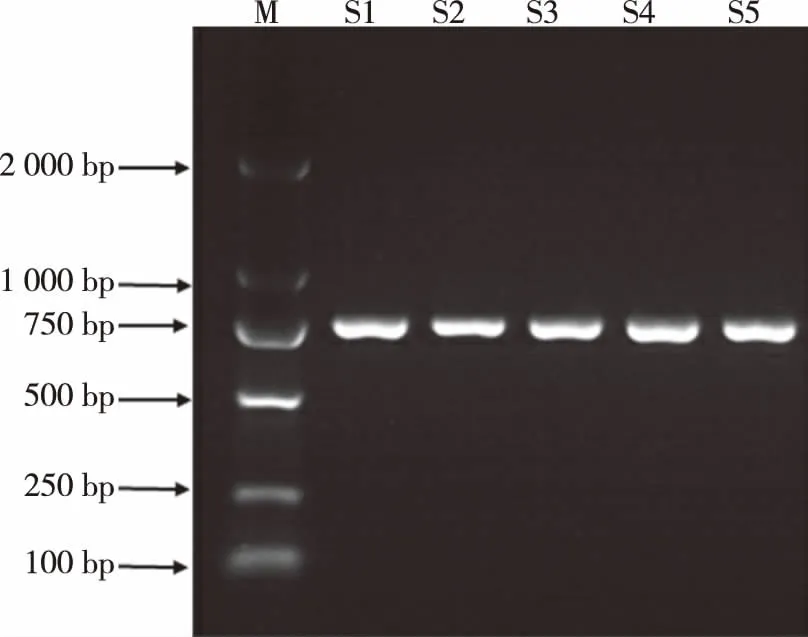
M:DNA标准参照物(DL2000); S1~S5:供试材料详细信息见表1。图2 ITS序列扩增产物电泳图
2.4测序结果及序列分析
2.4.1山慈菇及习用品的完整序列经深圳华大基因科技有限公司测序得到山慈菇S5与习用品园叶金果榄的S1的ITS序列,将ITS序列通过 CodonCode Aligner软件进行拼接和校对。
2.4.2ITS序列拼接及分析把测序后的序列利用CodonCode Aligner进行对比校对,山慈菇与园叶金果榄的ITS片段长度差89个碱基,CG含量差0.40%; 山慈菇与园叶金果榄ITS2片段长度差52个碱基,CG含量差3.30%,详见表3。
表3各片段的特征
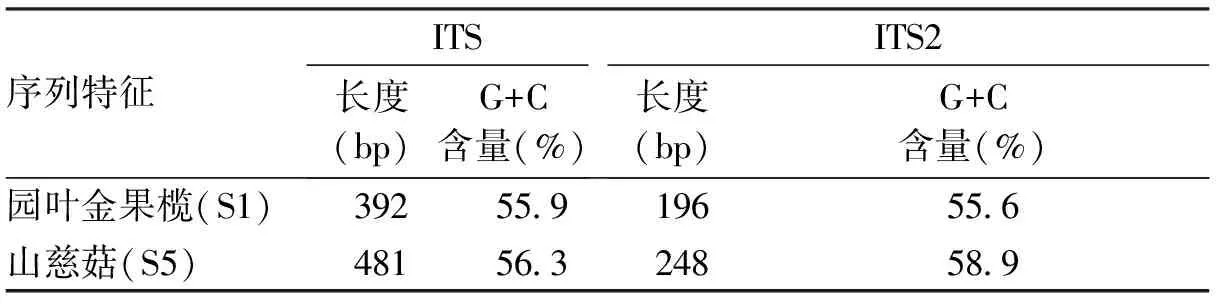
序列特征ITS长度(bp)G+C含量(%)ITS2长度(bp)G+C含量(%)园叶金果榄(S1)39255.919655.6山慈菇(S5)48156.324858.9
2.4.3贵州山慈菇及其混伪品ITS碱基比较由图3可知,山慈菇与大花独蒜兰(序列号AF461477.1)比较有1个突变位点,突变序列为G-T,山慈菇与大花独蒜兰(序列号AF461476.1) 比较有4个突变位点,突变序列分别为G-T,A-C,A-C,C-G; 山慈菇与独蒜兰比较有2个突变位点,突变序列分别为T-C和G-T;山慈菇与毛唇独蒜兰比较有2个突变位点,分别为G-T和A-T。山慈菇与4个金果榄比较有分别208个、206个、205个和206个突变位点,山慈菇与2个青牛胆比较分别有187个和194个突变位点,山慈菇与白及比较有70个突变位点。4个金果榄之间比较有6个突变位点; 2个青牛胆之间比较有30个突变位点,由此可见同种属之间的变异较少,不同种属之间的变异较多。

“.”代表与第一行相同的碱基;“-”代表缺失; 数字表示变异位点。图3 序列对比及变异位点分析
2.4.4山慈菇及伪品的遗传距离贵州山慈菇及伪品的ITS序列之间的遗传距离见表4。由表4可知遗传距离(K-2P)范围为0.002~0.404,其中1号至5号之间的遗传距离很小,6号至11号之间的遗传距离很小,10号于11号之间的遗传距离也很小。1号与6号、1号与10、1号与12号之间遗传距离都较大,由他们的距离可以看出真品与伪品之间的遗传距离较大。
表4山慈菇及伪品的遗传距离
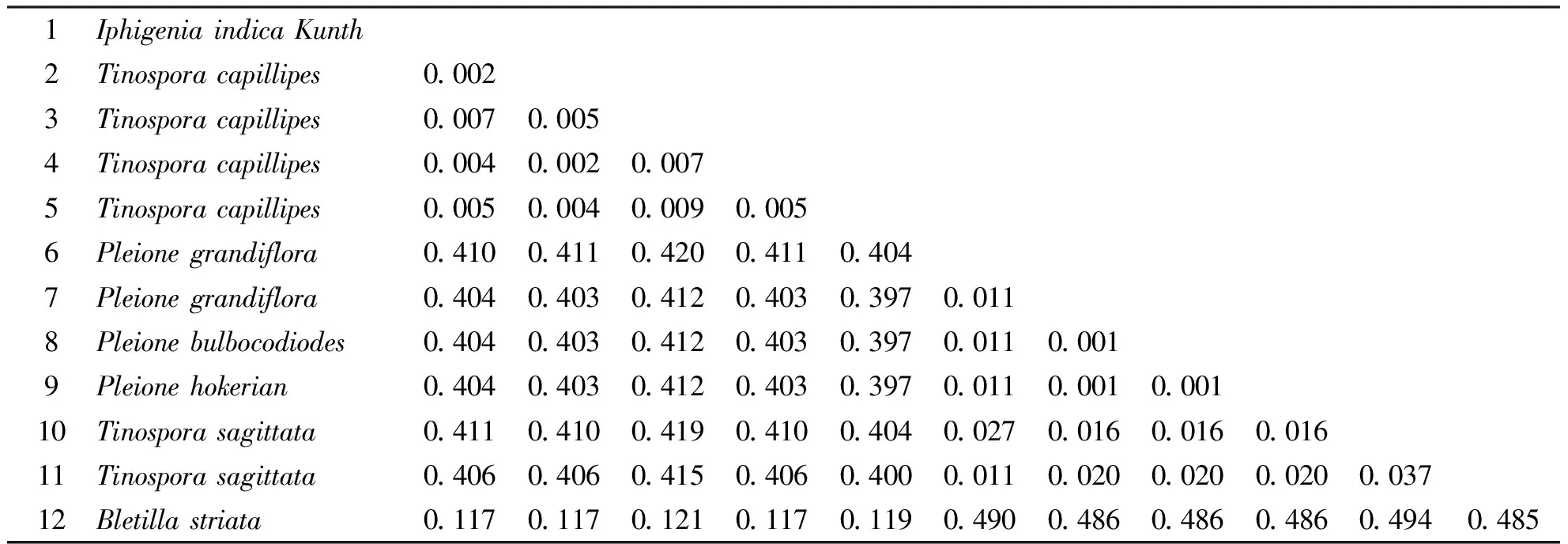
1Iphigenia indica Kunth2Tinospora capillipes0.0023Tinospora capillipes0.0070.0054Tinospora capillipes0.0040.0020.0075Tinospora capillipes0.0050.0040.0090.0056Pleione grandiflora0.4100.4110.4200.4110.4047Pleione grandiflora0.4040.4030.4120.4030.3970.0118Pleione bulbocodiodes0.4040.4030.4120.4030.3970.0110.0019Pleione hokerian0.4040.4030.4120.4030.3970.0110.0010.00110Tinospora sagittata0.4110.4100.4190.4100.4040.0270.0160.0160.01611Tinospora sagittata0.4060.4060.4150.4060.4000.0110.0200.0200.0200.03712Bletilla striata0.1170.1170.1210.1170.1190.4900.4860.4860.4860.4940.485
2.4.5物种间NJ树鉴定从ITS序列构建的NJ树图(见图4) 可以看出,山慈菇与独蒜兰、大花独蒜兰、毛唇独蒜兰种间亲缘关系较近,聚为一支; 白及单独聚为一支; 不同地域的金果榄与两种青牛胆聚为一支上,山慈菇与其混伪品白及、金果榄之间差异较为显著,分别聚到不同的分枝上。
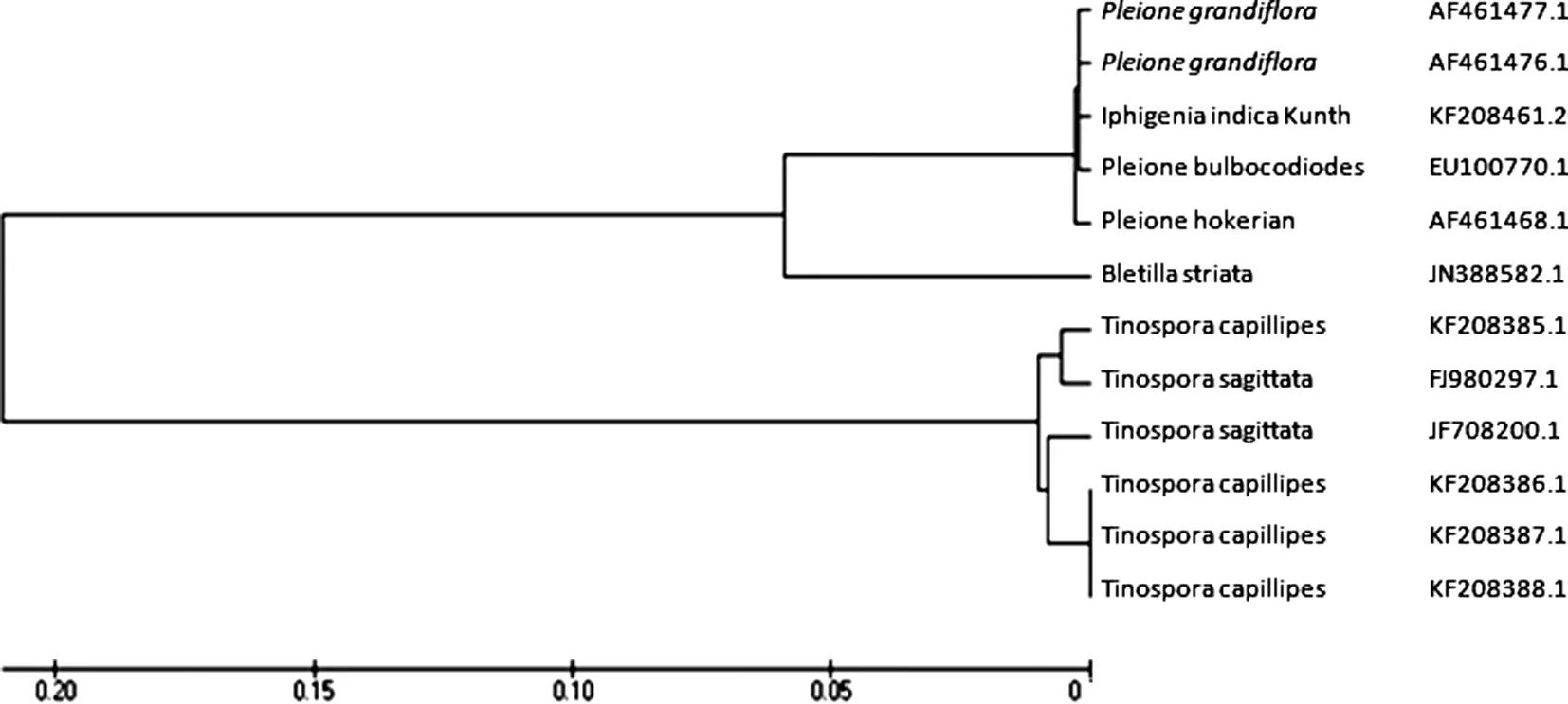
图4 山慈菇及伪品的NJ树
3 讨论
随着现代分子鉴定技术的不断发展,对中草药的品系评价研究已从传统的形态性状、组织解剖、理化特性等方面深入到了分子水平。以DNA指纹技术、DNA测序技术为代表的DNA分子标记技术已广泛应用于中药材的品质鉴定中,尤其是rDNA内转录间隔区(rDNA ITS)测序分析技术的发展。Lau等[7]分析了16种石斛属植物的rDNA序列,在ITS2区种间差异为12.4%,而与非兰科植物和伪品之间的差异分别为29.8%和18.8%,因此,ITS2区序列完全可以作为鉴定山慈菇药材的依据。丁平等[8]将 rDNA-ITS序列分析用于对巴戟天及其常见混伪品的鉴定。rDNA-ITS序列分析技术因不受药材的生长、环境、产地等因素的影响,在野生药材与其栽培品及混淆品的比较研究方面具有更好的应用前景。rDNA ITS序列分析技术还应用于伞房花耳草、白花蛇舌草与纤花耳草、松叶耳草等混杂品的鉴定[9],佛手与其混淆品近缘种香橼[10],巴戟天及其易混品虎刺、羊角藤[11],以及白木香[12]、高良姜[13]、石斛[14]、红芪[15]等药材的鉴定,为药用植物在野生品、易混品及栽培品等在分子水平的差异提供了重要的参考资料。
由于Rubisco酶大亚基基因编码序列rDNA ITS序列在不同生物之间存在碱基序列上的差异,因此可广泛用于物种分类与鉴定、遗传多样性与系统发育、各亲缘关系等方面的研究[16-19]。有关研究表明,rDNA ITS区序列分析技术在鉴别中药植物近缘种、易混品及药材道地性等方面具有方法可靠、灵敏、快捷的优点,为进一步确保药品质量及用药安全有效等方面发挥重要作用。
本研究通过对山慈菇ITS序列的比对分析,发现山慈菇与4个金果榄比较有200多个突变位点,与2个青牛胆比较有180多个突变位点,与白及比较有70个突变位点。而4个金果榄之间只有6个突变位点; 2个青牛胆之间有30个突变位点,由此可见同种属之间的变异较少,不同种属之间的变异较多。不同产地的金果榄的ITS序列相似率为99%,且聚在一起。NJ系统发育树图上进一步分析,白及与山慈菇、独蒜兰、大花独蒜兰、毛唇独蒜兰同为兰科植物,同聚为一支。但是白芨与山慈菇等在ITS序列有一定的差异,白及单独聚为一支; 不同地域的金果榄与两种青牛胆有较近的种间亲缘关系,同聚为一支上。由此看出,山慈菇与其混伪品白及、金果榄之间差异较为显著,分别聚到系统发育树不同的分枝上。说明不同产地的山慈菇以及其混伪品有一定的遗传距离,在种间分化上比较活跃。本研究对贵州道地药材山慈菇及其伪品rDNA ITS序列进行对比分析,为山慈菇的道地性研究确立初步标准。ITS序列分析技术为建立山慈菇真品鉴定的分子水平标记以及中药山慈菇DNA条形码的建立奠定初步基础。
