不同剂量右美托咪定预处理对大鼠体外循环肺损伤的影响
2018-07-16于承琨窦雪娇
于承琨,谢 菲,何 苗,韩 明,窦雪娇,张 琳,张 红
(1.遵义医学院 麻醉医学院,贵州 遵义 563099;2.遵义市第一人民医院 重症医学科,贵州 遵义 563000;3.成都大学附属医院 麻醉科,四川 成都 610081)
体外循环(cardiopulmonary bypass CPB)后患者几乎均有不同程度的肺损伤[1],严重的表现为呼吸窘迫综合征乃至多器官功能衰竭,病死率可高达50%~70%[2]。CPB后肺损伤的主要因素之一为CPB诱发的全身性炎症反应[3]。右美托咪定是一种新型、高选择性的α2肾上腺受体激动剂,具有镇静催眠、镇痛、抗交感神经、稳定血流动力学等作用,已在临床上广泛应用;研究发现右美托咪定可通过减轻炎症反应产生肺保护作用[4]。因此,本实验旨在大鼠CPB左肺缺血再灌注肺损伤模型中应用不同剂量的右美托咪定预处理,探讨其可能的保护作用,为拓展右美托咪定的临床应用提供理论依据。
1 材料与方法
1.1实验动物及分组350~500 g成年健康雄性SD大鼠144只,由重庆第三军医大学大坪医院创伤外科研究所动物中心提供,许可证:SCXK(渝)2012-0005。大鼠随机分6组,每组24只(每时间点8只),即单纯开胸组(T组)、单纯转机组(C组)、肺缺血再灌注组(IR组)、右美托咪定Ⅰ组(DexⅠ组)、右美托咪定Ⅱ组(DexⅡ组)和右美托咪定Ⅲ组(DexⅢ组)。T组只开胸,不做其他处理;C组只建立常规CPB;IR组只建立大鼠CPB左肺缺血再灌注损伤模型;DexⅠ组、DexⅡ组、DexⅢ组建立大鼠CPB左肺缺血再灌注损伤模型,在阻断左肺门前10 min分别尾静脉给予1.5、3、6 μg/kg右美托咪定,其余各组在阻断左肺门前10 min静脉给予等容量的生理盐水。
1.2大鼠体外循环肺缺血再灌注损伤模型的建立各组动物均用1%戊巴比妥钠50 mg/kg腹腔内注射麻醉,分离右侧股动脉、两侧股静脉并穿刺置管,左股静脉连接大鼠膜式氧合器(东莞科威医疗机械有限公司),股动脉连接生物信号采集处理系统监测大鼠生命体征,喉镜明视下气管插管连接呼吸机。肝素5 mg/kg由尾静脉注射,待全身肝素化后经股静脉进行静脉端引流,右侧颈总动脉连接BT100-2J蠕动泵,待激活全血凝固时间(Activated Clotting Time of whole blood ACT)大于480 s后开始转机,并循10 min后经左侧第四肋间开胸;游离并夹闭左肺门45 min后,开放肺门,30 min后停止CPB,术中维持灌注流量在40mL/(kg·min),平均动脉压保持在50~65 mmHg。停机前使用鱼精蛋白尾静脉内注射中和多余肝素,期间通过动脉血气分析结果维持实验动物的电解质平衡以及内环境稳态,停机1.5 h后结束本实验。
1.3指标检测各组分别在CPB前(T1)、开放左肺门后(T2)、实验结束时(T3)时点取股动脉血进行血气分析,根据血气分析结果计算氧合指数(OI)和呼吸指数(RI),其中OI= PaO2/FiO2,RI=P(A-a)O2/PaO2。动脉血3 000 rpm离心10 min取血浆,采用ELISA法测定血浆TNF-α和IL-1β、IL-6水平;取左肺分两份分别于液氮和福尔马林中保存。一份左肺组织经福尔马林固定后用HE染色光镜观察形态学变化,TUNEL法检测细胞凋亡情况(严格按照说明书操作),在光镜下观察染色呈黄褐色为阳性细胞。随机选取5个高倍视野(10×40),利用image-pro plus6.0进行图象分析并记录凋亡指数(A)和阳性细胞显色强度(B),按照免疫组化评分(IHS)=A×B进行评估,其结果反映了组织细胞的凋亡程度,评分越高凋亡程度越重。另一份左肺组织进行匀浆、离心、吸取上清测定TNF-α和IL-8、IL-6水平(严格按照ELISA试剂盒说明书操作)。
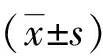
2 结果
2.1各组大鼠氧合指数(OI)及呼吸指数(RI)的变化各组不同时点比较:T组各时点OI、RI未见明显改变(P>0.05);其余各组各时间点OI:T1>T2>T3(P<0.05),RI变化则相反。
各组间相同时点比较:T1时点,各组大鼠间OI、RI无明显差异(P>0.05);不同时点组内及组间比较: T2、T3时点,与T组比较,C、IR、DexⅠ、DexⅡ、DexⅢ组OI显著减低(P<0.05),C组OI又明显高于IR、DexⅠ、DexⅡ、DexⅢ组(P<0.05),RI变化则相反。IR、DexⅠ、DexⅡ、DexⅢ组之间OI、RI无明显差异(P>0.05,见表1~2)。

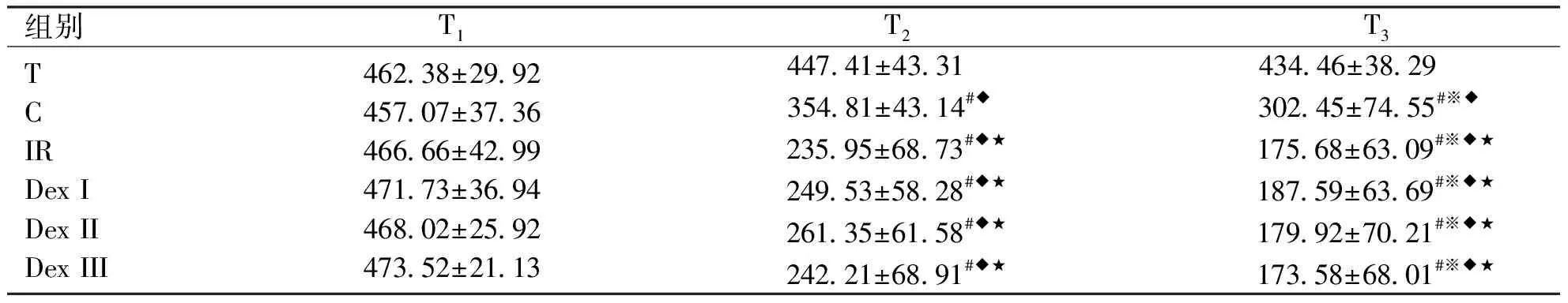
组别T1T2T3TCIRDex IDex IIDex III462.38±29.92457.07±37.36466.66±42.99471.73±36.94468.02±25.92473.52±21.13447.41±43.31 354.81±43.14#◆ 235.95±68.73#◆★249.53±58.28#◆★261.35±61.58#◆★242.21±68.91#◆★434.46±38.29 302.45±74.55#※◆ 175.68±63.09#※◆★187.59±63.69#※◆★179.92±70.21#※◆★173.58±68.01#※◆★
与T1比,#P<0.05;与T2比,※P<0.05;与T组比,◆P<0.05;与C组比,★P<0.05。


组别T1T2T3TCIRDex IDex IIDex III0.461±0.0610.444±0.0660.451±0.1350.465±0.0710.454±0.0360.449±0.5170.529±0.146 0.971±0.040#◆ 1.712±0.708#◆★1.732±0.712#◆★1.719±0.248#◆★1.761±0.734#◆★0.569±0.135 1.567±0.539#※◆ 2.555±0.728#※◆★2.644±0.573#※◆★2.643±0.543#※◆★2.638±0.611#※◆★
与T1比,#P<0.05;与T2比,※P<0.05;与T组比,◆P<0.05;与C组比,★P<0.05。
2.2各组大鼠肺组织形态学变化T1时点:各组大鼠肺组织结构清晰、完整,肺泡壁完整,肺泡腔内无明显出血及炎性渗出。T2时点:T组肺组织结构清晰,其余各组肺组织结构稍紊乱可见红细胞渗出及少量炎性水肿液。T3时点:T组肺组织结构较清晰,可见少量红细胞渗出及炎性渗出;C组肺组织结构尚清晰,可见部分肺泡壁断裂和肺泡腔塌陷,炎性细胞及红细胞浸润,肺组织损伤程度较IR、DexⅠ、DexⅡ、DexⅢ组明显减轻;IR、DexⅠ、DexⅡ、DexⅢ组肺组织结构紊乱,肺泡壁严重断裂,肺泡腔塌陷且有大量水肿液,可见红细胞及炎性细胞大量浸润(见图1)。

A:T组; B:C组; C:IR组; D:DEX I组; E:DEX II组; F:DEX III组,HE×100。图1 T3时肺组织形态学改变
2.3各组大鼠肺组织细胞凋亡及免疫组化评分T1时点:各组大鼠肺组织出现少量棕色凋亡细胞,染色强度也较低。T2时点:各组大鼠肺组织凋亡细胞数目逐渐增多,染色强度也逐渐加深。T3时点:T组出现少量染色较深的阳性细胞,C、IR、DexⅠ、DexⅡ、DexⅢ组均出现大量的深染阳性细胞,IR、DexⅠ、DexⅡ、DexⅢ组尤甚并形成凋亡细胞群,凋亡程度明显高于T、C组,证明该模型成功建立。
免疫组化评分(IHS):各组内比较不同时点:T组各时点肺组织IHS无明显变化;T3时点C、IR、DexⅠ、DexⅡ、DexⅢ组IHS均升高(P<0.05);与T2比较,T3时点C、IR、DexⅠ、DexⅡ、DexⅢ组IHS明显升高(P<0.05)。各组间相同时点比较:T1、T2时点各组IHS无明显差异(P>0.05);T3时点,IR、DexⅠ、DexⅡ、DexⅢ组IHS高于C组(P<0.05)并且均明显高于T组(P<0.05),IR、DexⅠ、DexⅡ、DexⅢ组IHS无明显差异(P>0.05)(见表3、图2)。
表3各组大鼠不同时点肺组织细胞凋亡IHS
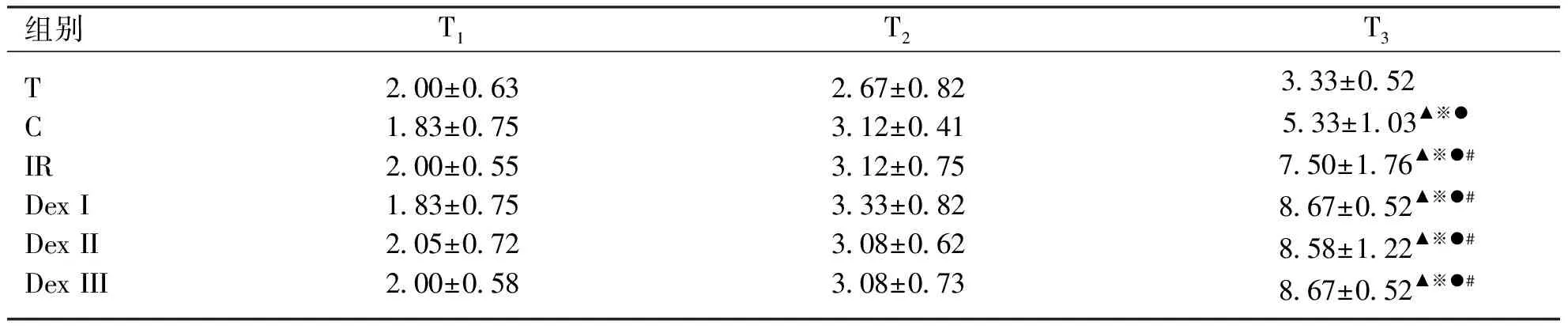
组别T1T2T3TCIRDex IDex IIDex III2.00±0.631.83±0.752.00±0.551.83±0.752.05±0.722.00±0.582.67±0.823.12±0.413.12±0.753.33±0.823.08±0.623.08±0.733.33±0.52 5.33±1.03▲※●7.50±1.76▲※●#8.67±0.52▲※●#8.58±1.22▲※●#8.67±0.52▲※●#
与T1比较,▲P<0.05;与T2比较,※P<0.05;与T组比较,●P<0.05;与C组比,#P<0.05。
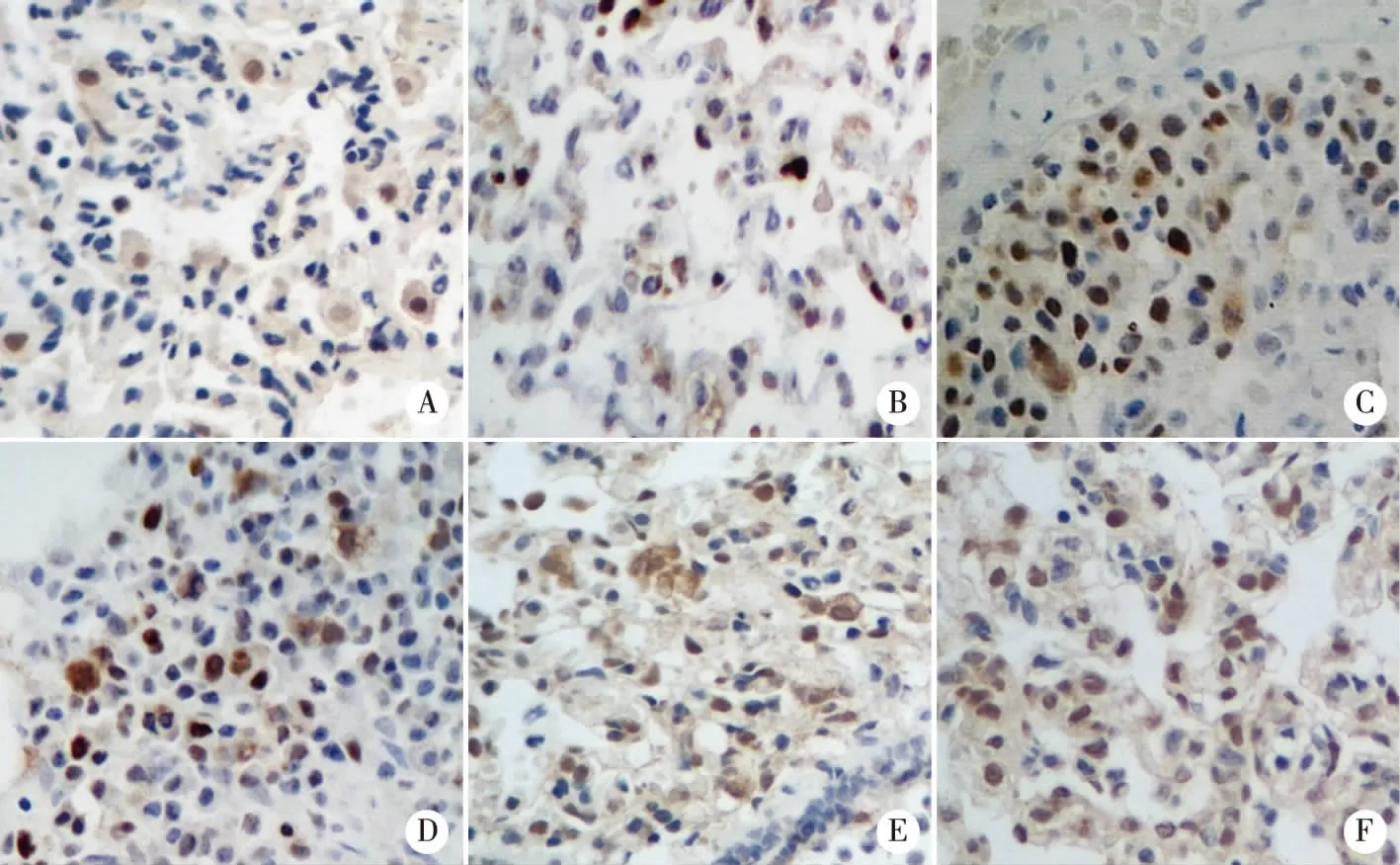
A:T组; B:C组; C:IR组; D:DEX I组; E:DEX II组; F:DEX III组,SP×400。图2 各组大鼠T3时染色
2.4各组大鼠肺组织和血浆TNF-α、IL-1β、IL-6含量变化各组大鼠肺组织和血浆TNF-α、IL-1β、IL-6含量变化趋势一致。由于CPB血液稀释的影响,TNF-α、IL-1β、IL-6血浆含量的数值需进行校正,校正值=实测值×转机前血细胞比积(Hct)值/实际Hct值。
各组大鼠不同时点比较:T组各时点肺组织及血浆TNF-α、IL-1β、IL-6含量无明显改变(P>0.05);随着时间的延长TNF-α、IL-1β、IL-6在肺组织和血浆中的含量明显增加,即TNF-α、IL-1β、IL-6含量T1最少,T2次之、T3最多(P<0.05)。
各组大鼠相同时点比较:T1时点各组大鼠肺组织和血浆TNF-α、IL-1β、IL-6含量无明显差异(P<0.05);T2、T3时点:TNF-α、IL-1β、IL-6含量T组最少,C组次之,IR、DexⅠ、DexⅡ、DexⅢ组含量最高(P<0.05),IR、DexⅠ、DexⅡ、DexⅢ组之间含量无明显差异(P>0.05) (见图3~5) 。

与T1比,# P<0.05;与T2比,※P<0.05;与T组比,◆P<0.05;与C组比,★P<0.05。图3 肺组织、血浆TNF-α含量
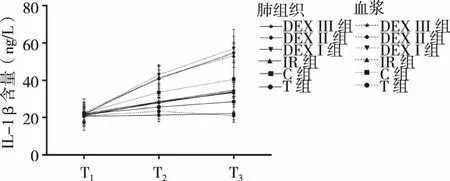
与T1比,#P<0.05;与T2比,※P<0.05;与T组比,◆P<0.05;与C组比,★P<0.05。图4 肺组织、血浆IL-1β含量

与T1比,#P<0.05;与T2比,※P<0.05;与T组比,◆P<0.05;与C组比,★P<0.05。图5 肺组织、血浆IL-6含量
3 讨论
体外循环后的肺损伤及肺保护研究一直是人们关注的热点,其中CPB后诱发的全身炎症反应是导致肺损伤的机制之一。本实验建立心脏不停跳的大鼠CPB,排除了心脏停跳对肺组织的影响,很大程度上模拟了CPB非生理循环状态的肺损伤。期间阻断左肺门45 min,模拟了肺缺血再灌注损伤。缺血组肺功能及光镜结果证明模型成功建立,模型的成功建立有助于CPB后肺保护的实验研究。研究发现[5],在犬CPB模型中随着肺组织TNF-α含量增加,肺组织结构破坏,最终导致肺功能下降。IL-1β是早期出现的炎细胞因子,可与TNF-α协同激活核转录因子-κB (NF-κB)产生细胞因子,参与启动炎性反应;IL-6被认为是严重急性肺损伤的标志。本实验结果发现:与体外循环前比较,CPB后单纯CPB组(C组)、左肺缺血再灌注损伤组(IR组),大鼠OI显著降低,而RI则明显升高;同时随着时间的延长,肺组织、血浆中TNF-α、IL-1β、IL-6含量逐渐升高,同时肺功能降低,细胞凋亡数及IHS明显增加,单纯开胸组(T组)则无明显变化;表明CPB后炎症因子数目增加可能是细胞凋亡及肺损伤的主要因素,这与Kearney等[6]研究结果相符。
随着右美托咪定相关研究的进展,其器官保护作用也得到了越来越多学者的肯定。研究发现[7]:使用右美托咪定有效减轻了肺缺血再灌注损伤模型中的肺损伤,具有肺保护作用。本实验选择人的临床等效剂量经静脉分别泵注1.5、3、6μg/kg的右美托咪定,结果发现,DexⅠ、DexⅡ、DexⅢ组各组间比较及与IR组的比较,肺组织和血浆中TNF-α、IL-1β、IL-6含量均无明显差异,肺功能指标、肺组织病理改变及细胞凋亡程度也无明显改善,说明右美托咪定预处理对CPB肺损伤没有明显的保护作用,与相关报道结果不符。分析可能原因为:①右美托咪定给药方式不同:有研究表明,过度的应激反应可能是引起急性肺损伤的重要机制之一[8]。CPB的非生理性灌注加之手术创伤会产生强烈的应激反应,且随时间增加应激反应越重,可导致各器官功能障碍。右美托咪定分布半衰期约为6 min,清除半衰期2 h,而时量相关半衰期随输注时间增加显著延长,本实验仅在开胸前10 min进行右美托咪定预处理,时间短可能无法完全抑制CPB引起的应激反应,对大鼠肺损伤无明显改善作用。②右美托咪定的剂量可能不足:有研究发现,右美托咪定的抗炎作用具有剂量依赖性,大剂量抗炎作用强[9-10]。在呼吸机诱导的大鼠肺损伤模型中[11],临床相关剂量的右美托咪定没有显著减轻肺损伤,而10倍于临床剂量时可显著减轻肺损伤。本实验选择的是临床相关剂量,因此推测,右美托咪定对大鼠CPB肺组织无明显的保护作用可能与选择的剂量偏小有关,但具体原因还需进一步研究证实。
