高脂饮食对C57BL/6J小鼠肝脏胆汁酸代谢调控通路基因的表达影响
2018-07-16杜艺玫周若雨马菲菲何芋岐周旭美
孔 晶,杜艺玫,周若雨,马菲菲,何芋岐,周旭美
(1.遵义医学院附属医院 药剂科,贵州 遵义 563099;2.遵义医学院 国家级药学实验教学示范中心药学实验室,贵州 遵义 563099)
胆汁酸具有促进脂溶性维生素、脂类在哺乳动物体内消化吸收,调节胆固醇代谢的作用,同时也是大多数药物在肝脏代谢中主要的生理调节剂。其作为肝脏法尼醇 X 受体(FXR)的天然配体,可通过激活FXR受体及膜G蛋白偶联受体功能,起到调节肝脏代谢的信号分子作用[1]。据有关实验研究及流行病学数据表明,长期高脂饮食可损伤肠道黏膜的屏障功能[2-3],增加总胆汁酸和脱氧胆汁酸含量[4],触发炎症性肠道疾病微生物的生长,影响FXR受体调节胆汁酸代谢相关基因的转录和配置[5-6]。因此,胆汁酸代谢调控通路对于机体调控血糖、胆固醇及肠道微生物起到十分重要的作用[7]。目前,文献报道较多的为单个基因在胆汁酸代谢调控通路中的调控作用[8-9],而高脂饮食压力对该通路的影响尚未见系统性研究报道。本研究通过制备高脂模型小鼠,利用转录组学研究方法,系统性了解在高脂饮食压力下对小鼠肝脏胆汁酸代谢调控通路关键基因的影响,为药物研发作用基因靶点及临床精准用药提供基础性数据。
1 材料与方法
1.1实验动物与试剂实验用SPF级C57BL/6J雄性小鼠由北京华阜康生物科技股份有限公司提供(实验动物生产许可证号:SCXK(京)2014-0004)。选取日龄约42~56 d,体重约23~25 g 共22只,以体重为条件随机分为对照组[饲喂普通饲料,成分组成:脂肪12.1%;碳水化合物64.7%;蛋白质23.2%,江苏协同医药生物工程有限责任公司,苏饲证(2014)01008]及模型组(饲喂高脂饲料,成分组成:脂肪60%;碳水化合物20%;蛋白质20%,美国Research Diets公司)各11只。两组均在屏障环境下饲喂16周,自由饮水、进食,每日2次,昼夜均衡。
1.2血清学标本采集及测定至实验终点,小鼠处死前进行水合氯醛麻醉,摘眼球取血,于室温静置约1 h后,以3 500 rpm离心10 min,吸取分离上清液用于测定总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)及高密度脂蛋白(HDL-C)水平。采用MULTISKAN GO全波长酶标仪(美国Thermo公司)及南京建成生物科技有限公司试剂盒进行测定。
1.3肝脏胆汁酸分析称取100 mg肝脏组织,加入乙腈300 μL匀浆,于4 ℃,14 300 rpm离心10 min,取250 μL氮吹仪吹干,用100 μL50%甲醇复溶残渣,待充分溶解后相同参数再次离心,取上清进行LC-MS分析。采用Agilent 6420三重四极杆液质联用系统(Agilent科技有限公司),固定相 CQUITY UPLC BEH C18 色谱柱(1.7 μm,2.1×100 mm),流动相为乙腈和乙酸铵,参考文献报道参数进行梯度洗脱[10]。质谱参数:Gas Temp:326 ℃,Gas Flow:12 L/min,Nebulizer:55 psi,Capillary:3 500 V。质量分析器参数为负离子模式下离子检测。
1.4总RNA提取及测序选取具有典型变化的对照组及模型组各5个肝脏组织样本,分别称取20 mg加入TRlzol溶液1 mL,置冰上匀浆,匀浆液加入200 μL氯仿,上下颠倒混合均匀后,室温孵育10 min,在12 000 rpm 4 ℃下离心15 min,分离上清液与500 μL异丙醇充分混匀,相同参数下再次离心15 min,弃去上清液。加入1 000 μL 75%乙醇(DEPC水配制),用移液器反复吸打乙醇,洗涤RNA沉淀,4 ℃,7 500 rpm 离心15 min后弃上清液,用微型离心机将管内壁上的乙醇甩至管底,用10 μL枪头吸出后常温放置沉淀,待挥干后加入20 μL DEPC水重悬RNA。采用超微量分光光度计检测RNA浓度及质量。送华大基因公司(BGISEQ-500测序平台)进行测序。
1.5数据处理采用热图可视化对基因转录变化进行宏观表达,经R语言中gplots工具包的heatmap.2函数完成。采用主成分分析法对基因表达进行统计,以小鼠个体为样本,单个样本的每一个基因表达值作为变量构建数据矩阵,经R语言开源工具包中mixOmics对数据矩阵进行 PCA函数处理。数据统计分析采用SPSS 17.0软件,组间比较使用t检验。
2 结果
2.1小鼠体重变化经过16周的高脂饲料饲喂,对照组小鼠体重增涨8.35%,模型组小鼠体重增涨30.60%。表1表明,经16周高脂饮食饲养明显增加小鼠体重(P<0.01)。

组别0周16周对照28.85±1.9131.26±2.03模型29.00±1.9341.78±2.28∗
与对照组比较,*P<0.01。
2.2血脂水平变化两组小鼠分别给予普通饲料及高脂饲料连续饲喂16周后,取血清测定TC、TG、LDL-C及HDL-C水平,可见与对照组相比,模型组小鼠TC(P<0.01)、LDL-C(P<0.05)水平增高(见表2),TG、HDL-C无明显变化。


组别TCTGLDL-CHDL-C对照3.27±0.460.72±0.140.20±0.120.98±0.61模型4.97±1.73∗0.67±0.330.66±0.38#1.14±0.50
与对照组比较,*P<0.01,#P<0.05。
2.3胆汁酸分析结果比较本研究采用LC-MS检测胆酸(CA)和鹅脱氧胆酸(CDCA)含量,经高脂饮食连续饲喂16周后,模型组CA和CDCA下降(P<0.05,见表3)。

组别CACDCA对照(6.76±0.60)×106(0.91±0.30)×106模型(0.12±0.02)×106#(0.14±0.03)×106#
与对照组比较,#P<0.05。
2.4基因表达差异及显著性分析
2.4.1轮廓可视化结果选用无监督聚类分析及可视化得图1,直观地展现了对照组与模型组基因表达上的差异,从宏观上体现了高脂饮食造成了小鼠肝脏基因转录的显著变化,红色表示上调,绿色表示下调,黑色表示不变。
2.4.2火山图结果火山图可以展示具有显著差异表达基因的整体轮廓,以倍数变化(Fold Change)≥2.0作为差异表达标准,纵坐标值越大,表示P值越小,越有显著性。从火山图结果看,差异基因在不同区间得到分布。为更进一步的明确胆汁酸代谢调控通路基因表达水平的变化,以小鼠个体为样本,单个样本的每一个基因表达值作为变量构建数据矩阵,对其进行主成分分析(见图2)。在选取2个主成分的情况下,得分图(见图3A)中能够显著区分两组小鼠,结合载荷图(见图3B)信息发现,在高脂饮食压力下变化最为显著的基因是Cyp3a11和Scp2。
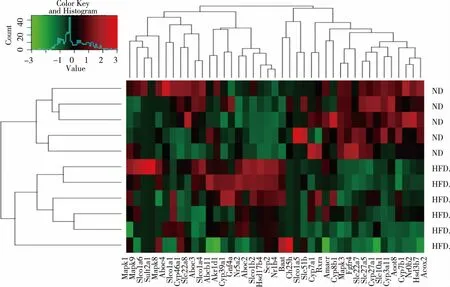
图1 胆汁酸通路中43个主要直接基因在高脂饮食压力下的轮廓可视化
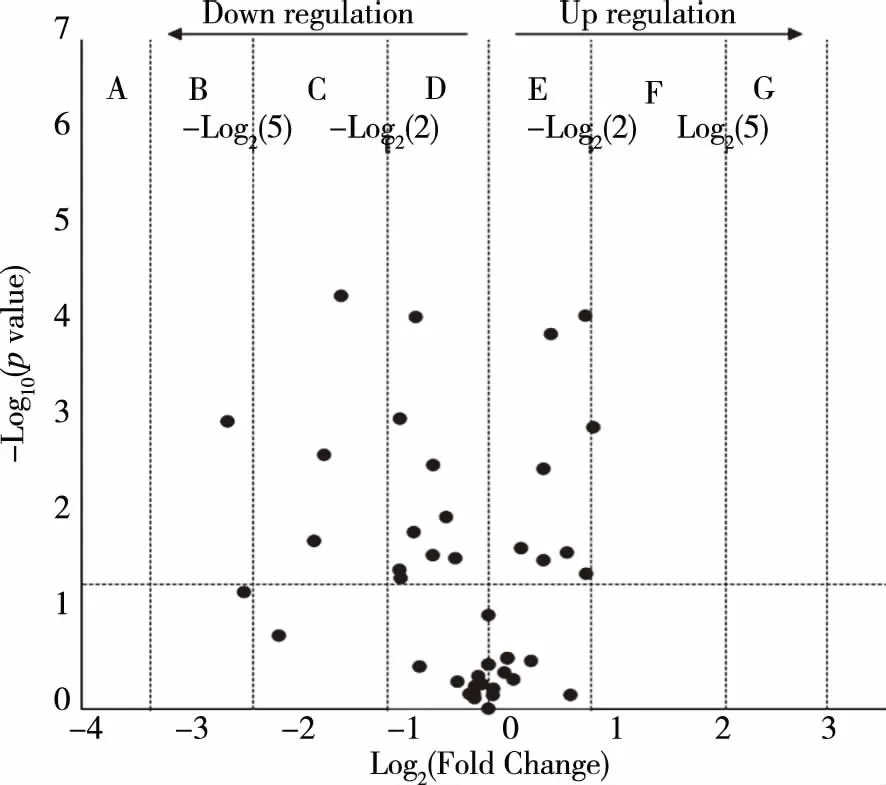
图2 高脂饮食压力下胆汁酸通路基因表达火山图
2.4.3基因表达的量化结果为了量化上述7个基因差异表达倍数值,将模型组差异基因平均表达值与对照组平均表达值相比得图4柱形图,纵坐标表示平均上下调倍数。从图4可知,Cyp3a11、Nr0b2、Hnf4aos和Fgfr4基因表达下调,Cyp39a1、Scp2、Hsd17b4基因表达上调,P均<0.05。

A:主成分分析得分图;B:主成分分析载荷图。图3 高脂饮食压力下胆汁酸轮廓主成分分析

图4 高脂饮食对Cyp3a11、Nr0b2、Hnf4aos、Fgfr4、Hsd17b4、CYp39a1、Scp2基因表达的调控
3 讨论
本研究显示,高脂饲料饲喂16周后,模型组小鼠TC、LDL-C水平显著增高(P<0.01,P<0.05),符合高脂模型血清学指标改变。CA和CDCA作为正常胆汁中的初级胆汁酸成分,本实验中CA和CDCA显著下降(P<0.05)。Watanabe等[9]研究表明,CA可促进能量消耗达到降低高脂饮食小鼠体重的作用。而CDCA具有利胆、溶石的作用,已将其作为治疗胆固醇结石药物被广泛应用于临床。说明在长期高脂饮食压力下,将增加患胆固醇结石的风险。
胆汁酸在体内的调控主要经肝脏和肠道得以实现,其合成主要有两条途径,经典途径是胆汁酸合成的主要途径,由胆固醇-7α-羟化酶(Cyp7a1)限速酶催化;替代途径,由甾醇27α-羟化酶(Cyp27a1)催化。早已论证,Cyp7a1在转录水平受到胆汁酸的反馈调节,在此过程中尽管FXR没有直接与Cyp7a1的启动子相结合,但却能够诱导小分子异源二聚体伴侣(SHP)的表达,目前认为,FXR与SHP是胆汁酸,脂质和葡萄糖稳态的重要调节剂。而Nr0b2作为SHP的启动子,亦间接参与胆汁酸通路的调节。胆汁酸的肠道调控,是通过激活肠道FXR核受体,上调肠道多肽成纤维细胞生长因子15(Fgf15),Fgf15经肠肝循环到达肝脏后与受体成纤维细胞生长因子受体4(Fgfr4)结合,上调应激活化蛋白激酶(JNK)及细胞外调节蛋白激酶(ERK)的活性[11]。JNK和ERK可通过磷酸化作用抑制Cyp7a1的表达[12]。Cyp3a11是胆汁酸进行生物转化过程中重要的酶,参与催化胆汁酸的羟基化反应,主要代谢产物为3-酮胆酸和多氧胆酸[13]。据Wahlström等[14]的研究报道,使用UPLC-MS / MS分析来自Cyp3a敲除小鼠的肝脏、胆囊、盲肠和血清中的胆汁酸组成与野生型littermate对照,显示胆汁酸组成没有显著差异。是否其中还有其他补偿机制的存在,将在今后的研究中进一步挖掘。本研究中,Cyp3a11、Nr0b2、Fgfr4基因表达水平显著下调(P<0.05)。
此外,本研究结果中,Cyp39a1、Scp2及Hsd17b4在高脂饮食压力下呈现高表达(P<0.05)。Smelt指出[15],Cyp39a1亦参与了胆汁酸合成的替代途径,最终生成鹅去氧胆酸。由于替代途径仅约占全部胆汁酸合成量的8.7%[16],所以固然Cyp39a1表达升高,在最终的含量测定结果中CDCA仍表现为降低。Scp2主要参与胞内胆固醇的合成与转化,据文献报道[17],当Scp2高表达时,一方面增加胆固醇转运,提高3-羟基-3-甲基戊二酸单酰辅酶A还原酶的活性,使肝脏胆固醇合成增加,胆固醇在胆汁中浓度上升;另一方面,其抑制Cyp7a1酶活性使胆汁酸合成减少,胆固醇排泄降低。反之,抑制Scp2表达,可有效降低胆固醇浓度[18],这也为调脂药物作用靶点提供新的视角。Hsd17b4,为类固醇代谢过程中重要的酶蛋白,目前较多实验研究表明[19],肝癌的发生及发展与雌二醇相关,雌二醇可有效减缓肝癌的病理过程,但Hsd17b4可将其灭活成为低活性的雌酮而促进肝癌细胞的增殖,在肝癌组织中Hsd17b4具有高表达。长期高脂饮食是否会增加肝脏癌症的患病率,还有待进一步深入的研究。
