BMSCs肝向分化过程中相关信号通路的研究进展
2018-07-16,,
, ,
(南华大学附属南华医院消化内科,湖南 衡阳 421001)
骨髓干细胞(Bone marrow stem cells,BMSCs)移植技术治疗肝脏疾病是研究的热点。BMSCs是一类具有多向分化能力的干细胞,在BMSCs分化过程中受到微环境及细胞因子的影响,其中肝细胞生长因子(Hepatocyte growth factor,HGF)作为一种多功能因子,调控细胞的生长分化及器官的发育等过程。近期研究表明HGF对BMSCs具有诱导肝向分化作用,本文就HGF对BMSCs肝向诱导分化过程中相关信号通路进行综述。
1 骨髓干细胞
细胞分化是同一来源的细胞涉及多种细胞因子及信号通道相互影响而逐渐形成各自特有的形态结构、生理功能和生化特征的复杂过程。BMSCs是多向潜能的干细胞,在特定的细胞微环境中,BMSCs可定向分化。HGF在BMSCs肝向分化过程中占有重要地位,可在一定的条件下,HGF诱导BMSCs向肝细胞分化[1]。因此,HGF作为体外诱导BMSCs向肝细胞方向分化的关键性细胞因子,是肝脏生长发育过程中最基本的细胞因子。
2 HGF及受体c-Met的结构及生物学功能
HGF作为一种多功能因子,参与细胞的增殖,分化,迁移等生物功能。HGF在人体多种细胞中表达,HGF是BMSCs以内分泌或旁分泌的形式分泌,由α链和β链组成,通过生物活性二硫键连接的异源二聚体[2]。目前的研究,主要集中在HGF诱导BMSCs肝向分化上。HGF通过与其受体c-Met结合而起作用。当HGF与其受体相结合,招募衔接蛋白生长因子受体结合蛋白2(growth factor receptor bound protein 2,Grb2)和Grb2相关结合蛋白1(grb-2-associated binder 1,Gab1)磷酸化。Grb2和Gab1是与受体直接相互作用的关键效应物,和其他衔接蛋白一起为更大的网络蛋白装置提供支架,最终促进多个信号传导途径的激活[3]。
HGF特异性受体c-Met蛋白由c-Met原癌基因编码,是含有酪氨酸激酶结构域的跨膜蛋白质。配体与受体结合导致酪氨酸残基磷酸化,被胞内含有src家族同源2结构域(src homology domain2,SH2)的信号分子识别并结合,从而激活下游的信号转导通路。
3 参与HGF诱导BMSCs肝向分化的信号通路
研究发现,c-Met激活后主要通过有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)通路及蛋白激酶C(protein kinase C,PKC)通路将信号传至细胞核内,调节细胞功能[4](图1)。
3.1有丝分裂原活化蛋白激酶信号通路MAPK信号可被生长因子激活,通过它们的同源酪氨酸激酶受体(tyrosine kinase receptor,TRK)发出信号。MAPK通路的信号通过由MAPK激酶(MAP kinase kinasekinase,MKKK)、MAPK激酶(MAP kinase kinase,MKK)和MAPK构成的三级激酶的依次激活,调节细胞的生长、分化等多种重要的细胞生理过程。
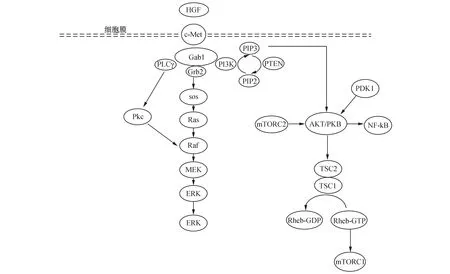
图1 HGF/c-Met信号通路调节BMSCs分化的途径注:当HGF与BMSCs上的c-Met受体结合,促进自磷酸化,激活不同的下游信号传导途径。Grb2:生长因子受体结合蛋白2;Gab1:Grb2相关结合蛋白1;sos:鸟苷核苷酸交换因子;Ras:Ras激酶;Raf:Raf激酶;ERK:细胞外调节蛋白激酶;PI3k:磷脂酰肌醇3-激酶;PKB:蛋白激酶B(又称AKT或Rac); MEK,丝裂原活化的细胞外信号调节激酶。PLCγ:磷脂酶 Cγ1;Pkc:蛋白激酶C
MAPK的活性受Ras激酶(rat sarcoma,Ras)/ Raf激酶(rapidly Accelerated Fibrosarcoma,Raf)表达调控,主要由细胞外调节蛋白激酶(extracellular regulated protein kinases,ERKs),c-Jun氨基端激酶(c-Jun N-terminal kinase,JNKs)和p38MAPKs三部分组成。一般而言,ERK信号通常与有丝分裂刺激激活的细胞存活,增殖和分化有关,而JNK和p38路径通常参与细胞生长和凋亡[3]。BMSCs分化可通过激活ERK/MAPK信号转导通路实现。T.Lu等[5]证实HGF和其他生长因子通过MAPK通路促进了BMSCs向肝细胞的分化,当ERK/MAPK信号通路受到抑制,肝向分化细胞比例显著降低,进一步证明了ERK/MAPK信号通路参与了BMSCs的肝向分化。
c-Met受体具有酪氨酸激酶活性,与生长因子结合导致自磷酸化,为含有SH2或磷酸酪氨酸结合(phosphotyrosine binding,PTB)结构域的蛋白如Grb2提供对接位点。这些衔接蛋白招募更多的效应物,如鸟苷酸交换因子(son of sevenless,SOS)。Gab1可以与c-Met结合被酪氨酸磷酸化,也可间接被Grb2激活。当Gab1被受体c-Met直接激活时,Gab1酪氨酸磷酸化持续时间较长,伴有MAPK及蛋白激酶B(Protein Kinase B,PKB)的活化,从而引起细胞的变形分化。GRB2与SOS结合,然后被募集到质膜。SOS蛋白是一种鸟苷核苷酸交换因子(guanine Nucleotide Exchange Factor,GEF),可促进Ras蛋白释放GDP,结合GTP,导致活性GTP结合形式的Ras增加。
Ras是一种单一的GTP酶分子。Ras蛋白在活性GTP结合形式和非活性GDP结合形式之间循环。在正常的静息细胞中,Ras与GDP结合并处于非活动的状态,而在细胞外刺激下,Ras结合GTP,其具有比GDP更多的磷酸基团,Ras被激活。因此,Ras蛋白在控制细胞增殖、分化等生理活动的信号传导途径中起开关作用。
Raf介导的MAPK途径是Ras几个重要的下游级联之一。激活的Ras导致Raf途径的第一个MKKK的活化。Raf磷酸化并激活MAPK激酶(包括MEK1、MEK2),后者继续磷酸化并激活细胞外调节蛋白激酶(包括ERK1、ERK2)。ERK1/2是最终的效应物,并对大量的下游分子(核和胞质)发挥作用。ERK1/2底物包括核成分,转录因子,膜蛋白和蛋白激酶,进而调控细胞的生物功能[6]。
信号通路也受到负反馈回路的很大影响。ERK磷酸化并抑制SOS,Raf和MEK1,减少ERK激活。这种复杂的调节方式反应了MAPK信号通路在BMSCs分化中的精确平衡。
有研究表明,通过MAPK信号通路还可以进一步影响其他信号通路,如MAPKs在NF-κB信号通路的活化中发挥重要的作用,可刺激细胞生长,抑制细胞凋亡[7]。当阻滞ERK通路时,导致转录因子β-链蛋白(β-catenin)核定位的减少,从而抑制了Wnt信号通路的信号传导[8]。
3.2磷脂酰肌醇激酶通路PI3K信号通路在哺乳动物细胞中广泛存在,调节细胞增殖、分化、衰老、生存等细胞功能。P13K属脂类激酶家族,其中I类P13K是研究最多的,是由催化亚基(p110)和调节亚基(p85)组成的异源二聚体,可被酪氨酸激酶活性受体和G蛋白偶联受体、Ras基因激活[9]。PI3K招募到细胞膜上,在体外可将PI4-磷酸酯转化成PI3,4二磷酸酯,磷脂酰肌醇4,5-二磷酸(PIP2)转化成磷脂酰肌醇3,4,5-三磷酸(PIP3)[10]。PIP3与PKB和3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase-1,PDK1)的PH结构域结合,将两个分子都募集到紧邻的质膜上,其中PKB通过PDK1在Tyr-308处的磷酸化被激活[11]。
结节性硬化复合物(tuberous sclerosis complex,TSC)作为Ras同源脑富集蛋白(rashomologenriched in brain,RHEB)的GTP酶活化蛋白,在稳定状态下可引起RHEB对GTP进行水解,从而将该蛋白从其活性GTP结合形式转化为其无活性GDP结合态。TSC被活化的PKB磷酸化,抑制RHEB活性,从而激活雷帕霉素(the mammalian target of rapamycin,mTOR)。在PI3K途径活化后,上游激酶PKB也可直接磷酸化TSC2,并使得能够通过RHEB活化mTOR,从而允许信号传播[12]。
mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶,通过两种不同的多蛋白复合物mTORC1和mTORC2发挥细胞生物调节重要作用。mTORC1是主要的下游效应物,控制下游靶标蛋白质合成。激活的mTORC1通过磷酸化两种主要的下游分子:翻译调控因子真核起始因子4E结合蛋白1(e IF4E-binding protein 1,4E-BP1)和核糖体蛋白S6激酶(ribosomal S6 kinase,S6K),进一步调控细胞的生物功能[13]。激活的S6K使mTORC2失活,通过负反馈回路抑制PI3K信号转导。而mTORC2通过PKB促进细胞存活,它可直接磷酸化Ser473上的PKB,对PKB的活化起到积极的作用。另一方面,mTORC2可以进一步调控肌动蛋白细胞骨架和细胞极性的组织,从而决定细胞的形态。
PI3K-PKB通路还可以影响其它信号通路的传递,如通过其介导的转录因子家族(E-twenty six,ETS)和核因子κB(nuclear Factor-KappaB,NF-κB)参与基因表达和细胞周期的调控。激活的PKB启动下游信号事件的级联,促进细胞生长,代谢,增殖,存活等生物功能,并间接触发级联事件,进而激活下游多种效应蛋白及通路,这些信号蛋白包括丝氨酸-苏氨酸激酶(PKB和PDK1)、蛋白酪氨酸激酶( Tec/BTK家族)、GTP结合蛋白的交换因子(grp1和Rac交换因子)、细胞骨架蛋白和Gab1,影响包括p38 MAPK、NF-κB和JNK/SAPK途径[11]。
PI3K信号通路被人第10号染色体缺失的磷酸酶(phosphatase and tensin homolog deleted on chromosome ten,PTEN)和Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type II,INPP4B)精确调控。PTEN是一种抑癌基因,具有蛋白磷酸酶活性剂脂质磷酸酶活性,对细胞周期、多种信号途径起负性调控作用。PTEN将PIP3去磷酸化PIP2,下调PI3K/PKB信号通路,使细胞的生长、增殖等活动受到抑制。INPP4B是一种脂质磷酸酶,促进细胞内磷酸肌醇的稳定,将磷脂酰肌醇3,4-二磷酸去磷酸化为3-磷酸磷脂酰肌醇,使PKB的激活受到抑制,导致PI3K/PKB信号通路被阻断[14]。提示PTEN通过调控PI3K信号通路抑制细胞的增殖、分化、凋亡等。
P13K是存在于细胞质中的脂类激酶,被HGF激活后,可活化下游关键蛋白PKB,调节细胞的多种生物功能。有研究发现,BMSCs分化过程中有下游蛋白PKB的表达,通过应用PI3K抑制剂LY294002阻断该通路在BMSCs中的活化,观察到BMSCs在增殖分化过程中受到了抑制,这主要表现在PKB的表达减少[15]。BMSCs的增殖分化能力明显下调,证明了阻断PI3K通路将抑制细胞的活性。
3.3蛋白激酶C通路HGF/c-Met还可以激活磷脂酶 Cγ1/二脂酰甘油/蛋白激酶C 信号转导通路(PLCγ1 /DAG/PKC 信号通路),广泛存在于多种细胞内,参与调控细胞生长、增殖、分裂等生理活动。在体外实验中,PKC的持续激活是一些细胞分化所必须的。PKC信号通路中的下游信号分子如cdc2,cyclinB磷酸化调节细胞的分裂和生长。PKC通过Raf-1激活MAPK通路,把信号传入核内。另外,PKC的直接磷酸化底物还包括核因子κB抑制蛋白(inhibitor of NF-κB,I-κB)和豆蔻酰化富丙氨酸C激酶底物蛋白(myristoylated alanine-rich C-kinase substrate,MARCKs)。其中I-κB在PKC的磷酸化下解离出有活性的NF-κB,它作为转录因子,也调节着许多早期反应基因c-fos,c-jun等的转录,调节细胞的增殖与分化等[16]。综上表明PKC 信号通路在细胞的增殖分化中发挥重要作用,促进细胞的生长发育。
4 诱导分化时细胞的变化
BMSCs肝向分化是一个综合变化的复杂过程,随着细胞信号的传导,细胞在分化过程中逐渐出现相关基因的改变及表达的改变,对细胞的代谢、生长等有着密切的影响,并出现肝细胞特有的代谢产物。
4.1基因表达的改变研究发现,BMSCs肝向分化过程中有121个基因表达发生了变化,其中约73%基因上调,约27%基因下调。这些基因涉及信号转导、能量代谢、基因转录及蛋白质合成等[17]。研究进一步指出,血清和糖皮质激素调节蛋白激酶(serum and Glucocorticoid Induced Kinase,SGK)基因可以通过HGF被激活,参与调节细胞存活,以及细胞-细胞和细胞-基质相互作用的信号通路。通过HGF联合其他因子诱导BMSCs研究发现,HGF可促进血清和SGK的上调,有利于细胞的存活及增殖,为BMSCs肝向分化提供了基础。姜华等[18]通过研究发现,在大鼠骨髓MSCs肝向分化模型中,利用芯片检测出,Fas、G6pc、S100a1、Ndufa7基因表达增加。Fas为内源性脂肪酸合成过程中的关键酶,参与脂肪代谢。G6pc 为葡萄糖-6-磷酸酶,是糖代谢过程中的关键酶。S100a1 参与大量细胞的周期调控、分化等过程。Ndufa7是泛醌氧化还原酶,存在于细胞线粒体上,参与线粒体呼吸链的调节,生成ATP。
4.2特殊蛋白的表达及代谢的改变甲胎蛋白(alpha fetoprotein,AFP)、白蛋白、细胞角蛋白18(cytokeratin 18,CK18)、α-1抗胰蛋白酶(α1-antitrypsin,AAT),酪氨酸氨基转移酶(tyrosine aminotransferase,TAT)是肝细胞特异性标志物。AFP及白蛋白是肝前体细胞分泌的一种胞浆蛋白,在幼稚的肝前体细胞中表达,是肝细胞未成熟的标志,随着细胞的成熟而消失。CK18是骨架蛋白,和白蛋白一起表达在成熟肝细胞中。有研究发现,利用HGF等诱导BMSCs肝向分化后,可以检测到白蛋白和CK-18蛋白的表达,提示BMSCs逐渐分化为成熟肝细胞[18]。
只有肝细胞才能产生、储存糖原,因此,在骨髓肝细胞分化为肝细胞,可检测出糖原的存在。Li等[19]对BMSCs进行体外培养,加入HGF等生长因子诱导后,观察到BMSCs糖原的产生,并进一步检测到BMSCs产生的AFP、CK18、ALB的表达,提示骨髓间充质干细胞在HGF等生长因子诱导下,可向肝样细胞分化。Al Ghrbawy NM等[20]通过实验发现,BMSCs经肝细胞分化培养基处理后,出现上皮细胞多边形的变化,并表达肝相关基因和蛋白质,证明了BMSCs成功分化为肝样细胞。
HGF/c-Met信号通路具有介导细胞增殖、迁移、分化、凋亡等功能,在BMSCs分化中发挥重要的作用,其中有PI-3K、MAPK、PKC等信号通路的参与。通过调控基因表达,BMSCs分化为肝细胞,表达AFP、白蛋白、CK18等肝细胞特异性标志物,并产生糖原及尿素。目前人们对HGF涉及的通路认识还不完善,比如HGF与受体c-Met结合后其大量的生物学结点研究较少,各通路相互之间的联系,及其它信号通路的激活状态等仍有未知。HGF诱导的BMSCs肝向分化,有利于肝脏的组织修复,随着BMSCs肝向分化研究的不断完善,将为肝病的治疗提供理论依据和参考。
