ER阳性乳腺癌中西达本胺逆转内分泌耐药
2018-07-14王雅楠朱静忠宁志强
周 游,王雅楠,张 堃,朱静忠,宁志强
深圳微芯生物科技股份有限公司,广东深圳 518057
雌激素受体(estrogen receptor, ER)阳性乳腺癌约占全部乳腺癌的70%,ER阳性乳腺癌细胞具有依赖雌激素生长的特性[1].内分泌治疗是大多数激素受体阳性乳腺癌首选治疗手段,通过降低体内雌激素水平(芳香化酶抑制剂和卵巢功能抑制剂)或抑制雌激素与ER的结合活性(选择性ER调节剂),抑制肿瘤细胞生长.常用的乳腺癌内分泌治疗药物有他莫昔芬、氟维司群、来曲唑、阿那曲唑和依西美坦等[2].但是,由于乳腺癌细胞本身及其周边微环境的改变,如ER突变或表达量变化、肿瘤细胞对激素依赖性下降或激素敏感性增加、微环境生长因子提供旁路增殖信号等,约1/3的患者在长期内分泌药物治疗后仍出现耐药和复发[3-4].目前,临床也在尝试各种不同作用机制药物与传统内分泌治疗药物序贯或联合应用以延长疾病控制时间,已获批的药物包括旁路生长信号PI3K/Akt/mTOR通路抑制剂everolimus,ER下游细胞周期蛋白依赖性激酶(CDK4/6)抑制剂palbociclib等[5-6].此外包括组蛋白去乙酰化酶(histone deacetylase, HDAC)抑制剂等多种药物已进入临床试验[7].
西达本胺(chidamide, Chida.)是中国首个上市的HDAC抑制剂药物,已被批准用于复发/难治性外周T细胞淋巴瘤(peripheral T-cell lymphoma, PTCL)治疗[8].体外研究显示,西达本胺能显著诱导肿瘤细胞的周期阻滞和细胞凋亡,同时对自然杀伤细胞(nature kill cells, NK cells)和抗原依赖的细胞毒T淋巴细胞(cytotoxic lymphocyte, CTL)介导的抗肿瘤免疫活性具有明显的促进,另外在诱导肿瘤干细胞分化、逆转肿瘤细胞的上皮细胞-间充质转化(epithelial to mesenchymal, EMT)方面也有作用,对增强耐药肿瘤对药物的敏感性和抑制肿瘤转移、复发等方面具有潜在的应用价值[9-11].本研究在体外培养的ER阳性乳腺细胞株以及相应的裸鼠原位移植瘤模型上,考察和验证了西达本胺与内分泌治疗药物的体内外联合治疗药效.
1 材料与方法
1.1 主要试剂
细胞增殖检测实验所使用反应试剂3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium(MTS)购自美国Promega公司,吩嗪硫酸甲酯(phenazine methosulfate, PMS)购自美国Sigma-Aldrich公司.Western blot实验所使用的一抗包括MEK1/2、phospho-MEK1/2(S217/221)、p44/42 MAPK (Erk1/2)、phospho-p44/42 MAPK (Thr202/Tyr204)、mTOR、phospho-mTOR (Ser2448)、akt、phospho-akt (Ser473)、p70 S6 kinase、phospho-p70 S6 kinase (Thr389),均购自美国Cell Signaling Technology公司;此外,Estrogen receptor alpha和Estrogen receptor alpha (phospho S118) 的一抗购自英国Abcam公司.上述抗体种属来源均为兔,使用二抗为goat anti-rabbit IgG antibody, HRP-conjugate(Merck Millipore).内参β-actin一抗购自美国Santa Cruz Biotechnology公司,种属来源为鼠,使用二抗为Goat Anti-Mouse IgG Antibody, HRP-conjugate (Merck Millipore).免疫组织化学实验使用Ki-67一抗(kit-0005)、相应二抗HRP-polymer anti-mouse/rabbit IHC kit(kit-5010)及DAB染色液(Kit-0014)和苏木素染色液(CTS-1099)等均购自福州迈新生物技术开发有限公司.
1.2 实验药物与细胞系
西达本胺原料药由深圳微芯生物科技股份有限公司自行合成,检验合格后用于本研究;4-羟他莫昔芬(4-hydroxytamoxifen, 4-OH TAM)、氟维司群(fulvestrant, Ful.)及雌二醇(β-estradiol, E2)均购自大连美仑生物技术有限公司;上皮生长因子(epidermal growth factor, EGF)和二甲基亚砜(dimethyl sulfoxide, DMSO)购自上海生工生物工程有限公司.实验所用化合物均以DMSO为溶剂配制成一定浓度的储备液,再根据需要加入到实验体系中,使化合物达到指定终浓度,在对照组中均加入了与实验组等体积的DMSO.
ER阳性人乳腺癌细胞系MCF-7购自美国国家典型培养物保藏中心(American Type Culture Collection, ATCC).常规培养条件为含0.1 g/L青链霉素及10%(体积分数)胎牛血清的DMEM培养液(dulbecco’s modified eagle medium);E2依赖性增殖培养条件为在含0.1 g/L青链霉素及10%(体积分数)活性炭处理胎牛血清的无酚红DMEM培养液中添加10 nmol/L E2.上述双抗、血清和培养液均购自美国Gibco公司,细胞培养于体积分数为5%的CO2和37 ℃的培养箱中.
1.3 细胞增殖实验
常规培养至对数增殖期的MCF-7细胞,采用E2依赖性增殖培养条件按3 000个/孔接种到96孔培养板中.24 h后向培养液中分别加入或不加入EGF(终质量浓度10 ng/mL),以及特定终浓度的Chida.(0 μmol/L或0.5 μmol/L)联合不同终浓度的4-OH TAM,或相应的溶剂对照,继续培养72 h后加入MTS检测试剂,即MTS和PMS溶液按体积比20∶ 1混合后每孔加入10 μL,37 ℃孵育2 h后用酶标仪于490 nm波长处检测光密度值.药物作用后以溶剂对照组光密度值OD(490)作为参照计算和比较细胞相对生长率.
1.4 蛋白表达与磷酸化水平检测
以E2依赖性增殖培养条件在培养皿中培养的MCF-7细胞,分别加入或不加入10 ng/mL EGF和(或)0.5 μmol/L Chida.,作用24 h后提取总蛋白(M-PER®哺乳动物蛋白抽提试剂,Thermo scientific,78501),采用Western blot检测蛋白表达及磷酸化水平,即蛋白样品经定量、SDS-PAGE电泳和转膜后,利用针对目标蛋白特异的抗体(一抗)进行杂交反应,随后以相应的二抗及其偶联的化学发光反应对目标蛋白进行相对定量.
1.5 动物荷瘤模型构建
6~8周龄雌性NOD/SCID小鼠购自北京华阜康生物技术有限公司,在SPF级动物实验室饲养至实验结束,温度、湿度控制与清洁按常规进行.裸鼠检疫合格后接种MCF-7细胞,以1×105μL-1无血清无抗生素培养液重悬细胞,与等体积Matrigel(BD Biosciences, 356234)混合,采用乳腺原位方式接种混合液200 μL/鼠,同时埋入雌激素片(0.36 mg/片,Innovative Research).定期监测小鼠体质量和肿瘤体积,待肿瘤平均体积达136 mm3时,根据肿瘤大小随机分为4组(溶剂对照组、Chida.单药组、Ful.单药组和Chida.+Ful.联合给药组),每组8只.
1.6 动物药效实验
制备0.02 g/L羧甲基纤维素钠和0.1% (体积分数)吐温-80的混悬液作为灌胃给药的溶剂,根据受试动物体质量,Chida.单药组及联合给药组以20 mg/kg剂量Chida.每天灌胃给药1次(quaque die, QD),对照组则每天灌胃等量溶剂.此外,Ful.单药组和联合给药组每周1次皮下注射(quaque week,QW)50 mg/kg剂量的Ful..每3 d测量1次肿瘤体积和动物体质量,给药6周后,按标准操作要求处死实验动物,摘取肿瘤组织,称量肿瘤质量后分别以质量分数为10%的甲醛溶液固定,室温保存.
1.7 免疫组织化学实验
将固定于甲醛溶液中的肿瘤组织取出水洗,在递增梯度浓度乙醇溶液中渐次浸泡脱水、二甲苯透明后石蜡包埋和组织切片.切片附着于载玻片后,依次通过二甲苯脱蜡、递减梯度浓度乙醇浸泡复水、在柠檬酸钠缓冲液中进行抗原热修复、双氧水孵育消除过氧化物酶,PBS清洗后滴加羊血清封闭.
完成封闭后,在组织切片上滴加一抗工作液,置湿盒4 ℃孵育过夜.一抗孵育完成后,经PBS清洗,滴加二抗工作液,室温孵育15 min.PBS清洗后进行DAB显色反应,反应完成经苏木素溶液复染、盐酸溶液分化、乙醇(浓度梯度递增)浸泡脱水、二甲苯透明后滴加中性树脂、盖玻片封片.在20×物镜下观察染色结果,随机视野拍照.
1.8 统计学分析
本研究中两组间的差异比较采用t检验,P<0.01时认为差异具统计学显著意义.
2 结果及分析
2.1 4-OH TAM及联合Chida.对乳腺癌细胞系增殖的影响
4-OH TAM是他莫昔芬的活性代谢产物,在体外水平测试不同作用浓度的4-OH TAM单药及联合0.5 μmol/L Chida.时对MCF-7细胞E2依赖性增殖的影响.结果表明,4-OH TAM单药作用72 h已对MCF-7细胞的增殖具有一定抑制作用,且随着作用剂量的升高,抑制作用趋于明显.0.5 μmol/L Chida.单药作用于MCF-7细胞时,约10%的细胞增殖受到了抑制;0.5 μmol/L Chida.联合不同剂量4-OH TAM存在于培养体系中时,二者增殖抑制药效在一定剂量范围内具有叠加效应(图1).

图1 4-OH TAM及联合Chida.对MCF-7细胞增殖的影响Fig.1 Effects of 4-OH TAM combined with Chida.on proliferation of MCF-7
2.2 Chida.对EGF引起乳腺癌细胞内分泌治疗耐受的逆转
EGF是上皮细胞增殖刺激因子,在缺乏外源雌激素或雌激素依赖的生长信号通路被抑制时,ER阳性乳腺癌细胞可以转而依赖肿瘤基质细胞或其他肿瘤微环境细胞产生的EGF因子维持其增殖生长.如图2,E2依赖性增殖的MCF-7细胞在10 ng/mL EGF作用时,相对于无EGF条件时,并未表现出额外增殖(P>0.05); 4-OH TAM(2.5 μmol/L或5 μmol/L)对E2依赖性增殖的MCF-7细胞产生约13%和25%的抑制时,10 ng/mL EGF可在一定程度上抵抗4-OH TAM对细胞增殖的抑制(抑制率分别降至0和12%,P<0.01), 表现为MCF-7细胞对4-OH TAM的耐药.4-OH TAM与0.5 μmol/L Chida.共同处理时,药效发生叠加,EGF所引起的4-OH TAM耐药也被Chida.逆转(P>0.5, 即联合用药的两实验组中,EGF的作用与否无差异).

***表示P<0.01图2 Chida.逆转EGF诱导的4-OH TAM耐药Fig.2 Chida. reverses EGF-induced 4-OH TAM resistance
2.3 Chida.对EGF相关通路活性的影响
通过检测MCF-7中EGF相关通路蛋白及其磷酸化水平变化,发现EGF显著促进其下游通路上激酶(MEK1/2、ERK1/2和AKT等)的活化(磷酸化),而Chida.处理可以明显降低其活化水平.此外,Chida.处理还降低ER磷酸化,尤其在EGF与Chida.同时存在时,ER磷酸化仍被显著抑制,显示出Chida.可通过独特的ER通路抑制活性,阻断EGF对ER活性的维持(图3).
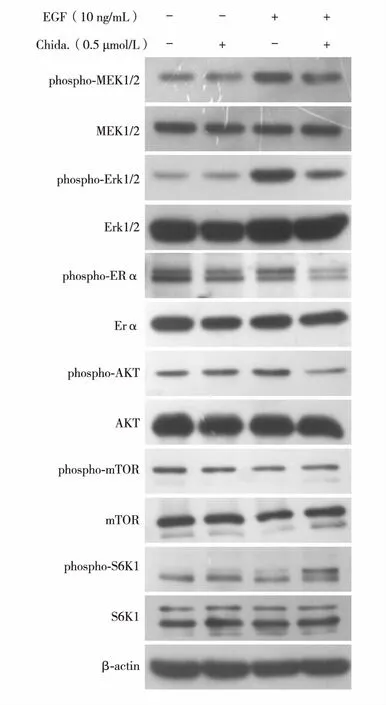
图3 Chida.对EGF及ER通路相关激酶活性的影响Fig.3 Inhibition of Chida. on activation of EGF and ER pathway-related kinases
2.4 Chida.联合内分泌治疗的体内药效
在MCF-7原位移植瘤裸鼠模型上给药4周后,Chida.(20 mg/kg, QD)和内分泌治疗药物Ful.(50 mg/kg, QW)2个单药组均能显著抑制移植瘤生长;Chida.+Ful.联用时抑制效果更明显(P<0.01), 肿瘤体积保持在给药前基线水平,几乎完全抑制了肿瘤生长.同时各药物处理组实验动物体质量无明显变化,表明两药在协同药效的同时无明显毒性增加(图4).
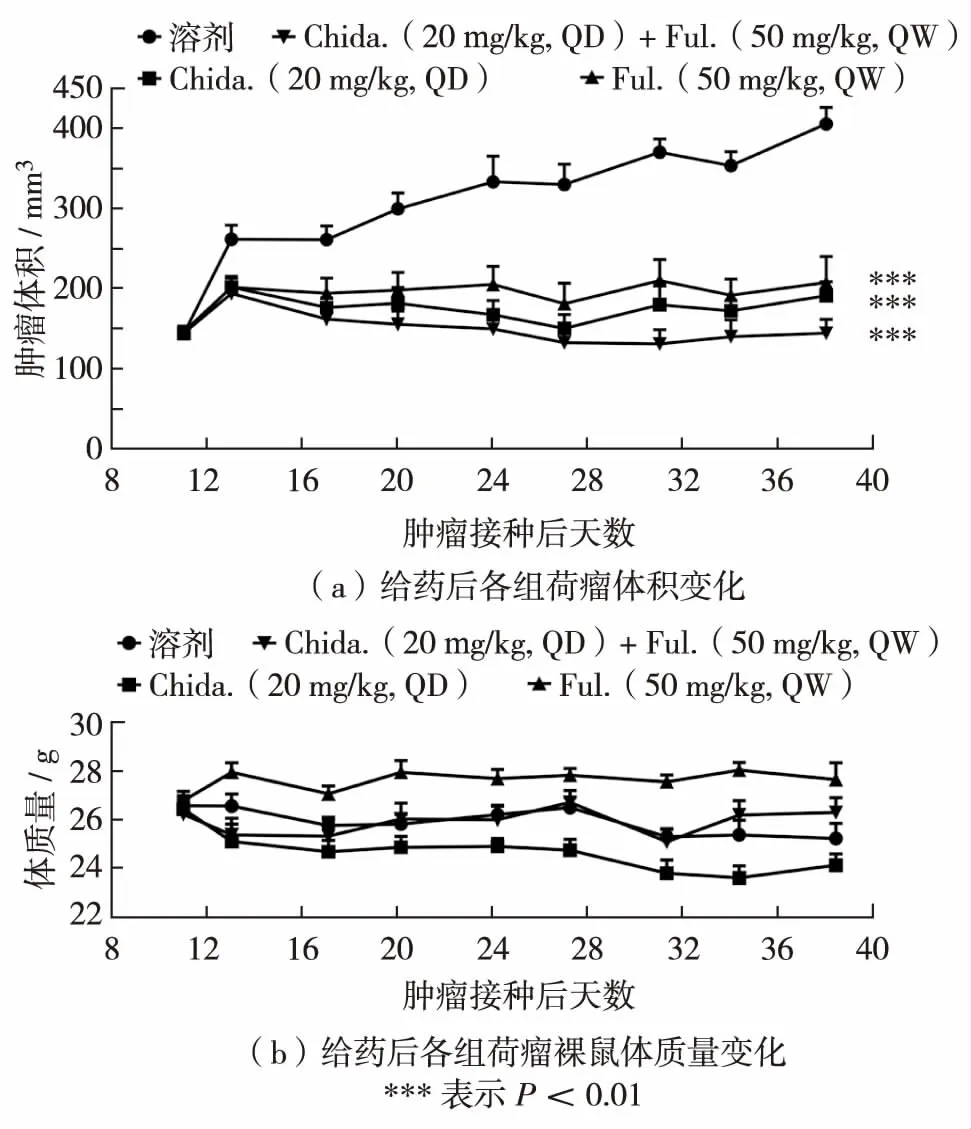
图4 Ful.和Chida.联合用药的体内药效Fig.4 In vivo anti-tumor effects of Ful.combined with Chida.
Ki-67是一种增殖细胞相关的核抗原,是病理分析中判断肿瘤细胞增殖情况的重要指标之一,免疫组织化学染色阳性率越高表示正在增殖的肿瘤细胞越多[12].如图5,通过对各动物模型的肿瘤样本进行Ki-67免疫组织化学检测发现,相对与溶剂对照组,Chida.单药、Ful.单药及Chida.+Ful.联用组中,Ki-67阳性的增殖细胞均减少,且两药联用组减少最为明显,表明Chida.与Ful.对体内ER阳性肿瘤细胞有显著的联合抑制药效.
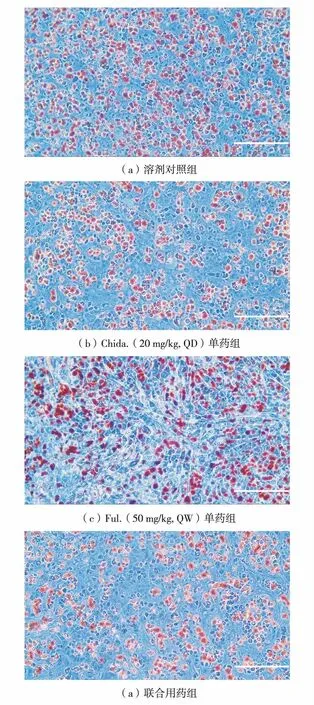
图5 Ki-67免疫组织化学检测结果(×20)Fig.5 Results of immunohistochemical staining of Ki-67(×20)
3 讨 论
HDAC是参与蛋白乙酰化修饰的一个蛋白酶家族,主要针对染色质组蛋白以及其它非组蛋白底物(如p53、Rb和NF-kB、STATs等)的乙酰化,进而影响染色质空间构象以及转录因子类底物蛋白的活性,最终改变特定基因群的转录,属于重要的表观遗传调控形式[13].HDAC抑制剂通过诱导抑癌基因和促凋亡基因的转录活化,抑制肿瘤细胞生长.除此以外,HDAC抑制剂还广泛调节多种与肿瘤耐药或生长依赖性信号相关的通路活性,已有研究提示,HDAC抑制剂可以诱导ER阴性乳腺癌细胞中的ER表达,从而恢复对抗雌激素药物的敏感性、抑制芳香化酶活性与芳香化酶抑制剂产生协同效应,并抑制EGF受体介导的旁路生长信号通路[14-16].因此,在乳腺癌治疗中,联合HDAC抑制剂具有增强传统抗雌激素治疗敏感性和长期疗效的应用潜力.
本研究首先在ER阳性乳腺癌细胞模型中评价了亚型选择性HDAC抑制剂Chida.与内分泌治疗药物的联合药效,观察到二者具有一定药效叠加.在4-OH TAM耐药模型中,进一步发现Chida.可显著逆转EGF所诱导的耐药.研究初步探讨了相关机制,结果表明Chida.能够显著抑制EGF通路下游激酶及ER的磷酸化,因此,Chida.可能通过改变生长因子介导的信号通路活性增强激素受体阳性乳腺癌细胞对内分泌治疗的敏感性.此外,在原位移植瘤动物模型体内,也证实了Chida.与内分泌治疗药物联用时具有相对单药更明显的肿瘤抑制效果.综上,Chida.可能在针对难治/复发的ER阳性乳腺癌治疗中发挥逆转耐药的作用,进一步的临床研究将可能更深入发掘其联合内分泌治疗的应用价值.
