三氧化二砷对慢性粒细胞白血病Hedgehog信号转导通路分子基因表达影响的研究
2018-07-12田丽月杨璐媛吴龙月张丽坤张鑫縢悦秋刚宏林杨东光
田丽月,杨璐媛,吴龙月,张丽坤,张鑫,縢悦秋,刚宏林,3,杨东光*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.哈尔滨医科大学附属第一医院中心血液实验室,黑龙江 哈尔滨 150001;3.哈尔滨食品药品检验检测中心,黑龙江 哈尔滨 150025)
CML是一种起源于造血干细胞(hematopoietic stem cell,HSC)水平的恶性克隆性疾病,以存在t(9;22)易位的费城染色体为特征,其融合基因的蛋白产物Bcr-Abl具有持续增高蛋白酪氨酸激酶活性,被认为是CML的致病性蛋白[1]。CML多表现为乏力、消瘦、发热、自汗或盗汗、腹痛、脾肿大、肝肿大、淋巴结肿大等[2-5]。根据其临床表现,中医学多将本病归为“虚劳”“症瘕”“积聚”“血证”等范畴,并认为,本病的发生多因“虚”“毒”“瘀”所致[6]。王运津等[7]将慢粒辨证分为肝热血瘀型、热毒炽盛型和正虚邪实型,慢性期多为肝热血瘀型,治宜清肝化瘀为主;加速期和急变期多为热毒炽盛型和正虚邪实型,治以清肝化瘀,益气养阴,宜清肝化瘀为主[8]。
以伊马替尼(Imatinib mesylate, IM)为代表的蛋白酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)针对CML的致病蛋白Bcr-Abl设计,是目前CML的标准治疗方案。但发生IM耐药的CML患者病情进展迅速、预后不良,IM耐药因此成为CML治疗的瓶颈和亟待解决的问题。
近年来研究认为,耐药的关键是CML干细胞(Leukemia stem cells,LSCs)对IM治疗不敏感,产生这一现象的原因是Bcr-Abl并非CML-LSCs赖以生存的唯一通路,在IM作用下,CML-LSCs可以依靠其他通路提供的生存信号得以存活。自我更新能力和白血病形成能力是LSCs的主要功能,研究证实,Hh通路是影响CML-LSCs自我更新能力和白血病形成能力的重要通路。Hh通路的活化起始于细胞外配体Hh,该肽与细胞膜受体Ptch的结合解除了Ptch对Smo的抑制作用,因此,Smo可以将其信号传递给进入初级鞭毛的Gli2,Gli2进入细胞核,活化Gli1及其下游的靶基因Ptch和CyclinD1。Gli1是负责全面活化Hh通路的基因,并通过Ptch以负反馈的形式调控Hh信号通路的范围和强度[9]。因此,Gli1和Gli2是执行Hh信号的关键蛋白。
亚砷酸(Arsenic trioxide, ATO)在2010年被认定为Hh通路的靶向性抑制剂,这为ATO应用于CML的IM耐药治疗提供了理论上的可能性。但ATO对CML-LSCs及其Hh通路的抑制作用及抑制机制尚未阐明。本课题组率先在应用ATO治疗并获得满意疗效的APL患者上进行了ATO对Hh通路抑制作用的验证。但ATO对Hh通路重要分子表达的影响尚有待证实。
本研究以CML细胞株K562为模型,初步探讨ATO对CML细胞Hh通路关键分子抑制作用及机制,为该药应用于CML的临床治疗提供理论基础。
1 材料与方法
1.1 材料
人类CML细胞株K562(本实验室长期培养);ATO注射液(10 mg/10 mL,哈尔滨伊达药业);TRIzol(invitrogen公司);逆转录试剂盒(PROMEGA公司);Fast Start Universal SYBR Green PCR Master实时定量PCR试剂盒(罗氏公司);RIPA强裂解液(碧云天公司);抗c-Abl抗体(sc-56887,Santa Cruz公司);碱磷显色二抗(Amersham公司)。
1.2 方法
1.2.1人类CML细胞株K562培养与处理
K562细胞使用含10%胎牛血清(杭州四季青)和浓度为100 IU/M青链霉素(Invitrogen)的1640培养基中(Gibco),置于37°C细胞培养箱中长期培养。实验时,使用不同浓度的ATO溶液连续作用于K562细胞48 h,并收集细胞,做下一步检测。
1.2.2实时定量PCR
收集经过浓度分别为0、0.5、1、2 μM ATO处理的K562细胞,采用TRIzol分别对细胞株的总RNA进行抽提,然后逆转mRNA至cDNA。应用primer Express2.0软件 (ABI公司)设计qRT-PCR引物,并交由上海生工合成。引物序列见表1。
应用Fast Start Universal SYBR Green PCR Master试剂盒,依据生工提供的退火温度设定反应条件,进行目的基因扩增。所有对目的基因的检测,均重复3次,取平均值。使用2-△△CT计算处理前后基因变化的比值。
1.2.3免疫印迹
收集经过浓度分别为0、1、2、4 μM ATO处理的K562细胞,采用RIPA强裂解液提取蛋白后进行SDS-PAGE电泳,电泳结束后,用蛋白转移装置将蛋白转移到硝酸纤维素膜上,按转移蛋白的常规方法进行。转移结束后,进行免疫印迹、碱磷显色及灰度分析。采用抗体为抗c-Abl 抗体及碱磷显色二抗成像。
1.2.4统计学处理
2 结果
2.1 ATO对CML细胞Hh信号转导通路分子基因水平的影响
经不同浓度ATO连续作用于K562细胞株48 h后,我们对标本的目的基因进行了有效扩增。结果发现,ATO 对Hh通路的核心转录因子Gli1和Gli2 mRNA的表达具有显著的抑制作用,其抑制作用呈剂量依赖性(P<0.05)(Fig.1)。ATO可以上调Hh通路抑制因子ptchmRNA的表达(P<0.05)。但Smo mRNA的表达在各浓度ATO的作用下均未受到影响。
2.2 ATO对CML细胞P210/Bcr-Abl蛋白表达的影响
经不同浓度ATO连续作用于K562细胞株48h后,我们检测了K562细胞P210/Bcr-Abl蛋白的表达情况。结果发现,ATO对P210/Bcr-Abl蛋白表达具有显著的抑制作用,其抑制作用呈剂量依赖性(P<0.05)(Fig.2)。
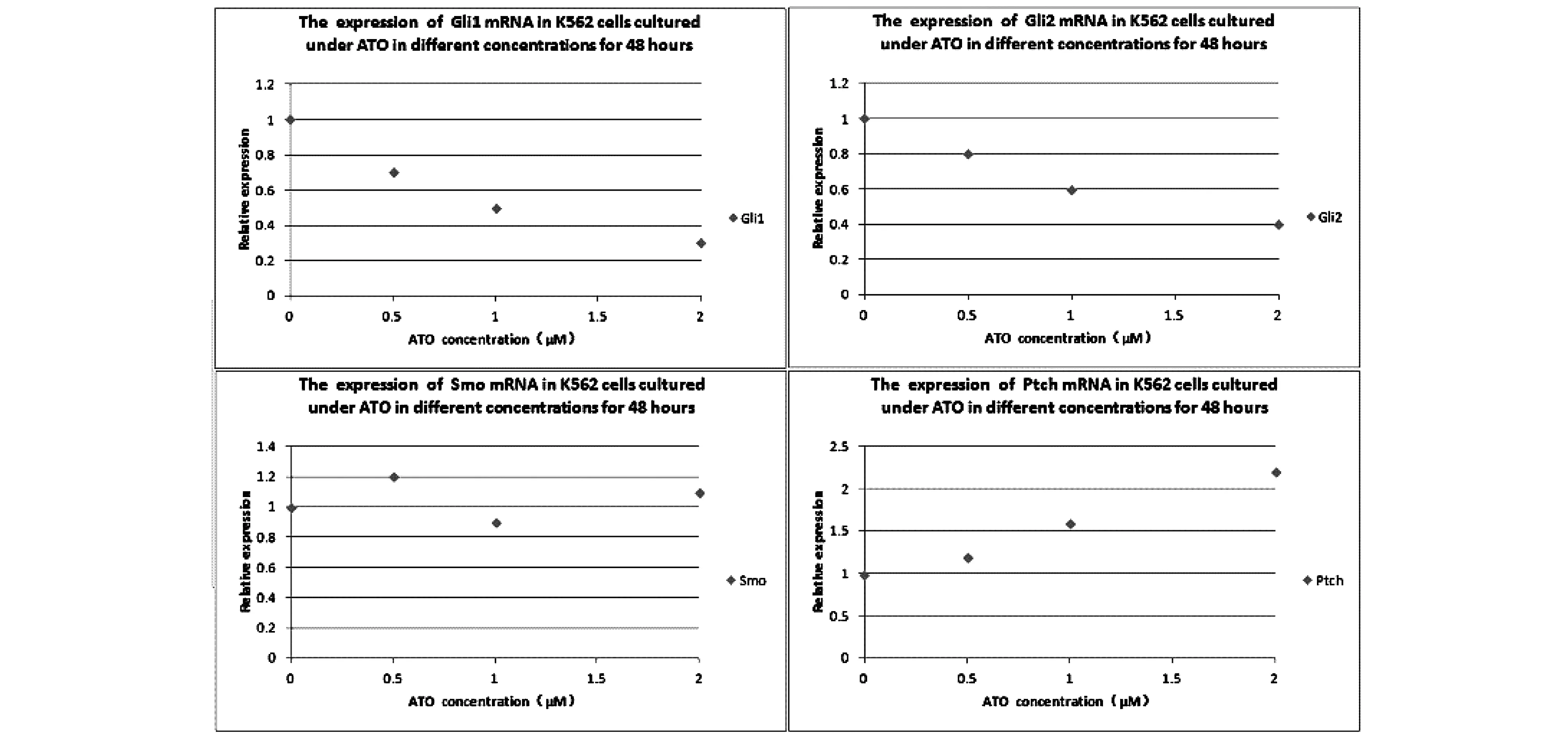
Fig.1 The expression of Gil1, Gli2, Ptch and Smo mRNA in K562 cells cultured under ATO in different concentrations for 48 hours
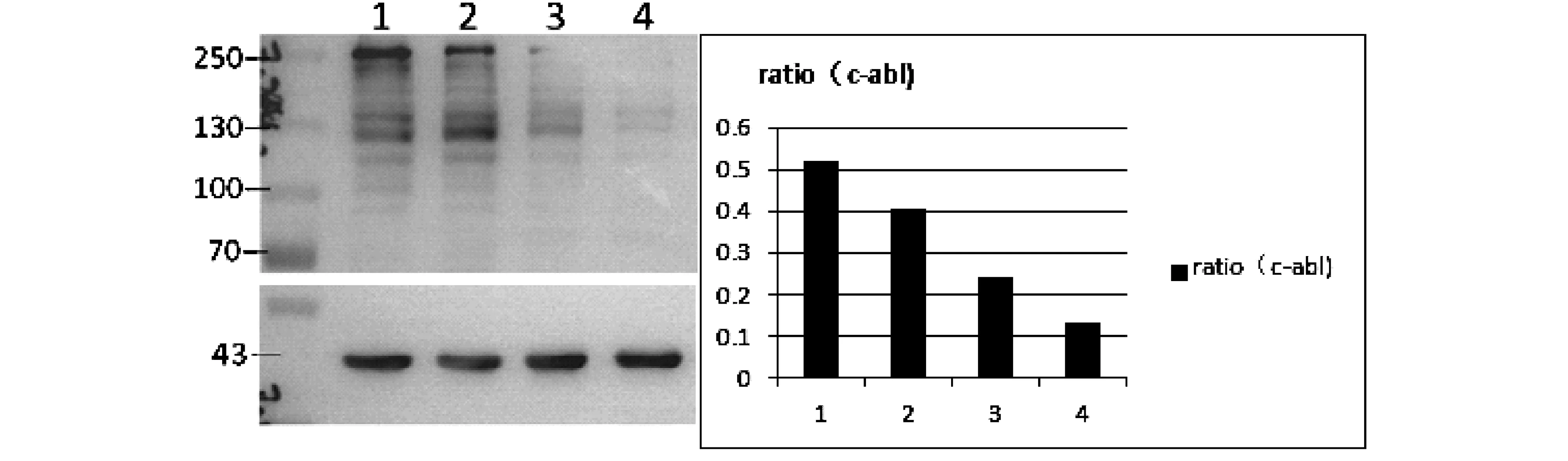
Fig.2 The expression of P210/Bcr-Abl in K562 cells cultured under ATO in different concentrations for 48 hours
3 讨论
砒霜又名白砒,为传统的以毒攻毒中药,《本草纲目》记载:“砒乃大热大毒之药,而砒霜之毒尤剧”。其药性峻猛辛,大热,有大毒,归肺肝经,具有祛痰止哮、截疟、蚀腐、杀虫等作用,用于治疗寒痰哮喘、疟疾、休息痢、梅毒、痔疮、瘰疬、走马牙疳、癣疮、溃疡腐肉不脱等[10]。而经中药砒霜提取制成的静脉制剂,称为三氧化二砷(As2O3)或亚砷酸。目前该药已广泛应用于临床,治疗多种恶性血液病,如白血病、骨髓瘤、骨髓增生异常综合征等,并得到全世界的公认[11]。
ATO治疗CML历史悠久,最早的抗CML药物。ATO对CML的作用机理集中在几个方面:一是ATO能够活化CML细胞内的自噬通路,直接降解Bcr-Abl蛋白[12];二是ATO可以诱导CML细胞发生凋亡,可以显著增强IM诱导CML细胞凋亡效应,且与IM无交叉耐药现象[13-14]。三是低浓度的ATO可以杀伤静止期的CML-LICs,其与阿糖胞苷或α-干扰素(Interferon alpha,IFN)联合应用,对CML-LICs的克隆形成能力和白血病形成能力都具有很好的抑制效果[15-16]。可见,ATO对CML-LICs的早幼粒细胞白血病蛋白(promyelocytic leukaemia protein,PML)具有抑制作用。
在近年的研究中,Hh通路在CML发生耐药过程中的重要作用逐渐被证实。研究发现,Hh通路是影响CML-LSCs自我更新能力和白血病形成能力的重要通路。体外实验中,Smo抑制剂能够显著降低CML患者的骨髓细胞长期培养起始细胞(Long term culture-initiating cell,LTC-IC)克隆数,证实了Hh通路对CML-LSCs自我更新能力的重要作用。在体内实验中,采用逆转录病毒介导的CML鼠模型,发现Smo的缺失和应用其抑制剂可以降低CML鼠的白血病发病率和二次移植发病率、延长其发病潜伏期;Smo过度表达则促进LSCs增殖和CML疾病进展,进一步证实了Hh通路对CML-LSCs白血病形成能力的影响[17]。不仅如此,Hh信号对CML的重要作用还体现在其是CML患者临床分期和影响IM治疗效果的重要标志。研究发现,Shh、Smo和Gli1等Hh通路分子不仅在CML患者中呈高表达,且在BP期的表达量显著高于CP期[18]。此外,Hh通路的负反馈调控因子Ptch低表达是CML患者预后不良的标志,Ptch是预测IM治疗失败的敏感和特异性指标[19]。
值得注意的是,Hh通路靶向抑制剂在体外实验中的良好疗效与其直接应用于CML患者尚有很大距离。目前新研发的小分子药物,均为针对Hh通路分子Smo的,但需要进行临床前研究以评价其安全性后才能走向临床[20]。其次,在髓母细胞瘤等疾病中发现,Smo抑制剂的应用可导致患者对该疗法耐药[21]。此外,Smo下游分子Gli2和cyclin D1的直接活化,可以绕过Smo抑制剂的作用靶点,是Smo抑制剂耐药的另外一个原因[22]。所以,由于缺乏临床应用经验,目前Hh通路抑制剂尚无法在CML患者中广泛应用。
2010年有学者发现,ATO对Hh通路具有靶向性抑制作用,陆续有研究者通过体内外实验证实,ATO通过此种机制对多种肿瘤发挥杀伤作用[12-13,21-22]。ATO是Hh的天然抑制剂,安全应用于急性早幼粒细胞白血病(Acute promyelocytic leukemia,APL)临床治疗近40年[17],不仅具有安全性,而且对Hh抑制剂耐药的患者也有抑制效果。鉴于ATO对Hh通路抑制作用的研究现状,本研究将ATO作用于CML细胞株K562,以期探讨ATO对CML细胞该通路的作用效果。
我们首先探讨了ATO对CML细胞株Hh通路分子mRNA表达的影响,发现ATO对Hh通路的核心转录因子Gli1和Gli2具有剂量依赖性抑制作用,而对Hh通路的抑制因子ptch具有剂量依赖性上调作用。在相似浓度,ATO对CML细胞株Hh通路分子mRNA表达的影响与对P210/Bcr-Abl蛋白表达的影响一致,并且对Hh通路分子mRNA表达的影响在0.5 μM即已发生,早于P210/Bcr-Abl蛋白表达的变化。说明,ATO对Hh通路的影响并非发生于降解P210/Bcr-Abl蛋白之后。因此,ATO对CML细胞Hh通路的抑制具有特异性。
总之,在CML细胞中,ATO对Hh通路具有显著的抑制作用,主要是通过抑制转录因子Gli1和Gli2mRNA表达,并同时上调Hh通路抑制因子ptch的mRNA表达发挥作用。该作用具有特异性,与ATO对P210/Bcr-Abl蛋白的降解无关。本研究为扩大ATO应用于IM耐药的CML提供了一个坚实的理论基础。
