HER-2阴性晚期胃癌外周血循环肿瘤细胞检测及临床意义
2018-07-12朱莹易善永郭云霞吕朋举耿伟民赵玲彭湃
朱莹, 易善永, 郭云霞, 吕朋举, 耿伟民, 赵玲, 彭湃
胃癌起源于胃黏膜上皮细胞,世界范围内发病率位居第四,病死率位居第三[1-2]。我国胃癌发病率居第二位,病死率居第三位[3]。胃癌早期症状无特异性,诊断率很低,确诊时大部分已为晚期,病情进展快,缺乏有效评价指标,5年生存率不足30%。循环肿瘤细胞(circulating tumor cells,CTC)是自发或由于诊疗操作技术从实体恶性肿瘤原发灶或转移灶进入外周血液循环的各类肿瘤细胞统称[4]。与临床常用肿瘤标志物检测(血清CEA、CA724等)、肿瘤相关影像学检查(彩超、CT、MRI、PET等)相比,CTC能较早提示肿瘤复发与转移。检测外周血CTC无创、便捷,易于被患者接受,便于监测肿瘤进展及评估患者生存情况[5]。本文通过检测HER-2阴性晚期胃癌患者外周血CTC,探讨与胃癌临床特征之间的关系。
1 资料与方法
1.1一般资料选取2016年1月至2017年8月,郑州市中心医院肿瘤科收治的35例HER-2阴性晚期胃癌患者,设为胃癌组。男19例,女16例;≤70岁21例,>70岁14例;腺癌26例,黏液腺癌4例,印戒细胞癌5例;转移部位数目1处28例,≥2处7例;ECOG评分≤1分28例,2分7例。入组标准:①经病理组织学确诊;②年龄≥18岁;③均为无手术指征的局部进展期、转移或复发的晚期胃癌患者;④ECOG评分为0~2分,预计生存期>3个月;⑤HER-2经FISH检测为阴性;⑥心、肝、肾及骨髓功能正常。排除标准:①HER-2阳性胃癌患者;②存在中枢神经系统转移;③孕妇及哺乳期妇女;④合并重症感染;⑤患有其他原发恶性肿瘤;⑥正在参加其他临床试验。本研究方案通过郑州市中心医院医学伦理委员会批准,患者及家属均签署知情同意书。另选择20例良性胃疾病患者为良性胃疾病对照组和20名健康者为健康对照组。3组在性别、年龄等一般资料方面比较,差异无统计学意义(P>0.05)。
1.2方法采用免疫磁珠微粒阴性富集并行免疫荧光原位杂交(immune fluorescence in situ hybridization imFISH)技术检测患者CTC。基本流程:抽取患者外周血3.2 ml,通过上皮细胞黏附分子(Ep-CAM)抗体磁珠富集上皮细胞,将细胞固定,采用DAPI荧光核染料、CD45荧光抗体和CK8、CK18、CK19荧光抗体对细胞进行标记;采用半自动四色荧光显微镜进行分析,将CK阳性、CD45阴性上皮细胞定义为CTC,以CTC≥2个/3.2 ml外周血判定为阳性。
1.3统计学方法采用SPSS 19.0软件进行统计学分析。计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
胃癌组中11例检出CTC,阳性率31.4%(11/35)。良性胃疾病对照组及健康对照组均未检出CTC。胃癌组患者中≤70岁的共21例,其中8例CTC阳性,阳性率为38.1%,>70岁的14例,其中3例CTC阳性,阳性率21.4%;男19例中5例CTC阳性,阳性率26.3%,女16例中6例CTC阳性,阳性率37.5%;ECOG评分0~1分28例,7例CTC阳性,阳性率25.0%,2分7例,4例CTC阳性,阳性率57.1%。胃癌组CTC阳性率与转移部位数目有关(P<0.05)。不同性别、年龄、ECOG评分、病理类型患者间CTC阳性率比较,差异无统计学意义(P>0.05)。详见表1。
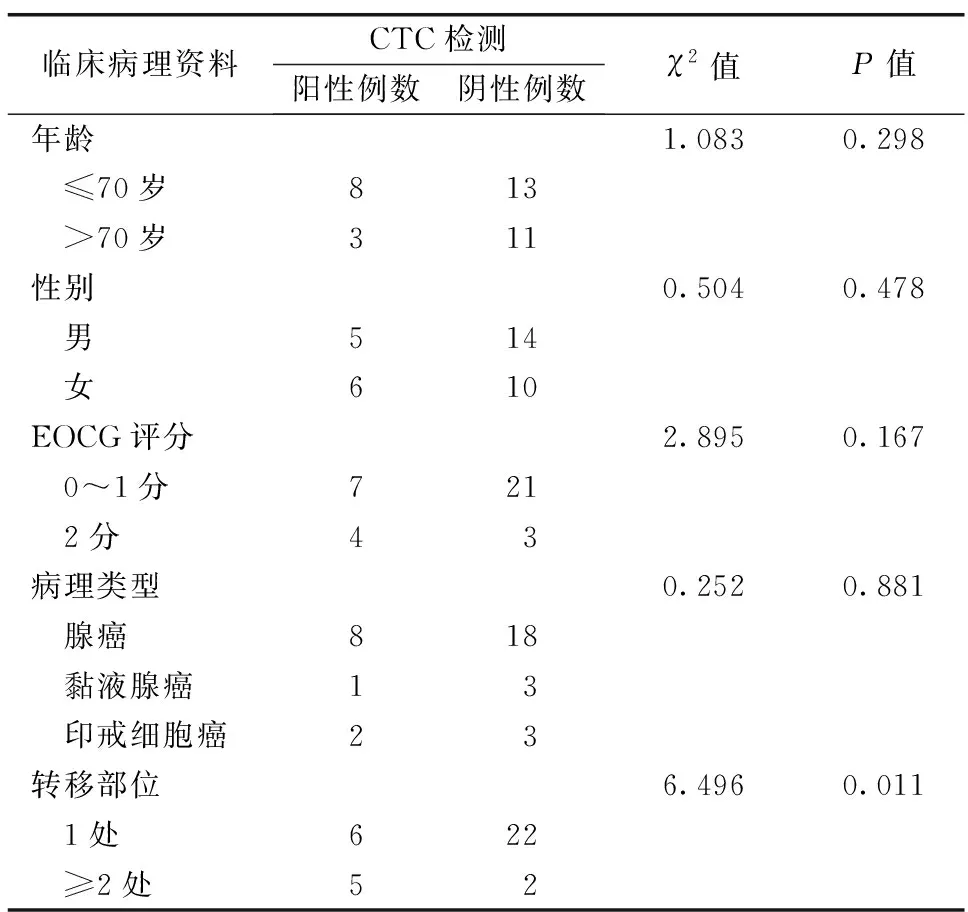
表1 HER-2阴性晚期胃癌患者CTC数值与临床特征关系
3 讨论
1869年, Ashworth等[6]首次在转移瘤患者血液中发现了CTC,由于技术落后,从外周血精确检测极低浓度CTC非常困难。随着检测技术进步和肿瘤生物学深入研究,CTC成为肿瘤临床和基础研究的热点。科学家们发现,CTC在乳腺癌、非小细胞肺癌、前列腺癌、结直肠癌等肿瘤早期诊断、疗效评估、转移预测、判断预后方面应用价值很高[7-10]。最新NCCN乳腺癌指南(2017.V3)已将CTC纳入TNM分期系统。乳腺癌患者外周血CTC已在2018年1月1日全球启动AJCC第八版癌症分期系统中被列为预后提示因子。目前,国内外针对胃癌CTC的相关研究不多。Okabe等[11]在136例进展期胃癌患者中检测到25例(18.4%)CTC阳性,弥漫型和伴远处转移型患者中更常见,且CTC阳性患者无进展生存(PFS)明显短于CTC阴性患者(P<0.05),因此认为,进展期胃癌患者CTC阳性检测结果是一项独立预测因素。Kolostova等[12]采用细胞形态学和分子分析检测22例胃癌患者外周血CTC,阳性率为59%(13/22),其中可切除组CTC 7例,阳性率70%(7/10),不可切除组阳性率50%(6/12)。2015年,Lee等[13]报道100例转移性胃癌患者中27例检测到CTC≥5个。CTC检测阳性组对细胞毒药物化疗的反应差,与CTC阴性组相比,差异有统计学意义(P<0.05)。CTC阳性组PFS短于CTC阴性患者,研究表明,CTC与转移性胃癌患者对化疗反应性差相关。郭迎雪等[14]对80例胃癌患者进行CTC无创性标准化检测,发现胃癌患者CTC水平明显高于慢性胃炎患者和健康人,与年龄、性别无关,提示CTC可作为血液学指标提高早期诊断率,且与胃癌转移密切相关。本研究采用国际先进无创性标准化CTC检测技术对35例HER-2阴性晚期胃癌患者外周血进行CTC检测,阳性率为31.4%(11/35)。而良性胃疾病对照组及健康对照组均未检出CTC。我们还发现,CTC阳性率与转移部位数目有关(P<0.05),不同性别、年龄、ECOG评分、病理类型患者间CTC阳性率差异无统计学意义(P>0.05)。提示CTC检测可用于评估HER-2阴性晚期胃癌患者预后,外周血CTC阳性率与转移部位数目相关。通过检索文献发现,国内外对胃癌患者CTC检测率并不相同,可能与研究对象的临床特点、抽血量、检测方法、阳性判断标准等不同有关。本研究提示,晚期胃癌患者CTC阳性表达时,多部位转移可能性大,临床应引起足够重视。
目前CTC与胃癌大样本、随机对照研究还很少,但其方便、无创、易被患者接受,可反复抽取,动态监测等优势已引起关注。随着大样本、多中心、前瞻性、随机对照试验展开,将进一步明确CTC在胃癌患者临床应用的价值,为优化诊断、选择个体化治疗策略、判断精确疗效和评估预后提供更可靠依据。
