吡喃型花青素类化合物的研究进展
2018-07-11王二雷刘彦君刘静波
王二雷,刘彦君,刘静波
(吉林大学食品科学与工程学院营养与功能食品研究室,吉林长春 130062)
花青素又称为花色素,是自然界中一类广泛存在的水溶性天然色素。自然条件下游离状态的花青素极少见,花青素多与糖类形成花色苷形式。花色苷还可与有机酸或脂肪酸通过酯键形成酰基化花色苷[1]。现已探明的花青素有23种,花色苷形式则达500余种[2-3]。花青素对人类健康影响广泛,具有抗氧化、抗炎症、降血脂等多种生理功能[4],在农产品深加工、功能食品、医药、化妆品等领域有着巨大的应用潜力。但花青素稳定性较差,极大地限制了其在加工、着色方面的应用。
吡喃型花青素(Pyranoanthocyanins)作为一种新发现的花青素衍生物,已引起诸多研究人员的兴趣和重视。截止到目前为止,各国研究人员已陆续从植物原料以及果酒、果汁中鉴定出多种吡喃型花青素,如甲基型、Vitisins型、Portisins型、Oxovitisins型等[5]。随着吡喃型花青素研究的不断深入,其特有的营养、保健功能也日益被人们发现,如能改善酒的风味及色泽、良好色素稳定性以及潜在功能活性。目前,国内外针对吡喃型花青素的
综述报道较少,且主要局限于其形成、结构鉴定、合成等方面,结合课题组对花青素的研究基础及国内外相关文献报道,本文将从吡喃型花青素的来源、种类、形成过程、纯化与鉴定、稳定性、对酒品质影响及功能活性等方面进行综述,以期为吡喃型花青素的进一步研究和综合开发利用提供参考。
1 吡喃型花青素简介
1.1 来源
吡喃型花青素最早发现于红酒中,1996年,法国Santos等[6]从红酒加工过程中的错流微滤膜上残留物中首次分离出吡喃型花青素,并通过核磁共振等技术从中鉴定出两种酚基吡喃花青素单体。此后,又有众多关于吡喃型花青素的报道,其中大部分是针对果酒或果汁中吡喃花青素开展的研究,少量针对西洋参[7]、血橙[8]等植物来源的吡喃型花青素。果酒(如葡萄酒)或果汁中的吡喃花青素一般由原料中存在的普通花青素类与发酵或陈酿过程中的糖代谢产物(如乙醛、丙酮酸)或有机酸(香豆酸、咖啡酸、阿魏酸)的脱羧产物通过加成反应所生成的吡喃花青素,且放置时间越久远,所形成的吡喃花青素含量及种类就越丰富。目前,已发现的吡喃型花青素大部分属于后期发酵过程中产生,如葡萄酒或果汁中发现的吡喃型花青素,仅从少量天然植物(鹿角漆树果实及月季花瓣)中发现若干形式的吡喃花青素[9-10]。此外,吡喃花青素也可通过生物或化学手段合成制得,从而获得具备特定化学结构的吡喃型花青素。
1.2 种类及形成过程
吡喃型花青素属于近20年来新发现的一类花青素衍生物,其结构是在原有花青素C4位及C5位羟基间经环化加成反应增加一个吡喃环D,从而形成一类新的花青素,吡喃型花青素因在C-10位上的取代基团不同,所形成吡喃花青素种类也各不相同(图1)。现已发现的吡喃型花青素见表1,约由10类不同结构吡喃花青素构成,如Vitisins型,Pinotin A型,Portisins型[11],Oxovitisins型等。不同吡喃类花青素命名主要依据其发现来源而定,如Pinotin A型最早发现于南非产的皮诺塔吉(Pinotage)红酒中,Portisins 型最早发现于葡萄牙产的一种波特(Port)酒中。吡喃型花青素主要存在于葡萄酒中,但新酿葡萄酒中并未检出Vitisins A,而贮存几个月后或数年后葡萄酒中则含有大量Vitisins A(图2A),其形成主要通过原有花青素与糖发酵过程中产生的丙酮酸经过加成反应形成;而Vitisins B则通过原有花青素与发酵过程产生的乙醛经过加成反应形成[12];黄烷醇型吡喃花青素一般由花青素与葡萄酒中黄烷醇在乙醛存在条件下,经过加成缩合、脱水等反应生成(图2B)。Portisins型、二聚体型及Oxovitisins型一般在葡萄酒陈酿后期形成,主要通过Vitisins型、酚基型、黄烷型吡喃花青素与小分子类物质继续反应生成,因此这类吡喃型花青素又称为第二代吡喃花青素,如Vitisins A与儿茶素在乙醛存在条件下发生反应,生成portisins A(图2C)[13]。
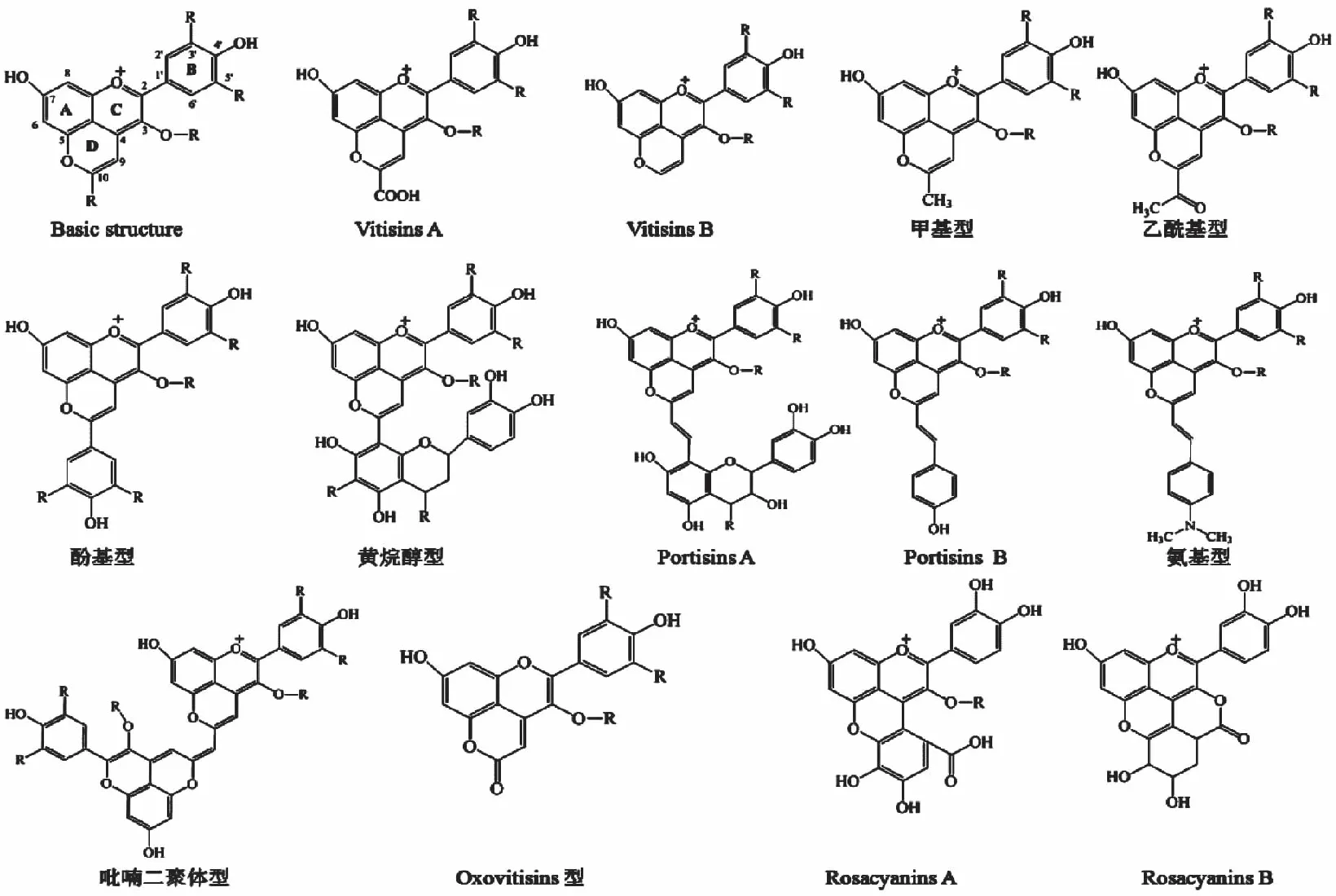
图1 吡喃型花青素衍生物典型化学结构汇总Fig.1 Typical chemical structures of already discovered pyranoanthocyanins注:R表示不同的取代基团。
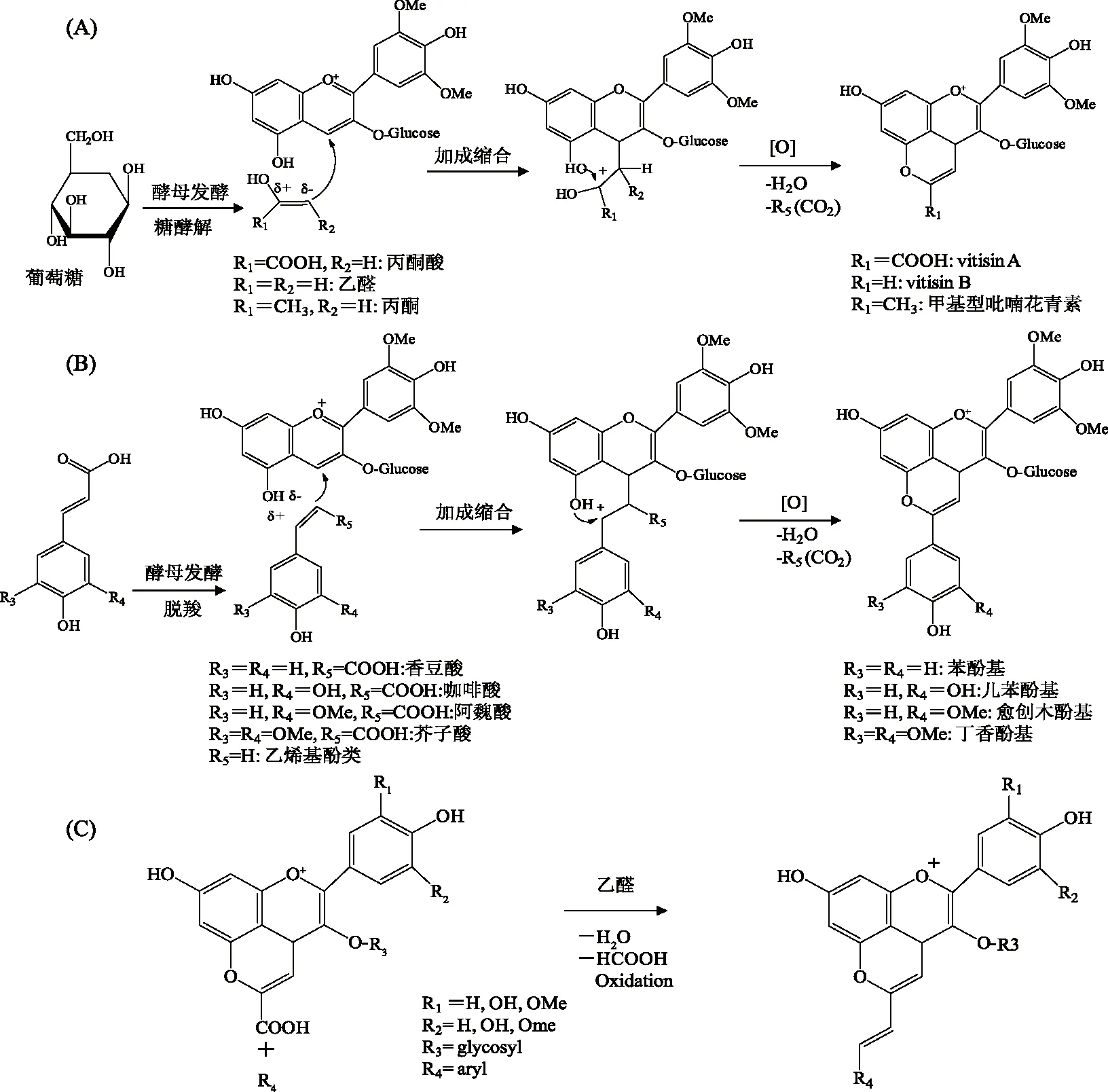
图2 葡萄酒中吡喃型花青素类化合物的形成过程[13,18-19]Fig.2 Formation process of pyranoanthocyanin compounds in red wines[13,18-19]

表1 吡喃型花青素的分类、来源及相关特征[5]Table 1 Classifications,sources and relevant characteristics of pyranoanthocyanins[5]
Rosacyanins 型为一种较特殊吡喃花青素,主要存在于月季花瓣中,在花青素的C-4位及没食子酸盐的C″-4位进行两次环化反应形成具有内酯结构的吡喃型花青素[10,14]。此外,利用微生物途径或化学合成手段也能制备出吡喃型花青素,如利用丙酮与黑加仑花青素在一定温度下可通过氧化加成反应生成甲基型吡喃花青素。乙酰基型及氨基型吡喃花青素也可通过人工合成途径得到,如Dora等利用丁二酮(二乙酰)与葡萄皮花青素反应,首次合成了10-乙酰吡喃花青素[15-16],Joana等利用羧基吡喃花青素与4-(二甲氨基)-肉桂酸合成了氨基型 Portisins花青素[17],此外尚无天然存在的吡喃花青素相关研究报道。
2 吡喃型花青素纯化及结构鉴定技术
2.1 概述
研究吡喃型花青素的分离纯化及结构鉴定技术是探索其成因、稳定性、对酒体品质影响及潜在功能活性的首要步骤;此外,目前国内外尚无市售吡喃型花青素标准品,研究吡喃花青素的分离纯化技术意义重大。目前,常用于吡喃花青素分离技术主要有层析技术、凝胶色谱分离技术、高速逆流色谱技术(HSCCC)、制备高效液相色谱等[20]。吡喃型花青素类化合物的生成及纯化步骤主要包括:原始花青素的分离纯化、吡喃型花青素的化学合成、吡喃型花青素的分离纯化三大部分,也有少量直接从原料中进行分离纯化的研究报道。
2.2 不同结构吡喃型花青素的纯化及鉴定技术
吡喃型与普通花青素的纯化及鉴定技术:吡喃型花青素与普通花青素的极性较为相似,采用一般的色谱手段难于实现两类物质的分离。Rivas等[21]为便于红酒中吡喃花青素类物质与普通花青素类的分离鉴定,首先将放置2年的红酒与亚硫酸氢钠反应15 min,使普通花青素与亚硫酸氢钠生成一种新的加成产物,吡喃类花青素由于D环上C-4已成环,则不再与亚硫酸氢盐反应,因此不能生成新的加成产物。普通花青素在亚硫酸氢钠溶液中的反应过程见图3,花青素或以甲醇、查尔酮形式存在,也可能以两种加成产物形式存在[22-23]。这两种加成产物在Toyopearl HW-40(s)凝胶柱上比吡喃花青素具有更强的保留能力,在层析柱上先用95%的乙醇分离出吡喃类花青素物质,再用100%甲醇洗脱出非吡喃类花青素物质,进而实现两类物质的分离,再采用分光光度法及串联质谱技术对两类物质分别进行鉴定,此种方法能够较好地实现吡喃类花青素与普通花青素在色谱柱上的分离鉴定。
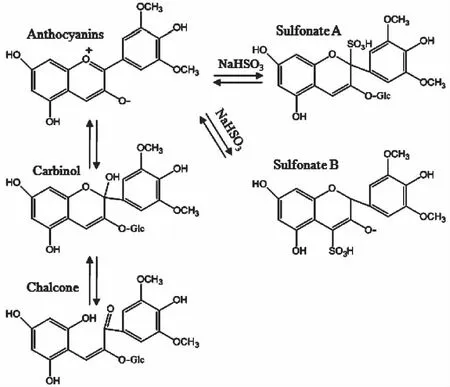
图3 普通花青素在在亚硫酸氢钠 溶液中的可能存在形式[21]Fig.3 Several possible chemical structures of non-pyranoanthocyanins in sodium bisulfate solution[21]
甲基型吡喃花青素的纯化及鉴定技术:何静仁等[24]以葡萄皮花青素为原料,以丙酮为反应介质,研究了甲基吡喃型花青素的合成,所优化出的最佳条件为:2.5 mg/mL葡萄皮花青素提取物与丙酮体积为15∶1,pH3.0,温度45 ℃,反应时间9 d,所得甲基吡喃花青素得率为49.4%。在以上合成工艺的基础上,何静仁团队采用聚酰胺树脂及TSK凝胶树脂制得了甲基吡喃花青素粗提物,并借助半制备液相色谱获得了纯度98%的甲基吡喃花青素[25]。Lu等[26]研究了黑加仑中甲基吡喃型花青素的制备工艺,首先制备了糖基化吡喃花青素,再利用酸水解技术脱除糖苷,从而获得了两种甲基型吡喃花青素苷元形式,还从中发现了少量呋喃形式的花青素,这是由于苷元形式的稳定性较差,其结构发生了重组现象,具体转换过程见图4A。Bednar等[27]采用氯化天竺葵素与丙酮试剂反应,分别制得了5-甲基吡喃型天竺葵素苷元及4-甲基呋喃型天竺葵素苷元,并采用半制备液相色谱对这两种组分进行了分离。由以上结果可知,糖苷型甲基吡喃花青素在制备过程中较稳定,而苷元型吡喃花青素不稳定,易转化成呋喃形式花青素。因此,在制备甲基吡喃花青素的苷元形式时,应适当控制反应条件,防止其向呋喃型甲基吡喃花青素转化。

图4 吡喃型花青素苷元形式存在过程[26,28] Fig.4 Formation process of pyranoanthocyanin aglycones[26,28]
酚基型吡喃花青素的纯化及鉴定技术:酚基型吡喃花青素大多从果汁或果酒后发酵产物中获得,如Peter等[29]从贮存3个月后的紫萝卜汁产品中鉴定出6种吡喃型花青素,并采用HSCCC及半制备型高效液相色谱对其中两种主要的酚基型吡喃花青素进行了分离,经高效液相色谱-串联质谱技术(HPLC-ESI-MSn)鉴定为两种矢车菊素衍生物与儿茶酚的加成产物形式。此后,Peter团队[30]又以5年陈酿的皮诺塔吉(Pinotage)红酒为原料,采用固相萃取及XAD-7大孔树脂制得了吡喃型花青素粗提物,再经HSCCC及半制备液相系统制得高纯度的单体,经HPLC-ESI-MSn及核磁共振(NMR)鉴定为锦葵色素-3-O-β-D-葡萄糖苷与4-乙烯基愈创木酚的加成产物(Pinotin A)。天然存在的酚基型吡喃花青素较少见,目前仅有从鹿角漆树果实中发现酚基吡喃花青素的报道,如Jason等[9]采用快速色谱系统(Flash chromatography)及半制备高效液相色谱系统首次从鹿角漆树果实中分离出两种
天然存在的酚基型吡喃花青素,并经质谱及核磁鉴定为7-O-甲基-飞燕草素-3-O-(2‴没食子酰基)-半乳糖苷-4-乙烯基儿茶酚-3″-O-葡萄糖苷(Sumadin A)和7-O-甲基-矢车菊素-3-O-(2‴没食子酰基)-半乳糖苷-4-乙烯基儿茶酚-3″-O-葡萄糖苷(Sumadin B)。高粱种皮中所含的花青素不同于一般水果蔬菜中花青素,因其C环3位上缺少羟基,属于3-脱氧花青素形式。由于花青素主要通过C环3位上羟基结合糖类,从而形成花色苷形式,但高粱种皮中花青素因在C环3位上缺少羟基,则只能以苷元形式存在(如Apigeninidin和Luteolinidin),其化学结构见图4B。Michael等[28]研究了高粱种皮中吡喃型花青素苷元的制备技术,首先以红高粱种为原料,利用植物乳杆菌(L. plantarum)发酵剂制得了发酵面团,再经甲醇提取、乙酸乙酯萃取,将酯层上制备型液相色谱,最终制得了酚基型吡喃3-脱氧花青素苷元,并制得一种新的与乙烯苯酚加成后的花青素衍生物,这两种物质经核磁共振氢谱(1H-NMR)及电喷雾离子阱质谱(ESI-MS/MS)鉴定后,所得结构见图4B所示,考虑到吡喃型3-脱氧花青素苷元结构特殊性,后期对其理化性质、功能活性等方面均有必要深入研究。
羧基型吡喃花青素的纯化及鉴定技术:Maria等[31]研究了羧基型(Vitisins A)的纯化工艺,首先采用半制备高效液相色谱法从葡萄皮提取物中分离出3种花青素单体,再将丙酮酸与花青素单体按摩尔比300∶1进行混合,在pH3.7,温度32 ℃条件下制备出3种Vitisins A 型花青素,经高效液相色谱法测定样品纯度为93%~94%。Monica等[32]利用黑豆花青素提取物与丙酮酸反应,再经过Amberlite XAD-7大孔树脂及Sephadex LH-20凝胶树脂纯化,共制备出3种纯度在80%~90%的羧基吡喃花青素单体,并通过高效液相色谱及核磁共振鉴定为3-葡萄糖苷化的5-羧基吡喃飞燕草素、5-羧基吡喃牵牛花素及5-羧基吡喃锦葵色素。羧基型吡喃花青素上的羧基易受水的亲核攻击,从而导致羧基型吡喃花青素在微氧化条件下转化成更加稳定的Oxovitisins型花青素,在制备羧基型吡喃花青素过程中应选择相对密闭的环境,以防止过多氧气的进入,从而导致Oxovitisins型花青素的生成。
Portisins型及Oxovitisins型吡喃花青素的纯化及鉴定技术:这两种吡喃花青素的合成均以羧基吡喃花青素为前体物质,二者的区别在于,Portisins型通过羧基吡喃花青素与羟基肉桂酸类物质反应生成,而Oxovitisins则通过羧基吡喃花青素在微氧化环境下生成。Joana 等[11]从2年陈酿的波特红酒中鉴定出Portisins型吡喃花青素,并采用TSK toyopearl gel HW-400凝胶柱及聚酰胺树脂柱进行了纯化技术研究,在此基础上,又利用葡萄皮花青素与丙酮酸合成了羧基吡喃花青素,并以羧基吡喃花青素与羟基肉桂酸类物质合成了Portisins型吡喃花青素,最终采用TSK凝胶柱及半制备液相色谱进行了分离纯化。何静仁团队[33]研究了具有非氧鎓离子结构和内酯型吡喃环的Oxovitisins A的制备技术,首先以葡萄皮花青素和丙酮酸试剂制得羧基吡喃吡喃花青,再通过微氧化反应制得了Oxovitisins A,最佳制备条件为:pH3.6,反应温度45 ℃,乙醇浓度20%,反应时间21 d,并采用HPLC-ESI-MSn对样品进行了定性和定量分析,所得产物得率为26.5%。羧基吡喃花青素转化成Portisins型及Oxovitisins型属于花青素向更稳定构型转化的一种途径,因此深入研究这两类吡喃花青素的分离纯化技术,从而获得相应的产品,将具有更广泛的应用空间。
3 吡喃型花青素稳定性研究
pH耐受性:吡喃型花青素是普通花青素与不饱和小分子物质发生加成或聚合反应后的产物,属于一种更稳定的花青素构型。普通花青素对于pH变化非常敏感,而吡喃型花青素因在其C4位与C5位之间形成了吡喃环,能直接保护花青素分子免受水的亲核攻击。例如:黄烷醇型吡喃花青素的吸光度在pH1.0~3.6范围内未有明显变化,甚至当pH为中性或弱碱性条件下也呈现出一定的耐受力;Portisins A型吡喃花青素在pH从1.0~7.0时,其最大吸光度值略有降低。当Portisins A型吡喃花青素在其C3位的糖苷部分与有机酸形成酰基化的结构时,会进一步提高其pH耐受力。即稳定性顺序依次为:酰基化Portisins A>Portisins A>普通糖基化花青素形式[34]。但吡喃型花青素的稳定性并非随着pH的增强而提高,如黄烷型吡喃花青素在pH为3.6时的最大吸光度值要远远高于在pH为1.0时的吸光度值,这种现象大多与分子间共色作用有一定关联[35]。鉴于吡喃型花青素在酸性及中性pH范围内的良好稳定性,吡喃型花青素与普通花青素相比,更能适应人体或动物体内的消化道环境,从而更有利于其功能活性的发挥。
SO2耐受性:在葡萄酒的生产过程中,SO2常被用做保鲜剂、防腐剂或抗氧化剂,但SO2的存在会对葡萄酒中吡喃花青素的形成及稳定性产生一定影响。普通花青素在其C4位易与SO2发生亲核加成反应,而吡喃型花青素因在其C4位形成新环(D环),从而有效阻止了SO2的亲核攻击。在葡萄酒的发酵过程中,SO2能与酵母发酵产生的乙醛或丙酮酸反应生成新的加成产物,进而导致乙醛或丙酮酸的浓度降低,会影响Vitisins型吡喃花青素的形成,相比之下,酚基吡喃花青素的形成则不受SO2添加量的影响[36]。Oliveira[34]及何静仁[35]分别研究了吡喃型花青素及普通花青素在不同SO2浓度下的稳定性差别,得出普通花青素稳定性随着SO2浓度升高呈现剧烈衰减趋势,而黄烷醇型、Portisins型在SO2浓度为0~200 mg/kg内稳定性几乎没有变化。以上文献内容表明,除Vitisins型吡喃花青素的形成受SO2浓度影响较大外,大部分吡喃型花青素均对SO2表现出了较好耐受性,进而在一定程度上赋予了葡萄酒特有的色泽及品质。
此外,何静仁等[35]考察了若干种吡喃花青素在6个月存贮期内的稳定性变化情况,得出稳定性顺序依次为:黄烷醇型>Vitisins A>普通花青素。鉴于吡喃型花青素的较高的稳定性,除赋予酒类产品更持久的色泽及品质外,其在功能食品、药品及化妆品等领域将有更广泛的应用前景。
4 吡喃花青素对酒品质影响
花青素是葡萄酒中的主要呈色物质,其组成、含量直接影响着酒体的色泽及品质[37]。一般新酿葡萄酒中的花青素主要赋予酒体鲜艳的紫红色或红宝石色,而陈酿葡萄酒的中游离花青素含量会随着时间的延长逐渐减少,吡喃花青素或其它花青素聚合物则逐渐增多,酒体的颜色也由鲜艳的红色渐变为砖红色[38-40]。根据吡喃型花青素的光谱特征(表1),Vitisins A型(λMax=510~515 nm)吡喃花青素主要贡献酒中的橙红色,而Vitisins B型(λMax=490 nm)主要贡献桔黄色色调。Portisins A(λMax=570~580 nm)则主要贡献葡萄酒中的蓝紫色或蓝色调,而Portisins B(λMax=540 nm)主要贡献更多的紫红色色调。通过次甲基桥连接的吡喃花青素二聚体(λMax=676 nm)则显示出特有的土耳其蓝色色调[41]。葡萄酒中吡喃型花青素的存在不仅能改变酒体的颜色,而且对其风味的改善也有一定的作用,如已有研究表明葡萄酒所特有的干涩收敛不仅与单宁的存在有关,而且与吡喃花青素的存在有一定关联[42],这是由于吡喃型花青素能与唾液中的蛋白(如富含脯氨酸的蛋白)产生絮凝,从而阻止了唾液腺的进一步分泌,并使黏膜组织失水变硬,降低了渗透性,从而增加了葡萄酒的收敛性口感。
一般葡萄酒中所含的酚基吡喃花青素的稳定性要高于Vitisins型,因此常用作反映葡萄酒陈酿年代的指示剂[43]。而酚基吡喃花青素的形成除受原有花青素的浓度、浸渍酶种类[44]、陈酿时间等因素的影响外,酵母菌种类[45]的选择也是至关重要的一步。葡萄酒在发酵或陈酿过程中,酵母菌株所产生的羟基肉桂酸脱羧酶能将酒体中所含的肉桂酸类物质转化成乙烯基酚类,进而与原有花青素反应生成酚基型吡喃花青素[46],但不同酵母菌株分泌羟基肉桂酸脱羧酶的能力各不相同,如酵母菌株S. cerevisiae分泌羟基肉桂酸脱羧酶的能力远远高于S. uvarum,从而造成了葡萄酒中所含酚基吡喃花青素的含量有较大差别。此外,选择高产乙醛和丙酮酸的酵母菌株能有效提高葡萄酒中Vitisins型吡喃花青素的含量[36],进而提高葡萄酒的色泽和品质。
5 吡喃型花青素功能活性评价
关于吡喃型花青素功能活性方面已经部分研究报道,主要表现在抗氧化、抗癌、抗炎症等方面。
5.1 抗氧化活性研究
Rivas等[47]采用过氧亚硝基清除能力(NORAC)、Trolox等效抗氧化能力(TEAC)、亚铁离子还原能力(FRAP)、硫代巴比妥酸反应产物(TBARS)四种方法评价了吡喃型花青素与其它酚类化合物的抗氧化作用,得出抗氧化能力大致遵循以下顺序:原花青素>普通花青素>吡喃花青素。Maria等[31]采用FRAP、TEAC、ORAC三种方法比较了Vitisins A型(或羧基型)花青素与普通花青素的抗氧化大小,从整体上来看,Vitisins A型吡喃花青素抗氧化能力要低于普通花青素抗氧能力,在普通花青素中飞燕草素-3-O-葡萄糖苷的抗氧化能力最强,锦葵色素-3-O-葡萄糖苷和牵牛花素-3-O-葡萄糖苷均较差;类似地,在Vitisins A中,由飞燕草素-3-O-葡萄糖苷形成的Vitisins A的抗氧化能力是最强的,这也表明,花青素B环羟基位置或数量对吡喃型和普通花青素的抗氧化能力的影响都非常大。
高效液相色谱-库仑陈列检测法(HPLC-Coulometric array detection)为一种新兴起的针对多酚类物质的抗氧化评价方法[48],其原理为:多酚类物质作为一种还原剂,当发生氧化还原反应时,电子的给出会引起电化学响应值的变化,通过检测电化学响应值的变化情况就能够推测出其氧化活动的变化,例如大部分黄酮类具有两个氧化电位(100~300和700~800 mV)。Andersen等[49]采用FRAP及高效液相色谱-库仑阵列检测法分别比较了花青素化学结构与抗氧化能力的关系,得出两种方法的测定结果存在一致性,即普通花青素与相应的吡喃型花青素在抗氧化能力上未有明显差异;此外,在B环上拥有连苯三酚结构或邻苯二酚结构的羧基吡喃型花青素与普通花青素均具有较好的抗氧化能力,但当B环上仅存在一个羟基的吡喃型花青素或普通花青素则具有较弱的抗氧化能力。
Goupy等[50]分别采用DPPH自由基清除能力及亚油酸过氧化抑制能力研究了红酒中多酚类化合物的抗氧化活性大小,得出Vitisins A及由锦葵色素形成的酚基吡喃型花青素对DPPH自由基的清除能力均高于原有的锦葵色素,且酚基吡喃花青素为一种有效的抑制亚油酸过氧化的多酚类物质。邝敏杰等[51]研究表明,甲基吡喃花青素在羟自由基清除能力及氧化还原能力方面均优于原有锦葵色素,且对H2O2引起的细胞损伤有一定保护作用。
以上研究结果表明,不同研究人员对吡喃型花青素的抗氧化评价结果均存在一定差异,这主要是由样品的不同化学结构、测定方法、样品纯度上的差异造成的,总体上而言,普通花青素转化成吡喃型花青素后,其抗氧化能力并未出现明显的变化,但考虑到吡喃型花青素在稳定性方面的突出优势,吡喃型花青素在今后的抗氧化应用方面将展现出更大的潜力。
5.2 抗癌活性研究
Oliveira等[52]利用磺酰罗丹明B(SRB)比色法测得了几种花青素衍生物的抗癌活性大小,得出锦葵色素-3-O-葡萄糖苷与三种吡喃花青素相比,对乳腺癌细胞MCF-7具有更强的抗增殖作用,而三种吡喃花青素中抗癌活性大小依次为:Oxovitisins型>Vitisins A>甲基吡喃花青素,推测其可能的原因为,Oxovitisins型的强抗癌活性与其不带电荷且拥有羰基基团的特殊结构有一定的关联。吴闹等[33]研究表明,Oxovitisins A能显著抑制Caco-2肠癌细胞及 MCF-7乳腺癌细胞的细胞增殖,且其抑制作用均强于羧基型及甲基型吡喃花青素。
5.3 抗炎活性研究
鹿角漆树多酚粗提物中富含多种酚基型吡喃花青素及其它多酚类物质,You等[53]研究了鹿角漆树多酚提取物的抗氧化、抗炎症作用,得出这种提取物对过氧化氢诱导的白介素IL-8的分泌有一定抑制作用,从而起到一定的抗氧化效果;并得出这种提取物对Caco-2细胞中炎症因子TNF-α诱导的白介素IL-8的分泌有显著的抑制作用,进而发挥其抗炎症效果。
6 展望
综上所述,在过去近二十年中,各国研究人员已陆续从不同植物原料或相关产品中发现了新的吡喃型花青素类化合物,并对其种类、形成机制、分离纯化技术、化学合成、稳定性、功能活性等方面展开了多样化的研究。尽管国内外对于吡喃型花青素类化合物的研究已经有了很大起色,但总体而言,对于吡喃型花青素的研究仍处于起步阶段,探索其更多未知组成及功能仍需要进行大量的研究工作。此外,由于天然植物中存在的或酒体中存在的吡喃型花青素的含量较低,不易于富集并加以利用,而以自然界中含量丰富的普通花青素为基础,通过化学合成手段,制备出大量不同结构的吡喃型花青素,研究其潜在抗肿瘤、抗辐射、抗炎症、提高机体免疫力等方面的功效,进而开发其应用价值,将成为未来研究吡喃型花青素的重要研究方向。随着研究的不断深入,吡喃型花青素的真正价值必将得到更加充分的发挥。
