EBR处理对甜樱桃贮藏期间品质 及生理特性的影响
2018-07-11王云香李文生王宝刚
周 慧,王 愈,王云香,李文生,王宝刚,3,*
(1.北京市林业果树科学研究院,北京 100093;2.山西农业大学,山西晋中 030801;3.果蔬农产品保鲜与加工北京市重点实验室,北京 100097)
甜樱桃为蔷薇科李属樱桃亚属,被誉为“春果第一枝”[1],其果实色泽鲜艳,风味独到,营养丰富,深受广大消费者青睐[2]。甜樱桃属于典型的核果类果实,采后易发生果肉褐变、腐烂变质等现象,极其不耐贮藏,给消费者和市场供应都带来了极大的限制[3-4]。因此,研究适宜的甜樱桃贮藏保鲜技术是当务之急。目前国内外研究和应用较为深入的延缓甜樱桃果实采后品质劣变的保鲜技术有气调贮藏[5]、辐射处理[6]、涂膜处理[7]、1-MCP处理[8]、冷库贮藏[9]等,但长期在低温逆境条件下贮藏会出现果实凹陷、果肉褐变等症状。
油菜素内酯(Brassinosteroids,BRs)是一种普遍存在于植物中的天然激素[10]。不仅对植物的生长发育发挥重要的调节作用[11],还可以通过提高植物的抗氧化系统来增强抗低温逆境能力[12]。李园园[13]等研究表明,2,4-表油菜素内酯处理草莓可以延缓果实硬度、可溶性固形物和VC含量的下降,增加了总酚、花色苷的积累。此外,表油菜素内酯处理能够显著降低青椒[14]和桃果实[15]等果蔬采后冷害的发生。Zhu等[16]发现2,4-表油菜素内酯处理过的柑橘在贮藏50 d后腐烂率显著低于对照组。然而,迄今尚未见到将油菜素内酯用于甜樱桃果实贮藏相关的研究。本实验以“先锋”甜樱桃果实为实验材料,用不同浓度的2,4-表油菜素内酯(5、10 μmol/L)浸泡甜樱桃10 min,研究甜樱桃在贮藏期间品质及生理特性的变化,为油菜素内酯处理在甜樱桃果实贮藏保鲜中的应用提供依据。
1 材料与方法
1.1 材料与仪器
甜樱桃 品种“先锋”采自北京市林业果树科学研究院实验基地;2,4-表油菜素内酯 上海源叶生物科技有限公司;氢氧化钠、硫代巴比妥酸、2,4-二硝基苯肼、邻苯二酚、愈创木酚 (分析纯)天津市精科精细化工研究所;磷酸二氢钠、磷酸氢二钠 (分析纯)、北京化工厂;磷酸缓冲液、H2O2溶液、草酸溶液、硫脲溶液、1%盐酸-甲醇溶液、氮蓝四唑、PVP、DTT、EDTA-Na2、三氯乙酸、无水乙醇、冰醋酸、磷酸、硫酸、核黄素、福林酚试剂 北京拜尔迪生物技术有限公司。
TU-1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;809型自动电位滴定仪 瑞士万通;3K15型高速冷冻离心机 SIGMA公司;TP3012型精密天平 丹佛仪器(北京)有限公司;BSA224S-CW型电子天平 北京赛多利思科学仪器有限公司;DK-S24型电热恒温水浴锅 上海精宏实验设备有限公司;PAL-1型数字手持折光仪 日本ATAGO公司;DW-40L262型海尔立式低温冰箱 青岛海尔特种电器有限公司。
1.2 实验方法
1.2.1 样品预处理 甜樱桃“先锋”果实采后立即运回北京市林业果树科学研究院实验室,挑选成熟度一致、剔除腐烂果、畸形果、大小和色泽相近、无机械损伤的果实用于实验。
不同浓度的2,4-表油菜素内酯(5、10 μmol/L)浸泡甜樱桃10 min,对照是蒸馏水浸泡,自然晾干后,每组每次分别选用600个果实,各重复3次。将处理后的甜樱桃用透明塑料盒(大小为20 cm×12 cm×8 cm)进行分装,再将透明塑料盒置于纸箱中保鲜处理。在(0±0.5) ℃,湿度为85%~90%的冷库中贮藏60 d,每隔15 d取样检测相关生理生化指标。
1.2.2 指标及测定方法 果柄和果肉褐变指数的测定参照王春生等[17]方法。每次取样观察腐烂情况并统计腐烂率,果实面积可见柄斑面积大于0.5 cm2即视为发病。
计算公式:

硬度测定采用硬度计(Penetrometer FT02,Italy)探头直径为6 mm;可溶性固形物含量测定采用手持糖度计(ATAGO PAL-1,Japan);可滴定酸含量测定采用瑞士万通(Metrohm)804型标准型自动电位滴定仪进行滴定[18];维生素C含量测定采用2,4-二硝基苯肼比色法[19]。丙二醛含量测定采用硫代巴比妥酸比色法[20];总酚含量测定采用福林酚比色法[21];花色苷含量测定采用pH示差法[22];甜樱桃果皮色差测定采用手持色差仪分别在果实阴、阳两面均匀取两个点进行测定;甜樱桃果肉色差测定采用采后手持色差仪,每个甜樱桃削去一小块薄薄的果皮(厚约1 mm)在果肉上取点进行测定;多酚氧化酶(PPO)、过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、脂氧和酶(LOX)活性采用比色法[23]测定。
1.3 数据分析方法
各指标均做3次重复,运用Excel 2013软件对实验数据进行绘图及分析,差异显著性检验(p<0.05为显著水平)用邓肯式多重比较方法完成。
2 结果与分析
2.1 EBR处理对甜樱桃贮藏期间腐烂率、果柄及果肉褐变、丙二醛含量的影响
随着贮藏时间的延长,甜樱桃果实的腐烂率呈逐渐上升的趋势。在整个贮藏过程中对照组的腐烂率明显高于EBR处理组(见图1A),在贮藏60 d时对照组腐烂率比5 μmol/L EBR腐烂率高50%。这与Zhu[24]等在枣果实上的研究结果一致。
丙二醛含量高低可以反映细胞膜膜脂过氧化的程度,贮藏15~45 d,5 μmol/L EBR处理和10 μmol/L EBR处理丙二醛含量呈下降趋势,这可能与可溶性糖含量的上升有关,因为可溶性糖类对MDA含量反应有干扰作用,贮藏45 d后,果实MDA含量呈逐渐上升的趋势,但在整个贮藏的过程中对照组上升的斜率明显大于5 μmol/L EBR处理组和10 μmol/L EBR处理组(见图1B),说明两处理组有效抑制了MDA含量的升高,在贮藏60 d时,对照组的丙二醛含量分别比5 μmol/L EBR处理组、10 μmol/L EBR处理组高31.0%和30.4%。
甜樱桃可以根据果柄的褐变程度估测果实的新鲜程度。随着贮藏时间的延长,甜樱桃的果柄褐变指数逐渐增加,但在整个贮藏过程中,EBR处理的果实褐变指数明显低于对照(见图1C)。在贮藏结束时(60 d),对照组褐变指数分别比5 μmol/L EBR处理组、10 μmol/L EBR处理组高22.0%和17.1%,两处理间不存在显著差异(p>0.05)。
果实采后褐变是影响果实外观品质和贮藏寿命的重要因素。随着贮藏时间的延长,甜樱桃果实的褐变指数逐渐增加,在整个贮藏过程中对照组的褐变指数最高(见图1D),在贮藏60 d时对照组褐变指数分别比5 μmol/L EBR处理组、10 μmol/L EBR处理组高38.2%和8.4%。

图1 EBR处理对甜樱桃贮藏期间腐烂率、果柄及果肉褐变、丙二醛含量的影响Fig.1 Effect of EBR treatment on decay incidence,browning and malondialdehyde content of sweet cherry during storage
2.2 EBR处理对甜樱桃贮藏期间果皮及果肉色差变化的影响
L*值表示色泽明亮度,L*值越大,代表亮度越高。由图2A可知,贮藏过程中甜樱桃果皮亮度L*值呈先上升再下降的趋势,贮藏30 d后,L*值下降,甜樱桃不再鲜艳,这可能与甜樱桃果实品质的下降有关,贮藏后期5 μmol/L EBR保持樱桃表面颜色的效果最明显,与对照相比,5、10 μmol/L EBR都延缓了甜樱桃表面颜色的鲜艳程度。
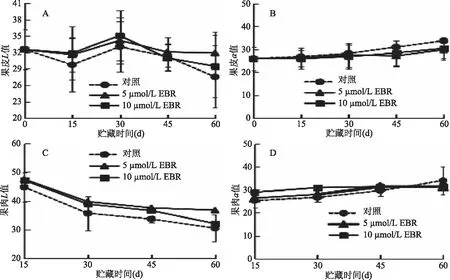
图2 EBR处理对甜樱桃贮藏期间果皮及果肉色差变化的影响Fig.2 Effect of EBR treatment on color of peel and pulp during storage of sweet cherry
a*值表示色度中的红绿色差指标,正值代表红色程度,正值越大,红色越深,由图2B可知,在贮藏过程中a*值呈现逐渐上升的趋势,在贮藏后期甜樱桃果皮的颜色逐渐加深,在45~60 d贮藏过程中a*值上升尤其明显,贮藏结束时对照的a*值比其他两组的处理a*值高。
三组果肉随贮藏时间延长的L*值与a*值变化趋势如图2C、2D所示。在整个贮藏过程中,L*值随着时间的延长呈下降的趋势,说明甜樱桃果肉亮度逐渐变暗。在贮藏后期45~60 d时,对照组和10 μmol/L EBR处理组下降趋势明显,而5 μmol/L EBR处理组下降缓慢。在60 d时,对照的L*值最低,5 μmol/L EBR处理的L*值最高。由此可知,EBR处理可以缓解甜樱桃的颜色变暗。
随着贮藏时间的延长,甜樱桃果肉在衰老的过程中红色逐渐加深,因此a*值呈逐渐上升的趋势。在贮藏30 d时10 μmol/L EBR处理a*值最高,但在贮藏45 d-60 d时对照组的a*值迅速上升,在贮藏60 d时对照的a*值最高,5 μmol/L EBR处理和10 μmol/L EBR处理不存在明显差异,但a*值都低于对照组。
2.3 EBR处理对甜樱桃贮藏期间硬度、可溶性固形物、可滴定酸、VC含量的影响
果实硬度变化是果实成熟衰老的特征之一。随着贮藏时间的延长,果实的硬度呈现先上升后下降的趋势。5 μmol/L EBR处理组在贮藏30~60 d过程中起到了较好延缓果实硬度下降的效果,10 μmol/L EBR在贮藏30~45 d时延缓了果实硬度的下降(见图3A)。两处理之间无显著差异(p>0.05)。
随着贮藏时间的延长,果实可溶性固形物呈现下降的趋势,贮藏后期45 d-60 d时对照组果实的可溶性固形物含量下降幅度较大(见图3B),5 μmol/L EBR处理和10 μmol/L EBR处理有效延缓果实可溶性固形物含量下降,保证果实的风味。

图3 EBR处理对甜樱桃贮藏期间硬度、可溶性固形物、可滴定酸、VC含量的影响Fig.3 Effect of EBR treatment on firmness,soluble solids,titratable acidity and VC content of sweet cherry during storage
果实含酸量是影响果实风味的一项重要指标。贮藏期间果实的可滴定酸含量逐渐下降,与对照相比,5 μmol/L EBR和10 μmol/L EBR处理组均显著缓解果实可滴定酸含量的下降,5 μmol/L EBR处理效果最好。两处理组存在显著差异(p<0.05),在贮藏60 d时,5 μmol/L EBR处理组可滴定酸含量明显高于对照组和10 μmol/L EBR处理组的可滴定酸含量(见图3C)。
VC具有抗氧化作用,是果实营养价值的一个重要指标。随着贮藏时间的延长,果实VC含量呈下降趋势(见图3D)。EBR处理显著抑制了果实VC含量的下降(p<0.05),其中,5 μmol/L EBR处理效果最佳。
2.4 EBR处理对甜樱桃贮藏期间总酚及花色苷含量的影响
酚类物质属于次生代谢物,由于其具有一定抗氧化能力常常作为保护物质参与植物组织抗病反应。0~15 d时,5 μmol/L EBR和10 μmol/L EBR的酚类物质均呈现不同程度的下降,对照组变化趋势不明显,随着贮藏时间的延长,总酚含量呈现缓慢上升再下降的趋势,对照组下降趋势最明显,在贮藏后期(60 d)时,5 μmol/L EBR总酚含量最高(见图4A)。
花色苷与樱桃的色泽发育、品质和风味的形成、成熟衰老的过程、组织褐变、抗逆性和抗病性代谢等作用有着密切的关系,随着贮藏时间的延长,甜樱桃花色苷含量呈现逐渐上升的趋势,在贮藏15~30 d时,10 μmol/L EBR上升的趋势最明显,在30~60 d时10 μmol/L EBR花色苷含量明显高于5 μmol/L EBR且低于对照组,在整个贮藏过程中对照组相比于5 μmol/L EBR和10 μmol/L EBR的花色苷含量值最高(见图4B),结果表明,5 μmol/L EBR和10 μmol/L EBR两组处理都可以延缓甜樱桃花色苷含量的上升,其中,5 μmol/L EBR处理效果更明显。

图4 EBR处理对甜樱桃贮藏期间总酚及花色苷含量的影响Fig.4 Effect of EBR treatment on total phenolic and anthocyanin contents of sweet cherry during storage
2.5 EBR处理对甜樱桃贮藏期间PPO、POD活性的影响
多酚氧化酶(PPO)与果蔬褐变相关,果蔬贮藏中降低PPO的活性有助于减少自身酚类物质转化为醌类物质。如图所示,在贮藏0~15 d内5 μmol/L EBR和10 μmol/L EBR处理组PPO活性呈下降的趋势,15~45 d内对照和所有处理组PPO活性呈上升的趋势,到60 d贮藏结束时5 μmol/L EBR和10 μmol/L EBR处理的PPO活性呈下降趋势,其中5 μmol/L EBR下降趋势最显著达到最低点,与对照差异显著(p<0.05)(见图5A)。结果表明,5 μmol/L EBR处理甜樱桃可以显著降低樱桃PPO活性,提高保鲜效果。

图5 EBR处理对甜樱桃贮藏期间PPO、POD活性的影响Fig.5 Effect of EBR treatment on PPO and POD activities during storage of sweet cherry
过氧化物酶(POD)是广泛存在于植物组织内的一种酶类,它在植物生长的各个阶段不断发生变化,与植物许多生理生化代谢过程都有密切关系。如图所示,在贮藏0~15 d内对照及各处理组的PPO活性呈下降的趋势,15~45 d内对照和
所有处理的POD活性呈上升的趋势,到60 d贮藏结束时对照和各处理的POD活性呈下降的趋势,其中5 μmol/L EBR处理的活性下降趋势最显著达到最低点(见图5B),与对照差异显著(p<0.05)。结果表明,5 μmol/L EBR处理组可以显著降低甜樱桃POD活性,提高保鲜效果。
2.6 EBR处理对甜樱桃贮藏期间CAT、SOD活性的影响
过氧化氢酶(CAT)属于血红蛋白酶,它能催化植物体内积累的过氧化氢分解为水和分子氧,从而减少H2O2对果蔬组织可能造成的氧化伤害。从图中可以看出,在贮藏0 d~30 d时对照组和10 μmol/L EBR处理组SOD活性呈下降趋势,其中对照组最为明显。在30 d~45 d时CAT活性呈上升趋势,在整个贮藏过程中5 μmol/L EBR处理组CAT活性处于较高水平(见图6A)。5 μmol/L EBR与对照组之间差异显著(p<0.05)。结果说明:5 μmol/L EBR处理组可以提高甜樱桃CAT活性,这与李园园[13]等在草莓果实上的研究结果一致。
超氧化物歧化酶(SOD)是细胞内一种重要的抗氧化酶,能够降低自由基的含量,同时能够加强细胞系统对活性氧或其他过氧化物自由基的抗性,降低毒害作用。从图中可以看出,0~15 d各个处理组的SOD活性趋于平缓,在贮藏30 d时5 μmol/L EBR和10 μmol/L EBR处理组的SOD活性呈上升的趋势,而对照组下降趋势最明显,在整个贮藏过程中5 μmol/L EBR处理组SOD活性处于较高水平(见图6B)。5 μmol/L EBR处理组与对照组之间差异显著(p<0.05)。结果表明:5 μmol/L EBR处理组可以提高甜樱桃SOD活性,增加其抗氧化能力,这与李园园[13]等在草莓果实上的研究结果一致。

图6 EBR处理对甜樱桃贮藏期间CAT、SOD活性的影响Fig.6 Effect of EBR treatment on CAT and SOD activity during storage of sweet cherry
2.7 EBR处理对甜樱桃贮藏期间LOX活性的影响
脂氧合酶(LOX)是与果实成熟衰老密切相关的一种酶,其主要促进不饱和脂肪酸生成氢过氧化物,直接或者间接地促进了植物组织的衰老过程。由图可知,在整个贮藏过程中各处理组的LOX活性呈上下波动的趋势,在贮藏15 d时对照组和10 μmol/L EBR处理组LOX活性呈上升的趋势,而5 μmol/L EBR处理组呈下降的趋势,在贮藏15 d后对照组和10 μmol/L EBR处理组LOX活性呈下降再上升的趋势,在整个贮藏期内5 μmol/L EBR处理组LOX活性处于较低水平,5 μmol/L EBR处理组与对照组之间差异显著(p<0.05).结果说明5 μmol/L EBR处理组可以降低甜樱桃LOX活性,保持较好的贮藏保鲜效果。

图7 EBR处理对甜樱桃贮藏期间LOX活性的影响Fig.7 Effect of EBR treatment on LOX activity during sweet cherry storage
3 结论
5 μmol/L EBR处理甜樱桃可以有效延缓果实硬度、可溶性固形物含量的下降及甜樱桃颜色变化,减轻果柄、果肉的褐变及腐烂的发生,抑制MDA含量的升高;抑制多酚氧化酶(PPO)、过氧化物酶(POD)、脂氧合酶(LOX)活性,提高过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性;延缓了樱桃品质变化和衰老,从而较好的保持了果实在贮藏和货架期间的品质和风味。
