猪肺血管紧张素转化酶 纯化工艺中试放大研究
2018-07-11廖丹葵熊珍爱周利琴孙丽霞伍善广兰雄雕
廖丹葵,熊珍爱,周利琴,孙丽霞,伍善广,兰雄雕,2,*
(1.广西大学化学化工学院,广西南宁 530004;2.广西大学轻工与食品工程学院,广西南宁 530004;3.广西科技大学医学院,广西柳州 545006;)
血管紧张素转化酶(angiotensin converting enzyme,ACE)是一种膜结合的锌依赖型二肽羧基肽酶[1],在肾素-血管紧张素系统中起到关键作用,可对体内血压进行调节[2]。因此,ACE成为降血压药物研究的靶向分子。随着ACE抑制剂类降血压药物受到研究者越来越多的关注,ACE的需求量不断增大,但是商品ACE价格十分昂贵,实验成本过高,使得ACE抑制剂类降血压药物的研发及作用机理研究受到了一定限制。因此,寻求一种简便的制备大量ACE的方法是十分必要的。研究表明,ACE广泛存在于哺乳动物组织中,如肺、肾、小肠等[3],其中肺部组织的含量最高[4]。已有文献报道从各种动物肺部组织中提取ACE,其中,猪肺具有来源广、价格低廉的特点,因此,以猪肺为原料制备ACE可降低ACE生产成本,同时也能实现猪肺的高值化利用。目前,ACE的纯化方法主要有凝胶层析[5-6]、离子交换层析[7-8]、亲和层析[9-10]等,通常需将几种纯化方法结合,才能最终得到高纯度的ACE,纯化步骤繁琐,耗时长,成本高,限制了其纯化工艺的发展,大多数停留在实验室阶段的研究,工艺放大的可行性无法确定。
本课题组前期以新鲜猪肺为原材料,采用DEAE离子交换层析-超滤法对猪肺ACE进行分离纯化,得到电泳级纯的ACE[11]。本实验在此基础上,对DEAE离子交换层析进行放大,在尽可能低的生产成本下,得到高纯度产品,为其更大规模的纯化生产提供参考。
1 材料与方法
1.1 材料与仪器
新鲜猪肺 购于当地农贸市场;牛血清白蛋白 Aladdin试剂有限公司;马尿酸、马脲酰-组氨酰-亮氨酸 Sigma公司;DEAE Sepharose FF离子交换树脂 GE公司;蛋白预染Marker 生工生物工程(上海)股份有限公司;其他试剂 均为国产分析纯。
AR UV2501 pC型紫外可见光光度计 日本岛津公司;JXN-30/26型超高速冷冻离心机 美国贝克曼公司;超滤膜包(100 KD) 德国赛多利斯公司;高效液相色谱仪 美国安捷伦有限公司;蛋白纯化仪 美国GE公司。
1.2 实验方法
1.2.1 猪肺ACE粗提液的制备 参考吴琼英等[7]的方法处理制备猪肺ACE粗提液。新鲜猪肺洗净,剔除气管、脂肪,切成小块。称取200 g猪肺,加入1 L含0.25 mol/L蔗糖的硼酸缓冲液(BBS,0.1 mol/L,pH8.3)进行匀浆,匀浆液于4 ℃冰箱中浸提5 h。4 ℃条件下,8000 r/min离心40 min,得到匀浆上清液。往匀浆上清液中缓慢加入硫酸铵至终浓度为1.6 mol/L,于4 ℃冰箱中静置4 h。4 ℃条件下,8000 r/min离心40 min,得到一级上清液。往一级上清液中继续加入硫酸铵至终浓度为2.6 mol/L,4 ℃冰箱中静置过夜。4 ℃条件下,8000 r/min离心40 min,得到二级沉淀,用0.1 mol/L硼酸缓冲液(BBS,pH8.3)复溶,装入透析袋(截留分子量为(14000±2000) Da)中,加入同样的缓冲溶液,在4 ℃条件下透析24 h,收集得到猪肺ACE粗提液。
1.2.2 DEAE离子交换层析放大实验
1.2.2.1 线性梯度洗脱 以周利琴等[11]的DEAE离子交换层析的纯化工艺为基础,将层析柱体积放大至150 mL(放大15倍,柱直径为2.5 cm),流速设定为2.5 mL/min。DEAE Sepharose FF 离子交换树脂装柱后,用0.1 mol/L BBS(pH8.3)平衡柱子,ACE粗提液(100 mg蛋白质)上样后,再用0.1 mol/L BBS(pH8.3)洗涤至基线走平,然后用含0.21 mol/L NaCl和不含NaCl的BBS(0.1 mol/L,pH8.3)进行梯度洗脱(梯度洗脱时间为2.5 h),收集洗脱峰,测定蛋白含量及ACE比活。
1.2.2.2 阶梯式梯度洗脱 ACE粗提液(100 mg蛋白质)按照上述方法上样,0.1 mol/L BBS(pH8.3)洗涤至基线走平后,用含0.12 mol/L NaCl的BBS(0.1 mol/L,pH8.3)洗脱柱子,时间为1.5 h,然后用含0.17 mol/L NaCl的BBS(0.1 mol/L,pH8.3)进行洗脱,时间为1 h,收集每一步的洗脱峰,测定蛋白含量及ACE比活。
1.2.2.3 上样量的选择 分别考察上样量为100和150 mg蛋白质对分离效果的影响。ACE粗提液上样后,用0.1 mol/L BBS(pH8.3)洗涤至基线走平,按照上述方法进行阶梯式梯度洗脱,收集目标洗脱峰,测定蛋白含量及ACE比活。
1.2.3 超滤 采用超滤膜包(截留分子量为100 kDa)对DEAE洗脱液进行超滤。100 mL DEAE洗脱液以5 mL/min的流速经过膜包,然后用300 mL不含NaCl的0.1 mol/L BBS(pH8.3)洗涤,收集截留液,测定蛋白浓度及ACE比活。
1.2.4 蛋白含量测定 以牛血清白蛋白为标准蛋白,采用紫外分光光度法测定蛋白浓度。称取一定量的牛血清白蛋白溶于去离子水,配制成0.2、0.4、0.6、0.8和1.0 mg/mL的标准蛋白溶液,在280 nm处测定其吸光值。以牛血清白蛋白的浓度为横坐标,以对应的吸光值为纵坐标作图,通过进行线性拟合,得到蛋白质浓度标准曲线方程:y=0.5855x+0.0031,R2=0.9999。
1.2.5 ACE活力测定 ACE水解马脲酰-组氨酰-亮氨酸(HHL)生成马尿酸(HA),可采用高效液相色谱法测定马尿酸含量[12],计算其的生成速率,根据ACE每分钟催化HHL生成1 μmol HA所需的酶量,从而得到ACE活力,其比活(U/mg)为1 mg蛋白质所具有的酶活力。
1.2.6 ACE分子量及纯度测定 采用不连续SDS-PAGE电泳对ACE的分子量及纯度进行测定。按照夏其昌[13]制备电泳胶(浓缩胶4.0%,分离胶7%)。取15 μL样品,加入15 μL的样品缓冲液,振荡混合均匀,在沸腾的水中加热3 min。样品上样体积为20 μL,电压设置为100 V,样品进入分离胶后,电压调节为150 V。当样品距离底部1 cm时,结束电泳。关闭电源,取下凝胶膜,进行染色、脱色并拍照。
1.3 数据处理
每个实验重复3次,采用Origin 8.0 软件作图,采用SPSS 17.0 软件对数据进行分析,实验数据以平均值±标准差表示。
2 结果与分析
2.1 DEAE离子交换层析放大工艺研究
2.1.1 线性梯度洗脱 在小试实验中[11],DEAE离子交换柱体积为10 mL,流动相流速为1 mL/min,蛋白质上样量为10 mg。将层析柱放大15倍,流动相的线速度保持不变,根据层析柱的直径,确定流动相的流速为2.5 mL/min,上样量加大到100 mg。DEAE离子交换色谱图如图1所示。测定各收集组分的蛋白含量及ACE活力,结果见表1。实验结果表明,在设定的条件下,样品中的ACE全部吸附到DEAE离子交换树脂上,分离效果良好,ACE主要集中在A4中。在周利琴[11]等的小试实验中,ACE粗提液经DEAE纯化,ACE比活提高到0.3953 U/mg,酶活回收率为16.79%。DEAE纯化工艺放大后,ACE比活无显著变化,为(0.365±0.03) U/mg,但是酶活回收率大大提高,为46.6%±0.4%。

图1 DEAE离子交换色谱图(线性梯度洗脱)Fig.1 DEAE ion exchange chromatogram(linear gradient elution)
2.1.2 阶梯式梯度洗脱 在上述放大实验中,吸附的蛋白采用线性梯度洗脱,若进行更大规模的纯化,需要更大型的梯度混合仪,增大成本及实验操作难度。采用阶梯梯度洗脱,可解决上述问题。根据图1和表1的实验结果以及线性梯度时间设置,计算目标蛋白峰出峰时的NaCl浓度,设计阶梯梯度洗脱实验。采用含0.12、0.17 mol/L NaCl的 BBS(0.1 mol/L,pH8.3)进行阶梯梯度洗脱,收集对应的洗脱液B1和B2,结果如图2和表2所示。

图2 DEAE离子交换色谱图(阶梯梯度洗脱)Fig.2 DEAE ion exchange chromatogram(step gradient elution)

表2 DEAE离子交换纯化表(阶梯梯度洗脱)Table 2 Purification of pig ACE by DEAE ion exchange chromatography(step gradient elution)
由表2可知,采用阶梯式梯度进行洗脱,ACE可得到很好的分离,0.12 mol/L NaCl洗脱的都是杂蛋白,无ACE流出;0.17 mol/L NaCl可将ACE洗脱下来。与线性梯度洗脱相比,ACE比活和酶活回收率无明显变化。因此,在DEAE离子交换层析放大工艺中,可采用阶梯梯度洗脱的方式对猪肺ACE进行洗脱,从而简化实验操作。
2.1.3 上样量的确定 在层析中,当上样量过少,树脂得不到充分利用;上样量过多,目标蛋白会随穿透液流出,造成样品的浪费。此外,不同的上样量,会造成树脂吸附能力发生变化,继而影响洗脱的效果。本实验考察了上样量蛋白量为100和150 mg对纯化效果的影响,结果如表3所示。由表可见,加大样品上样蛋白量,更多的杂蛋白吸附到树脂上,使得收集的洗脱液比活降低,不利于ACE的纯化。通过综合比较,选择上样蛋白量为100 mg。
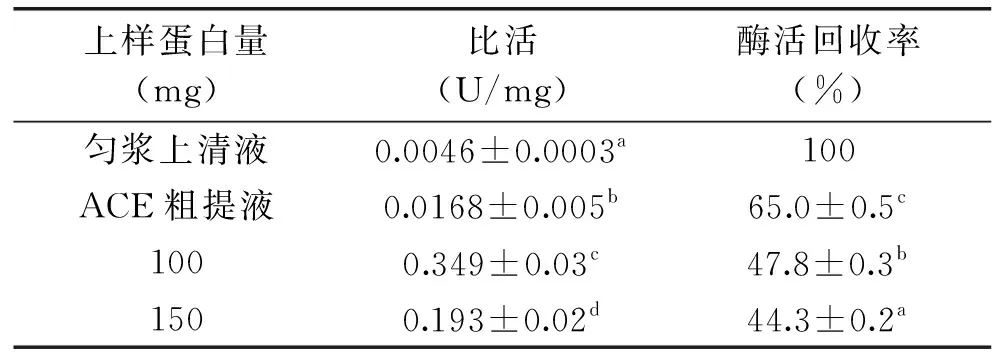
表3 上样量对DEAE离子交换层析纯化的影响Table 3 The effect of loading quantities on the purification of DEAE ion exchange chromatography
2.2 超滤
采用超滤膜包(截留分子量为100 KD)对DEAE洗脱液进行超滤处理,结果如表4所示。最终纯化的ACE比活为(1.05±0.04) U/mg,酶活回收率为34.6%±0.3%,与小试实验相比,纯化的ACE比活无明显变化。
2.3 ACE纯度及分子量测定
纯化后的猪肺ACE的SDS-PAGE电泳图如图3所示。由图3可知,猪肺ACE透析液经DEAE离子交换和超滤,电泳图显示为一条条带,达到电泳级纯。根据标准Marker的相对分子量的对数与相对迁移率的线性关系,计算得ACE相对分子量约为180 kD,与小试实验的纯化结果一致。

图3 猪肺ACE SDS-PAGE电泳图Fig.3 SDS-PAGE analysis of pig lung ACE
目前,研究所用ACE大多依赖进口,价格十分昂贵,主要原因就是ACE的纯化周期长,成本高。DEAE离子交换层析-超滤法作为一种ACE的纯化方法,具有生产成本低,工艺操作简单,周期短,稳定性好的优点。
由表5可知,在小试实验中,采用该方法可纯化得到比活为1.25 U/mg的电泳级纯ACE,酶活力回收率达12.28%。DEAE离子交换柱体积放大15倍后,上样量扩大10倍,洗脱液经超滤后,最终得到的ACE比活为(1.05±0.04) U/mg,SDS-PAGE电泳结果显示为一条条带,酶活回收率为34.6%±0.3%。由此可见,纯化工艺放大后,所得的ACE比活、纯度变化不大,酶活回收优于小试实验结果,该工艺是可行的。此外,在放大实验中,采用阶梯梯度方式进行洗脱,与小试中的线性梯度洗脱相比,更适合大规模工业化生产。

表5 猪肺ACE纯化小试与放大工艺比较Table 5 Purification of pig lung ACE by small and scale-up process
3 结论
本研究在实验室水平成功采用DEAE离子交换层析-超滤法纯化ACE的基础上,对DEAE离子交换层析进行了放大研究。DEAE离子交换柱体积放大到150 mL,流速为2.5 mL/min,上样蛋白量为100 mg,采用0.12 mol/L NaCl和0.17 mol/L NaCl进行阶梯梯度洗脱,0.17 mol/L NaCl 洗脱液在流速为5 mL/min条件下超滤,获得的ACE比活及纯度与小试实验结果无明显差异。研究结果表明,将实验室开发的ACE纯化小试工艺进行放大是可行的,甚至可以得到更高的酶活回收率,为后续放大到更大规
模的工业化生产提供了参考。
