血清学优化指标在克罗恩病黏膜愈合判断中的诊断效能
2018-07-10袁嘉伟张義捷黄礼睿张亚历顾红祥
袁嘉伟 张義捷 黄礼睿 张亚历 顾红祥
克罗恩病(Crohn′s disease,CD)是一种病因尚未明确,以慢性反复性肠道溃疡为主要表现的疾病。有研究证实,克罗恩病患者治疗后达到黏膜愈合时,其病情的复发和接受手术的风险明显降低[1]。因此,克罗恩病的黏膜愈合和长期临床缓解为临床治疗所追求的目标。然而,患者肠道黏膜愈合状况需行结肠镜检查方能明确。内镜检查为侵入性检查,检查前需行肠道准备,检查过程中常有痛苦体验,患者在临床缓解期间可能会拒绝肠镜随访,不能随时监控病情变化。因此,寻找一种无创、非侵入性的检查以降低患者接受肠镜检查的频率,让临床缓解期的患者接受定期随访是医患共同的期待。本研究旨在探讨血清白蛋白(ALB)、C-反应蛋白(CRP)、血小板计数(PLT)及血清学优化指标PLT/ALB、CRP/ALB与黏膜愈合的关系,并评估其检验效能。
资料与方法
一、研究对象
收集2000年1月至2017年12月在南方医科大学南方医院消化内科已确诊克罗恩病并经治疗后获得临床缓解的住院患者进行回顾性分析。根据下面描述的纳入排除标准筛选后,有75例患者被纳入研究,分别对每例患者进行 CDAI(Crohn′s disease activity index)评分、内镜下 SES-CD 评分(Crohn′s disease simplified endoscopic score)并收集血清白蛋白(ALB)、C-反应蛋白(CRP)、血小板计数(PLT)等检测结果。纳入标准:①根据2013年中国炎症性肠病诊断与治疗的共识意见诊断为克罗恩病[2];②在本院接受药物治疗,并在经过治疗后达到临床缓解(CDAI<150分);③在治疗后均有肠镜检查记录,并有相对应的血清学检查记录。排除标准:①合并其他感染性疾病(如感染性肠炎、肠结核)、淋巴瘤、溃疡性结肠炎、严重肝肾疾病,其他肠道肿瘤等;②治疗期间出现肠梗阻、肠瘘等并发症在本院或外院接受手术治疗者;③未在本院完成治疗或数据缺如者。
二、研究方法
详细记录患者的一般资料如性别、年龄等,以蒙特利尔分型对克罗恩病患者进行分型[3]。同时记录患者完成治疗前后的肠镜SES-CD评分、ALB、CRP、PLT。所有入选患者均由南方医院消化内科1名不知情且有丰富内镜阅片经验的医师按照SESCD标准进行评分。使用CDAI评分,当CDAI<150分时定义为临床缓解[2];根据内镜检查结果,当SESCD<2分时定义为内镜下缓解,即黏膜愈合[4]。以临床缓解患者是否已达到黏膜愈合分成两组,分析血清学指标在两组间的差异并评估每个相关指标的诊断效能。
三、统计方法
采用SPSS22.0软件对数据进行分析。通过对比检验 (χ2检验、Mann-whittney U检验、t检验、Spearman′s相关分析)分析黏膜愈合组与非黏膜愈合组的一般资料、肠镜评分以及血清学指标的差异,P<0.05为差异具有统计学意义。通过受试者工作曲线(ROC)检验其敏感性、特异性及曲线下面积。
结 果
一、患者的一般情况
75例治疗后已达临床缓解的克罗恩病患者中32例患者达到黏膜愈合,43例患者未达到黏膜愈合;黏膜愈合组与非黏膜愈合组在性别、年龄比较上无统计学差异(P均>0.05),见表1。
二、血清学指标及优化指标与黏膜愈合的相关性分析
治疗前,非黏膜愈合组患者与黏膜愈合组患者的 ALB、PLT、CRP、CRP/ALB、PLT/ALB 均无统计学差异,证明治疗前两组患者的血清学指标无明显差异,见表2。
治疗后,与非黏膜愈合组患者相比,黏膜愈合组ALB升高;PLT、CRP降低,在黏膜愈合组中,优化指标PLT/ALB和CRP/ALB降低,以上对比均有有统计学差异(P < 0.05),见表 2。
Spearman′s相关分析显示,治疗前后ALB、CRP、CRP/ALB、PLT/ALB与肠镜评分存在显著相关性(P < 0.05),见表 3。
三、血清学指标及优化指标对评价黏膜愈合的准确性分析
通过描绘ROC曲线,以评价血清学指标ALB、CRP以及血清学优化指标CRP/ALB、PLT/ALB对评价黏膜愈合的诊断效能。结果显示,在所有与黏膜愈合相关的指标中,当CRP/ALB<0.147时,在临床缓解患者中诊断黏膜愈合的正确指数最高,且血清学优化指标使用的特异度较血清学指标单个使用时高,见表4。
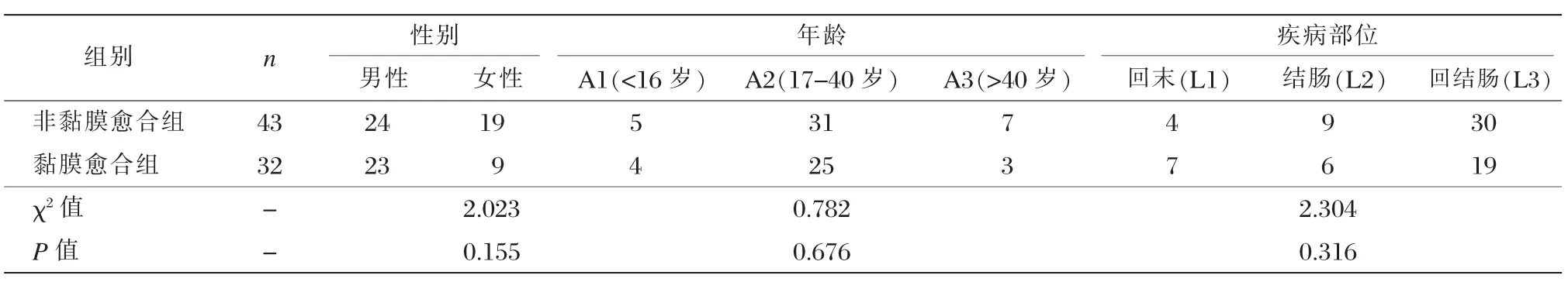
表1 纳入研究患者的一般资料 (n)
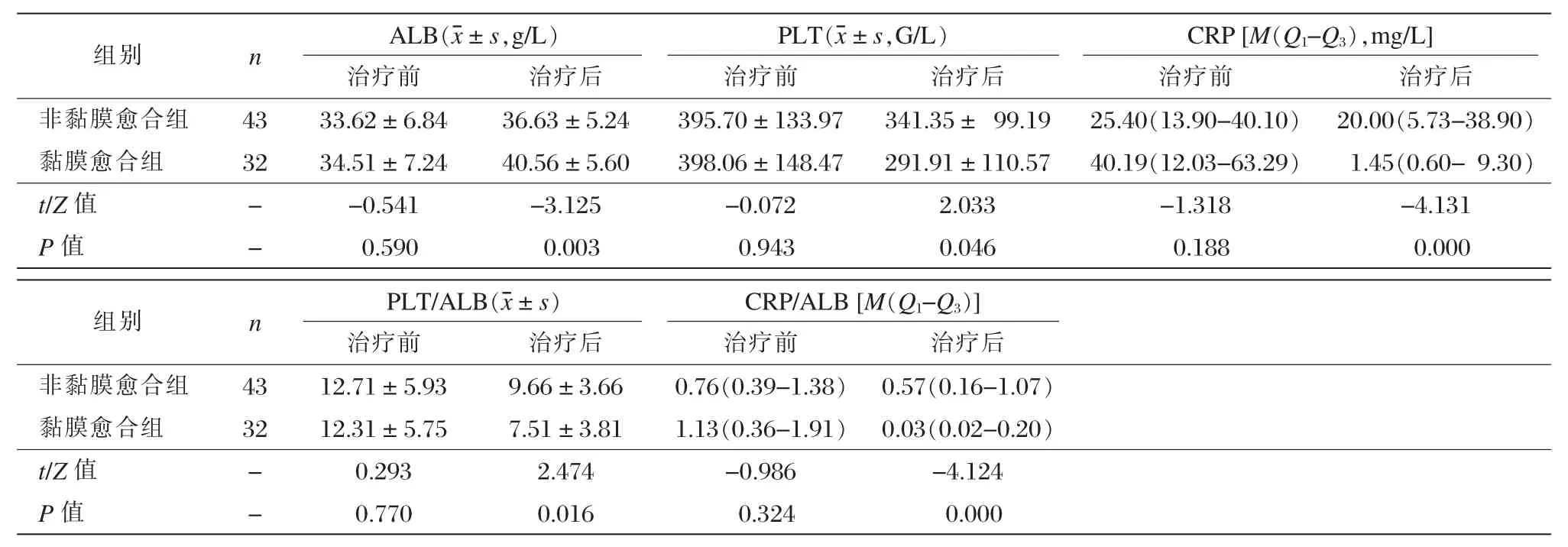
表2 两组治疗前后ALB、CRP、PLT、CRP/ALB、PLT/ALB水平比较
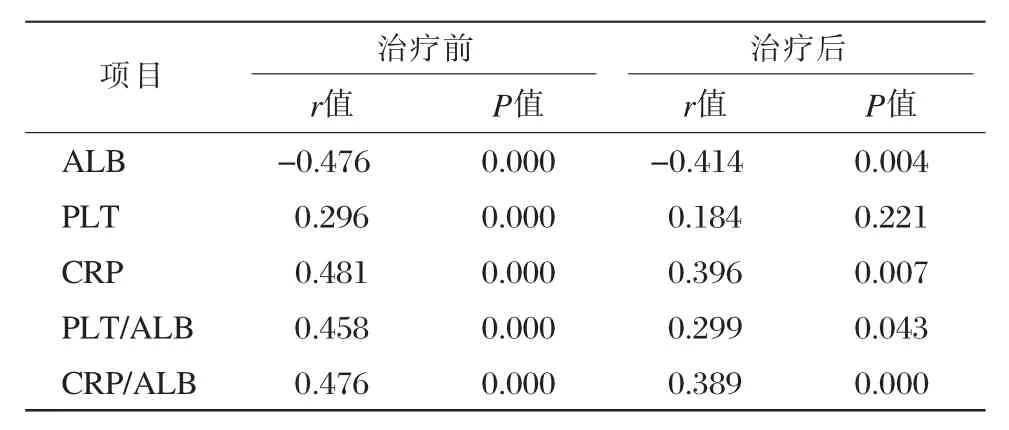
表 3 SES-CD 评分与 ALB、CRP、PLT、CRP/ALB、PLT/ALB 关系
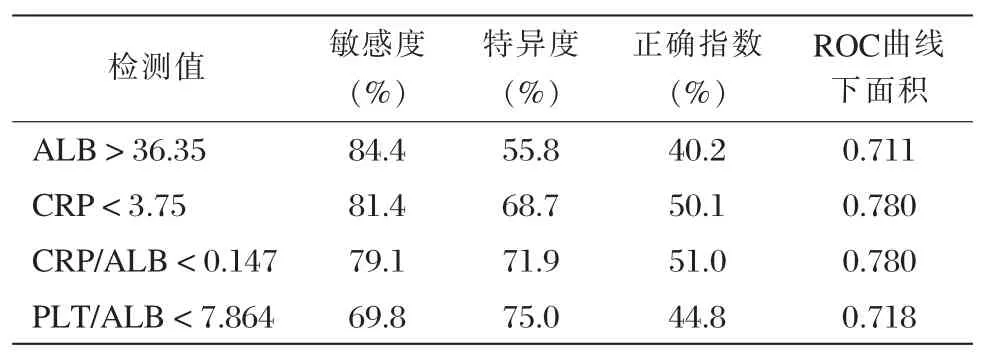
表4 治疗后ALB、CRP、CRP/ALB、PLT/ALB评估是否黏膜愈合的敏感度、特异度与ROC曲线下面积
讨 论
目前,黏膜愈合已被证实能显著降低克罗恩病患者的复发率以及需要手术的风险,有研究显示,黏膜愈合比单纯临床缓解的患者更容易获得长期临床缓解( > 50 周,OR 2.8,95%CI 1.91-4.10),长期的黏膜愈合(OR 14.30,95%CI 5.57-36.74)以及更能有效避免手术(OR 2.22,95%CI 0.86-5.69)[1]。 因此,监测临床缓解期患者处于持续黏膜愈合状态有助于减少患者并发症的出现以及接受手术的概率。然而,目前对临床缓解期患者的随访中,患者将忍受多次肠镜检查,肠镜检查的痛苦往往使患者不能遵医嘱定期复查,不利于定期监控病情变化。而血清学标记物的出现让治疗期间单纯门诊抽血随访变成可能。同时,血清学标志物亦能在治疗后或术后随访患者,对评估其预后有相当重要的意义[5]。因此,一种评估临床缓解患者是否处于黏膜愈合状态的无创手段,有助于减少患者痛苦的同时改善患者的预后。
目前已有大量研究证实多种血清学标志物与克罗恩病的活动度相关,且有少量的研究通过临床参数来预测克罗恩病患者远期肠道狭窄或肠梗阻形成[6-7],但是却未发现有研究对比临床缓解患者的血清学指标与黏膜是否愈合之间的关系,本研究尝试回答这一问题,希望能找到血清学优化指标评估克罗恩病患者的黏膜愈合状况,指导临床治疗。
在血清学指标的选取上,笔者查阅了大量文献,发现CRP早在1979年已被用于评估炎症性肠病的活动度[8],目前在临床上仍经常用其评价肠道炎症的活动程度。PLT可以反映机体是否处于急性炎症状态[9];ALB由肝脏合成,其水平高低受肠道的炎症及机体营养水平的影响,这就意味着白蛋白不仅是作为机体营养水平的指标,更是可用于评估克罗恩病的疾病严重程度的指标之一[10-11]。综合上述研究结果我们发现,CRP、PLT及ALB作为炎性指标的血清学检验,具备对克罗恩病疾病活动度及远期临床结局的评估能力,但是单独应用一种血清学指标来评价疾病,其特异度较低,因此越来越多的学者尝试优化血清学指标以提高其评估疾病时的特异度。Qin等[12]提出炎症指标组合营养学的优化指标CRP/ALB在克罗恩病的活动度的评估方面特异性更高。Stidham等[13]发现使用优化指标PLT/ALB可评估克罗恩病患者的手术风险。因此血清学优化指标的使用,无论对评估克罗恩病的活动度还是预后,均可得到较好的诊断效能。本研究发现,在诊断临床缓解的克罗恩病患者是否已达到黏膜愈合的诊断效能方面,单用ALB时,敏感度84.4%,特异度55.8%,正确指数40.2%;单用CRP时,敏感度81.4%,特异度68.7%,正确指数50.1%;而优化指标CRP/ALB的敏感度达79.1%,特异度达71.9%,正确指数51%。不难看出血清学指标优化后,比起单独评价时特异度及正确指数更高。
对治疗后达到临床缓解的克罗恩病患者的临床资料、血清学资料以及内镜资料进行综合分析,发现血清学优化指标特别是CRP/ALB能更有效地监测肠道黏膜的愈合情况,有助于减少临床缓解期患者接受肠道检查的频率,让通过门诊抽血随访,及时了解患者肠道黏膜的大致情况成为可能。
[1]Shah SC,Colombel JF,Sands BE,et al.Systematic review with meta-analysis:mucosal healing isassociated with improved longterm outcomes in Crohn′s disease[J].Aliment Pharmacol Ther,2016,43(3):317-333.
[2]胡品津.炎症性肠病诊断与治疗的共识意见(2012年o广州)解读[A].2012中国消化系疾病学术大会[C].中国上海,2012.
[3]Satsangi J,Silverberg MS,Vermeire S,et al.The Montreal classification of inflammatory bowel disease: controversies,consensus,and implications[J].Gut,2006,55(6):749-753.
[4]Molander P,Sipponen T,Kemppainen H,et al.Achievement of deep remission during scheduled maintenance therapy with TNFαblocking agentsin IBD[J].JCrohns Colitis,2013,7(9):730-735.
[5]张怡,王培学,张红杰.炎性生物标志物在克罗恩病诊断与疾病评估中的作用[J].世界华人消化杂志,2016,24(32):4389-4395.
[6]Kugathasan S,Denson L A,Walters T D,et al.Prediction of complicated disease course for children newly diagnosed with Crohn′s disease:a multicentre inception cohort study[J].Lancet,2017,389(10080):1710-1718.
[7]Mazor Y, Maza I, Kaufman E, et al. Prediction of disease complication occurrence in Crohn′s disease using phenotype and genotype parameters at diagnosis[J].J Crohns Colitis,2011,5(6):592-597.
[8]AndréC,Descos L,AndréF,et al.C-reactiveprotein usefulnessin diagnosis and survey of Crohn′s disease and ulcerative colitis(author′stransl)[J].Gastroenterol Clin Biol,1979,3(11):789-794.
[9]Harries A D,Fitzsimons E,Fifield R,et al.Platelet count:a simple measure of activity in Crohn′s disease[J].Br Med J(Clin Res Ed),1983,286(6376):1476.
[10]Novacek G, Vogelsang H, Schmidt B, et al. Are single measurements of pseudocholinesterase and albumin markers for inflammatory activity or nutritional status in Crohn′s disease?[J].Wien Klin Wochenschr,1993,105(4):111-115.
[11]Don BR,Kaysen G.Serum albumin:relationship to inflammation and nutrition[J].Semin Dial,2004,17(6):432-437.
[12]Qin G,Tu J,Liu L,et al.Serum Albumin and C-Reactive Protein/Albumin Ratio Are Useful Biomarkersof Crohn′s Disease Activity[J].Med Sci Monit,2016,22:4393-4400.
[13]Stidham RW,Guentner AS,Ruma JL,et al.Intestinal Dilation and Platelet:Albumin Ratio Are Predictors of Surgery in Stricturing Small Bowel Crohn′s Disease[J].Clin Gastroenterol Hepatol,2016,14(8):1112-1119.
