基于NIR-SERS基底的肺癌氧合血红蛋白NIR-SERS光谱研究
2018-07-10朱绍玲
高 飞,张 明,朱绍玲,熊 洋
(1遵义医学院物理教研室,贵州遵义562503;2遵义医学院附属医院检验科,贵州遵义562500;3楚雄师范学院光谱技术应用研究所,云南 楚雄 675000)
0 引言
近些年来,肺癌这种常见恶性肿瘤的死亡率以及发病率均迅速攀升,极大地威胁着各国人民的生命健康[1]。 数据[2]显示,我国每年死于肺癌的人数高达60余万,这种疾病的累计危险性已经迅速攀升至首位。一直以来,医学界均尚未探索出比较高效且完善的肺癌诊断治疗方案,因此很难及时发现并诊断肺癌。这种情况直接导致了许多肺癌患者被误诊或病情延误,往往在就诊时已经发展至晚期。就现阶段而言,支气管镜检查、放射性核素检查、细胞学检查、X射线检查、剖胸探查术、ECT检查、纵膈镜检查等为临床常见的肺癌诊断检查方法[3-4],不过从客观上来讲,上述方法都不是完善的,均存在着一定的缺陷与不足,如费用高昂,操作复杂度较高,灵敏度较低,会对患者造成创伤等。与此同时,应用这些方法诊断肺癌还存在着检测盲区、假阴性等问题[5]。在这一背景下,想要有效提升肺癌患者的生存率,当务之急在于探索出一套安全、简便的早期肺癌检测方法。
利用灵敏度高、简单快捷、生物兼容性好等优点的近红外表面增强拉曼散射(near infrared surface⁃en⁃hanced Raman scattering,NIR⁃SERS)光谱技术可以直观地获取分子含量以及转动、振动信息[6]。目前,这种技术在临床领域已经有了基本的应用。医学诊断领域也逐步引入了此项技术。在本研究中,将NIR⁃SERS基底定为二维纳米银膜,对肺癌患者以及健康人进行NIR⁃SERS光谱检测分析,主要通过785 nm近红外激光波长来检测并分析研究氧合血红蛋白,有利于提高肺癌SERS光谱技术诊断效率以及可行性。从一定程度上来讲,NIR⁃SERS技术具备应用于肺癌临床诊断领域的潜力与价值。
1 材料和方法
1.1 实验材料 血液样品:2015年5月至7月在遵义医学院附属医院采集血液,从健康人和肺癌患者胳膊抽静脉血液样本各25例,样品规格均为3 mL。
1.2 实验方法
1.2.1 提取氧合血红蛋白 第一步,血液样本编号。完成编号后分别提取每个样本各2 mL,37℃室温放置使其自然凝结,放置时间为1 h,血样凝结后利用小型台式离心机进行5000 r/min,5 min的离心处理,待样品分层后将下层血红细胞提取出并分装至新的离心管中,提取量为200 μL。向提取的红细胞中加入九倍体积的去离子水,缓慢混合后再次进行5000 r/min,
5min的离心处理,溶液分层后的中间层便是氧合血红蛋白。抽取500 μL中间层溶液置于4°C保存,用于后续检测处理。
1.2.2 氧合血红蛋白 NIR⁃SERS光谱测定 测定方案参照刘仁明等制备二维纳米银膜的方法[7],在纳米银膜基底上均匀涂覆制备好的氧合血红蛋白样品,涂覆量为60 μL,使其均匀覆盖在基底上并形成直径约1 cm的液体薄膜。待其自然干燥后利用美国海洋光学公司生产的便携式拉曼光谱仪(R⁃2500TM)进行检测。NIR⁃SERS光谱的测定选取了785 nm激光波长,采用垂直照射的方法,参数:激光功率密度J=103W·cm-2,每次扫描16 s,扫描次数为2次。为了降低实验误差,各样品分别测试三条谱线并取平均值。
1.3 数据处理 数据分析与处理采用的工具包括2007excel、Origin 8.0、SPSS19.0、Raman Spectrum 等。
2 结果
2.1 氧合血红蛋白NIR-SERS光谱 将NIR⁃SERS基底定为二维纳米银膜,对肺癌患者以及健康人进行NIR⁃SERS光谱检测分析,每组研究对象的样本数量均为25名,图1A为25名健康人氧合血红蛋白NIR⁃SERS光谱,图1B为25名肺癌患者氧合血红蛋白NIR⁃SERS 光谱。
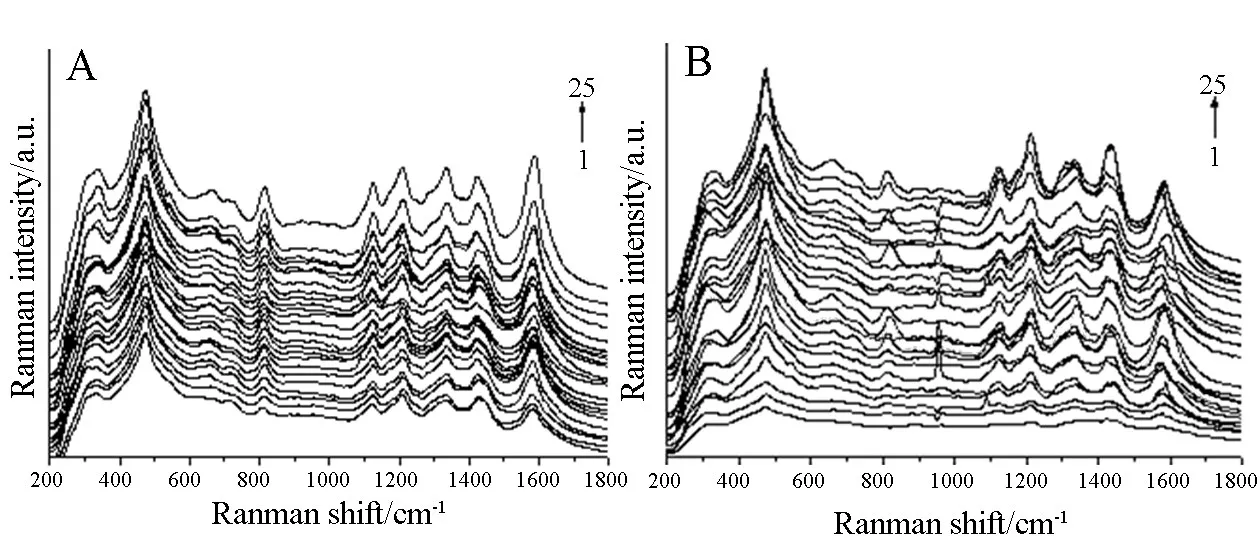
图1 氧合血红蛋白NIR⁃SERS光谱
将25名健康人(A)和25名肺癌患者(B)氧合血红蛋白NIR⁃SERS光谱求出平直曲线,并将谱线平均值向上/下平移处理,进而获取到直观的对比结果。图2为25名健康人(A)和25名肺癌患者(B)氧合血红蛋白平均NIR⁃SERS光谱比对,由图2可知,就氧合血红蛋白NIR⁃SERS光谱分析结果而言,两组样品具备明显差异。相比于健康人,肺癌患者的氧合血红蛋白 NIR⁃SERS光谱强度相对较小。 在 473、662、723、816、1126、1208、1336、1425、1583 cm-1均出现了两组研究样本氧合血红蛋白NIR⁃SERS光谱共有的谱峰;图中健康人和肺癌患者光谱谱峰强度有明显区别,相比于肺癌患者,在 662、723、816 cm-1等位置处健康人氧合血红蛋白NIR⁃SERS光谱谱峰强度相对较大;473、816、1583 cm-1处健康人的氧合血红蛋白NIR⁃SERS光谱出现的拉曼谱峰较肺癌患者更为明显。另外,在1583 cm-1处,健康人氧合血红蛋白平均NIR⁃SERS 光谱出现蓝移现象,蓝移至 1579 cm-1,肺癌患者在1208、1425 cm-1处谱峰出现红移现象,移动至 1212、1432 cm-1。

图2 25名健康人(a)和25名肺癌患者(b)氧合血红蛋白平均NIR⁃SERS光谱比对
2.2 t检验结果分析 对25名健康人和25名肺癌患者氧合血红蛋白NIR⁃SERS光谱扣除荧光背景,由于光谱中信息主要来自谱峰的相对强度和形状,故将在400~1800 cm-1范围内的谱峰进行面积归一化,面积归一化可以消除由于实验条件的微小差异对实验结果的影响。本实验采用的面积归一法就是指把氧合血红蛋白NIR⁃SERS光谱的谱峰面积逐个算出来(采用 Origin作图软件计算谱峰面积),如 S1、S2、S3.....Sn,然后把每个谱峰的面积相加得 S 总,再用每个谱峰的面积 S1、S2、S3.....Sn 除以总面积 S 总得到每个谱峰所占的面积比 A1、A2、A3...An,即An=Sn/S总。表1是 25名健康人和 25名肺癌患者在 473、662、723、816、1126、1208、1336、1425、1583 cm-19处谱峰面积的显著性分析。
通过表1显著性分析可以看出肺癌患者相对正常人在473 cm-1处谱峰面积 A1和1583 cm-1处谱峰面积A9有所减小,达到显著水平。肺癌患者相对正常人在816 cm-1处谱峰面积A4明显减小,达到极显著水平。对25名健康人和25名肺癌患者在473、662、723、816、1126、1208、1336、1425、1583 cm-19 处谱峰面积的显著性分析得出的结果与上述NIR⁃SERS光谱分析基本吻合,从而更加验证了上述分析结论。

表1 25 例健康人和 25 例肺癌患者在 473、662、723、816、1126、1208、1336、1425、1583 cm-19 处谱峰面积的显著性分析
3 讨论
从表1氧合血红蛋白拉曼谱峰的初步归属[9-12]中能够清晰直观地了解生物分子变化所导致的肺癌患者血红蛋白NIR⁃SERS光谱变化的具体机理,氧合血红蛋白分子乙烯基团(CaCm)的对称和反对称伸缩振动分别是引发处于1425、1583 cm-1附近的拉曼谱峰的根本原因;吡咯环间CmH基团的变形振动是引发处于1208 cm-1附近的拉曼谱峰的根本原因;吡咯半环的反对称以及对称伸缩振动分别是引发处于1126、1336 cm-1附近的拉曼谱峰的根本原因。
由图2可知,相比于健康人而言,在1583、816、473 cm-1处肺癌患者的氧合血红蛋白NIR⁃SERS光谱谱峰强度较小,从表2氧合血红蛋白拉曼谱峰的初步归属得知上述三个谱峰的产生原因分别为氧合血红蛋白分子乙烯基团(CaCm)的反对称和对称伸缩振动、氧合血红蛋白吡咯环的对称和反对称变形振动、氧合血红蛋白水合高铁血红蛋白吡咯环折叠振动,上述结果的依据为血红蛋白拉曼谱峰的初步归属分析结果。肺癌患者的谱峰之所以小于正常人,主要原因是上述三种振动模式数量的减少。另外,由于氧合血红蛋白吡咯环以及氧合血红蛋白分子乙烯基团的振动会影响人氧合血红蛋白平均 NIR⁃SERS光谱在1583 cm-1的谱峰变化,因此,当肺癌患者新陈代谢紊乱、恶性肿瘤组织异常增大后,其氧合血红蛋白分子乙稀基团、氧合血红蛋白吡咯环的构象以及模式往往会产生变化,进而异于健康人的谱峰移动情况[12]。
通过NIR⁃SERS光谱分析并对比两组研究对象的氧合血红蛋白情况,结果表明,两组样本氧合血红蛋白NIR⁃SERS光谱以及谱峰强度均存在明显差异。相比于健康人,肺癌患者的氧合血红蛋白NIR⁃SERS光谱以及谱峰强度均相对较小。对上述现象的内在原理加以分析后发现,肺癌患者的氧合血红蛋白NIR⁃SERS光谱以及谱峰强度之所以会减小,可能是由于恶性肿瘤组织异常增大所引发的,在这一过程中,患者上皮粘膜组织微血管的增生会直接引发其微血管含氧量的下降,进而诱使肿瘤组织中氧合血红蛋白含量降低[8]。上述变化能够通过氧合血红蛋白NIR⁃SERS光谱情况来加以表征。

表2 氧合血红蛋白的谱峰归属[8-11]
在本研究中,将NIR⁃SERS基底定为二维纳米银膜,对肺癌患者以及健康人进行NIR⁃SERS光谱检测分析。结果显示,两组研究对象的NIR⁃SERS光谱和谱峰强度均具备显著差异,相比于健康人,在1583、816、473 cm-1处肺癌患者的氧合血红蛋白 NIR⁃SERS光谱谱峰强度较小,正常人的氧合血红蛋白平均NIR⁃SERS 光谱在 1208、1425 cm-1谱峰处肺癌患者分别红移至1212、1432 cm-1,通过对氧合血红蛋白平均NIR⁃SERS光谱分析,观察到健康人在1583 cm-1的谱峰蓝移到1579 cm-1。上述谱峰均与氧合血红蛋白吡咯环和乙烯基团(CaCm)的振动有关。对于肺癌患者的氧合血红蛋白NIR⁃SERS光谱以及谱峰强度减小。因此通过肺癌组和对照组的谱峰强度变化揭示了氧合血红蛋白NIR⁃SERS用于诊断肺癌的潜力。利用氧合血红蛋白的NIR⁃SERS进行肺癌或其他疾病的诊断是一项简单快捷、生物兼容性好的技术,从一定程度上来讲,NIR⁃SERS技术具备应用于肺癌或其他疾病临床诊断领域的潜力与价值。
[1]Cerfolio RJ,Bryant AS,Ojha B.Restaging patients with N2 (stageⅢa) non⁃small cell lung cancer after neoadjuvant chemoradiothera⁃py:a prospective study[J].J Thorac Cardiovasc Surg,2006,131(6):1229-1235.
[2]Liu Y,Wang M.Advances in early diagnosis of lung cancer[J].Zhongguo Fei Ai Za Zhi,2011,14(5):429-434.
[3]Lee SM,Park CM,Paeng JC,et al.Accuracy and predictive fea⁃tures of FDG⁃PET /CT and CT for diagnosisof lymph node metastasis of T1 non⁃small⁃cell lung cancer manifesting as a subsolid nodule[J].Eur Radiol,2012,22(7): 1556-1563.
[4]刘振华,徐美金.恶性肿瘤研究的现状和对策[J].人民军医,2002,45(5):269-270.
[5]Liu R,Xiong Y,Tang W,et al.Near⁃infrared surface⁃enhanced Ramanspectroscopy (NIR⁃SERS) studieson oxyheamoglobin(OxyHb) of liver cancer based on PVA⁃Ag nanofilm[J].J Raman Spectrosc,2013,44(3): 362-369.
[6]Feng SY,Pan JJ,Wu YA,et al.Study on gastric cancer blood plasma based on surface⁃enhanced Raman spectroscopy combined with multivariate analysis [J].Sci China Life Sci,2011,54(9):828-834.
[7]刘仁明,自兴发,武延春,等.二维纳米结构银膜表面增强拉曼散射基底的制备与研究[J].中国激光,2009,36(10):2657-2661.
[8]Jain RK.Determinants of Tumor Blood Flow:A Review [J].Cancer Res,1988,48(10):2641-2658.
[9]Abe M,Kitagawa T,Kyogoku Y.Resonance Raman spectra of octa⁃ethylporphyrinato⁃Ni(II) and meso⁃deuterated and 15N substituted derivatives.II.A normal coordinate analysis[J].J Chem Phys,1978,69(10):4526-4534.
[10]Hu S,Smith KM,Spiro TG.Assignment of Protoheme Resonance Raman Spectrum by Heme Labeling in Myoglobin[J].J Am Chem Soc.,1996,118(50):12638-12646.
[11]Geβner R,Winter C,Rösch P,et al.Identification of biotic and abiotic particles by using a combination of optical tweezers and in situ raman spectroscopy[J].Chem Phys Chem,2004,5(8):1159-1170.
[12]Yammoto T,Palmer G.The valence and spin state of iron in oxyhem⁃oglobin as inferred from resonance Raman spectroscopy[J].J Biol Chem,1973,248(14):5211-5213.
