高纯度别藻蓝蛋白提取纯化及光谱特征分析
2018-07-09单小娥张发宇余金卫汪家权
单小娥,张发宇,余金卫,汪家权
(合肥工业大学资源与环境工程学院,安徽合肥 230000)
螺旋藻(Spirulina Sp.)是近年来已经规模化培养的单细胞螺旋丝状蓝藻,其蛋白质含量高达60%~70%。由于螺旋藻营养丰富,并且富含多种药物特性,引起了人们的广泛关注[1]。钝顶螺旋藻(Spirulinaplatesis)是螺旋藻中营养成分最高的一类,具有高蛋白、低脂肪、多种维生素的特点,其中的藻胆蛋白是一种天然食用色素,能够提高淋巴细胞的活性,增强人体免疫力[2],因此常被用来作蛋白提取的材料。
别藻蓝蛋白(APC)是藻胆蛋白的一种,在科学研究、医学、工业中具有广泛的应用前景。事实证明,APC作为荧光探针优于其他的藻胆蛋白,因为APC的最大激发峰和发射峰位于红光区,而大多数的生物材料在红光区无发射峰,这样就避免了相互之间的干扰[3]。同时,APC还可以作为食品中的色素添加剂以及医学中的光敏剂和抗肿瘤物质[4]。研究发现,APC对肠病毒71感染猴肾细胞诱导的细胞病理反应具有明显抑制作用[5]。
APC纯化的方法通常涉及凝胶过滤色谱和离子交换层析的组合,但耗时,并且不适于分离大量的材料[6-7],离子交换层析使用离子强度梯度洗脱也会带来高离子强度的问题。羟基磷灰石可以高效提取高纯度APC,由于APC和CPC的表面电荷性质不同,它们与羟基磷灰石结合的能力也不同。在适当的缓冲液中,羟基磷灰石选择性地仅吸附APC而不吸附CPC[8-9]。
本文采用硫酸铵分级粗提纯结合羟基磷灰石柱层析法从钝顶螺旋藻粉中分离纯化出APC,并对工艺条件进行了优化选择,建立了一个快速、高效的纯化APC的方法,并对纯化液进行紫外-可见吸收光谱扫描,运用光谱学的基本原理分析了该纯化工艺方法的可行性。
1 材料与方法
1.1 实验材料
钝顶螺旋藻粉,用0.02 mol/L磷酸盐缓冲溶液溶解至含水率约为96.5%。
1.2 仪器与试剂
仪器:紫外-可见分光光度仪、低温高速离心机、恒温磁力搅拌器、电子天平、冷柜、QuickSep中高压层析系统、Vantage-L层析柱。
试剂:硫酸铵、磷酸氢二钠、磷酸二氢钠、氯化钠、CHT-B型羟基磷灰石。
1.3 实验方法
(1)藻胆蛋白的粗提。反复冻融3次后过4层普通20目纱布,离心得到藻胆蛋白粗提液。
(2)藻胆蛋白的硫酸铵分级纯化。向粗提的藻胆蛋白中加入浓度为A(1.2~2.0 mol/L)的硫酸铵,在磁力搅拌器上匀速搅拌15min后离心(4℃,8000r/min,10min)取上清。再在上清中加入硫酸铵至浓度为B(1.8~2.6mol/L),匀速搅拌15min后离心取沉淀。沉淀用磷酸盐缓冲溶液溶解待用。
(3)羟基磷灰石柱层析。样品先用0.01mol/L磷酸盐缓冲溶液透析过夜。上样后用100、200mmol/L含0.1mol/L氯化钠的磷酸盐缓冲溶液梯度洗脱,流速6mL/min。将APC纯度大于3部分的洗脱液合并透析过夜后再进行一次柱层析。
(4)APC得率和纯度测定方法[10]。APC浓度=(A650-0.19×A620)/5.65;APC纯度=A650/A280;纯化系数=A650/A620。式中:A620、A650分别代表藻蓝蛋白溶液在620、650 nm处的吸光度。
2 结果与分析
2.1 硫酸铵分级粗提纯条件的优化
一步盐析浓度选择1.2、1.4、1.6、1.8mol/L和2.0mol/L,共5组,进行单因素实验结果如图1。由于一步盐析在1.2~2.0 mol/L浓度下的纯度差别不大,故采用纯化系数和回收率作为筛选条件。由图1可知,随着一步盐析浓度的增加,回收率不断降低,纯化系数先降低后不断上升。一步盐析在1.6 mol/L时APC对PC的含量比发生较大转变,说明溶液中APC对PC的所占比例要高,故选取1.6 mol/L为一步盐析最佳投加点。
二步盐析浓度选择1.8、2.0、2.2、2.4mol/L和2.6mol/L,共5组,进行单因素实验结果如图2。随着硫酸铵浓度的增加纯度先升后降,回收率不断上升。二步盐析在2.2 mol/L后APC纯度发生陡降,而回收率趋势平缓,故选取2.2 mol/L作为二步盐析最佳浓度。
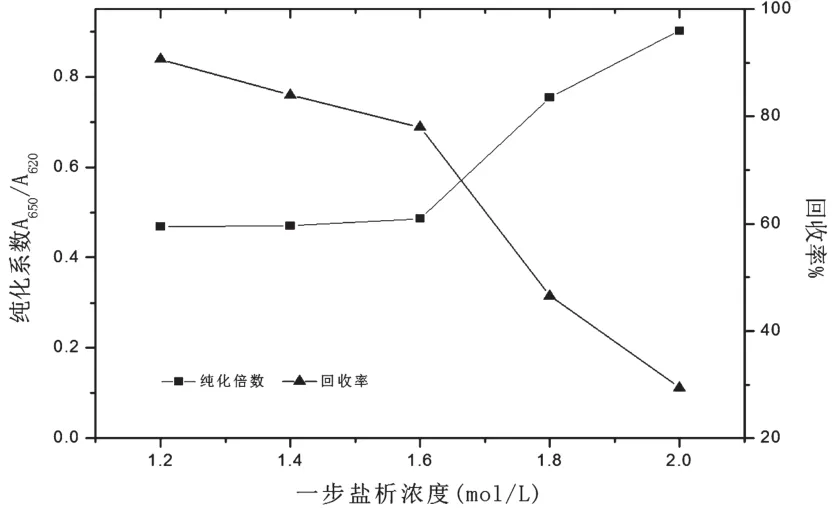
图1 不同一步盐析浓度下APC的纯化系数和回收率
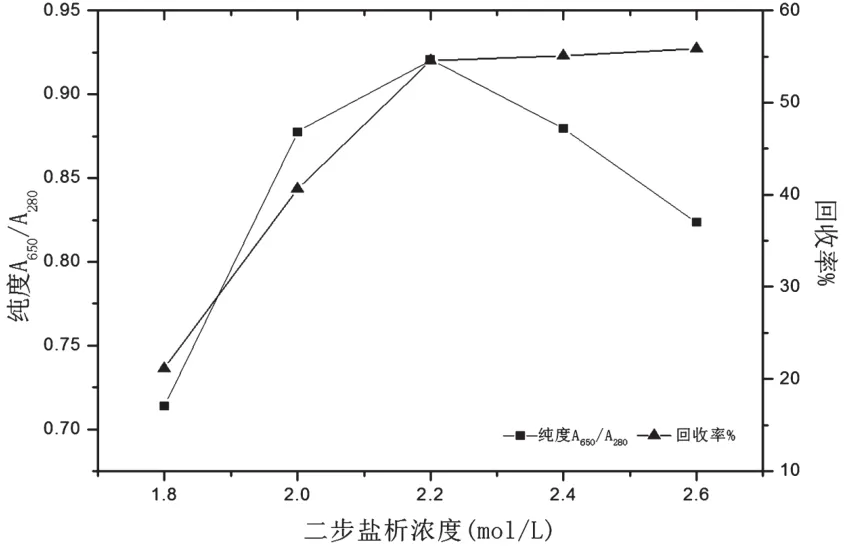
图2 不同二步盐析浓度下APC的纯度和回收率
2.2 羟基磷灰石柱层析分离
图3为第二次羟基磷灰石柱层析分级梯度洗脱曲线。由图可知,洗脱峰为目标组分APC,穿过组分为少量藻蓝蛋白和其他杂蛋白[11]。纯化后的APC纯度达到4.64,回收率高达11.25%。
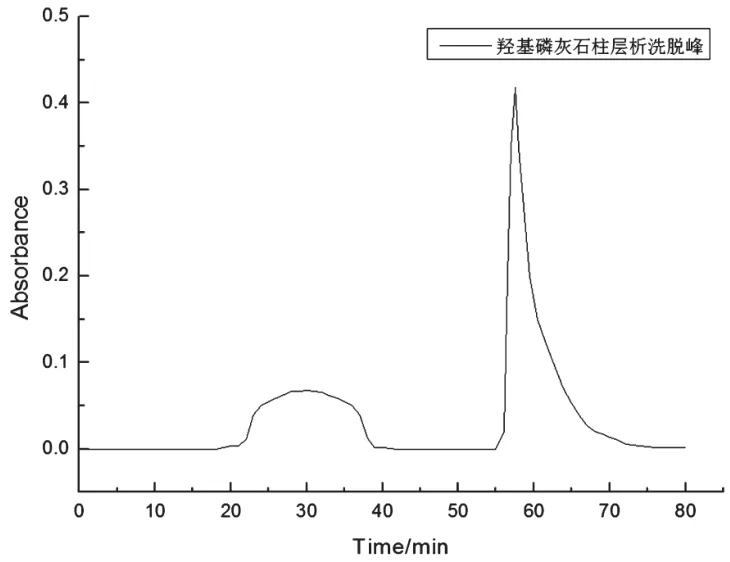
图3 二步羟基磷灰石柱层析分级梯度洗脱曲线
2.3 不同工艺阶段纯化结果比较
综合四步工艺观察APC纯化过程变化的具体情况见表1。如表1所示,经四步工艺后,APC的纯度由初始的0.32上升至4.64,达到试剂级的要求。
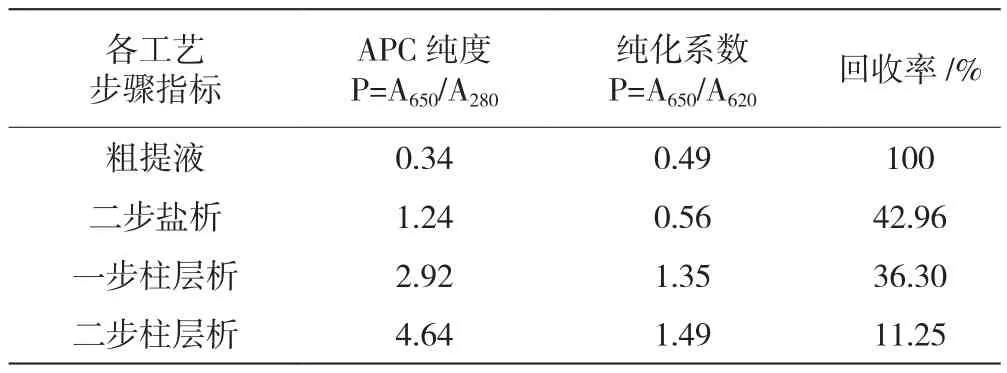
表1 不同阶段APC的相关指标
2.4 光谱分析
对不同纯化工艺阶段后的组分进行200~700 nm全波长扫描,得到完整的光谱扫描图如图4。
因蛋白质中的苯丙氨酸、色氨酸、酪氨酸残基的苯环含有共轭双键,使得蛋白质具有紫外吸收的性质,其吸收峰约在280nm处[12],但一步盐析后的上清液中含有大量的核酸类物质,而核酸物质的最大吸收峰在260nm处[13],因此该段吸收峰蓝移至265nm。
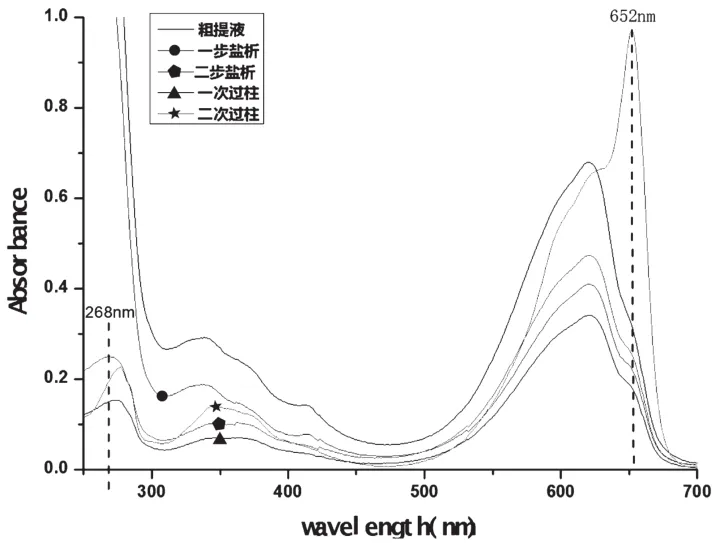
图4 不同阶段的溶液紫外-可见吸收光谱图
综合四步纯化工艺光谱图看,APC溶液在250~300nm吸收谱带中,吸收峰逐步从258 nm移至280nm。在500~700nm处吸收谱带中,吸收峰逐步从620nm移至652nm,最终显示出APC的典型吸收峰特性。
3 结论
运用两步盐析粗提纯结合两次羟基磷灰石层析的工艺能高效纯化APC。实验结果表明采用1.6、2.2mol/L硫酸铵分级粗提纯效果最佳,两步盐析后纯度由0.34上升到1.24。两次羟基磷灰石过柱后纯度达到4.64,回收率高达11.25%。采用同一种填料两次过柱,无需更换填料和洗脱条件,减少填料成本,操作简单,高效省时。
运用紫外-可见吸收光谱法分析各阶段目标产物,可清晰反映目标APC的纯化过程及去除杂质情况。分离出的APC在分别在277nm和652nm有两个明显吸收峰,显示出APC的典型吸收峰特性。
[1]Eriksen N T. Production of Phycocyanin-a Pigment with Applications in Biology, Biotechnology, Foods and Medicine[J]. Applied Microbiology&Biotechnology,2008,80(1):1-14.
[2]李冰,张学成,高美华,等.钝顶螺旋藻藻蓝蛋白提取纯化新工艺[J].海洋科学,2007,31(8):48-52.
[3]Bermejo R, Talavera E M, Alvarez-Pez J, et al. Chromatographic Purification of Biliproteins from Spirulinaplatensis, high-performance Liquid Chromatographic Separation of their α and β subunits[J].Journal of Chromatography A,1997,778(1-2):441-450.
[4]Shih S R, Tsai K N, Li Y S, et al. Inhibition of Enterovirus71-induced Apoptosis by Allophycocyanin Isolated from a Blue-green Alga SpirulinaPlatensis[J]. Journal of Medical Virology,2003,70(1):119-125.
[5]Chen T, Wong Y S, Zheng W. Purification and Characterization of Selenium-Containing Phycocyaninfrom Selenium-enriched SpirulinaPlatensis[J]. Phytochemistry,2006,67(22):2424.
[6]Su H N, Xie B B, Chen X L, et al. Efficient Separation and Purification of Allophycocyaninfrom Spirulina, ( Arthrospira ) Platensis[J]. Journal of Applied Phycology,2010,22(1):65-70.
[7]Soni B, Trivedi U, Madamwar D. A Novel Method of Single Step Hydrophobic Interaction Chromatography for the Purification of Phycocyaninfrom PhormidiumFragile, and its Characterization for Antioxidant Property[J]. Bioresour Technol,2008,99(1):188-194.
[8]Bennett A, Bogorad L. Complementary Chromatic Adaptation in a Filamentous Blue-Green Alga[J].Journal of Cell Biology,1973,58(2):419-435.
[9]Bryant D A, Guglielmi G, Marsac N T D, et al. The Structure of CyanobacterialPhycobilisomes: a Model[J].Archives of Microbiolo gy,1979,123(2):113-127.
[10]朱元荣,吴丰昌,林樱.紫外吸收光谱积分法分析蛋白质浓度-以碱性磷酸酶为例[J].光谱学与光谱分析,2013,33(7):1845-1849.
[11]吕宪禹.蛋白质纯化实验方案与应用[M].北京:化学工业出版社,2010.
[12]张静,韦玉春,王国祥,等.太湖水体中藻蓝蛋白的紫外-可见吸收光谱特征分析[J].光谱学与光谱分析,2014,34(5):1297-1301.
