枯草芽孢杆菌产淀粉酶基因的克隆与表达
2018-07-09单妍王毅吴丽君马永凯宋鹏飞魏云林
单妍,王毅,吴丽君,马永凯,宋鹏飞,魏云林
(1.昆明医科大学海源学院,云南昆明 650106;2.云南中烟工业有限责任公司,云南昆明 653100;3.昆明理工大学生物工程技术研究中心,云南昆明 650500)
烤烟叶片在大田生育过程中会有一定的淀粉积累,淀粉含量越高,反映烟叶越成熟。但在烟叶经过陈化后,烤烟叶片内大量的淀粉、纤维素、果胶质、蛋白质等大分子物质将对烟叶成色质量、烟丝成形质量、卷烟吸食品质具有较大的负面影响[1]。因此,降低陈化烟叶中的淀粉含量,势必成为提高烟叶品质的关键因素。据报道,施加淀粉酶处理烟叶可使淀粉含量明显降低[2-4]。李晓等[5]应用混合酶制剂(糖化酶和α-淀粉酶)水解淀粉,淀粉转化成还原糖增加了20%左右,能有效降解原烟中大部分的淀粉,烟叶品质得到了有效改善。因此,利用淀粉酶降解淀粉对于提高卷烟燃烧的完全性和燃吸时的气味有积极的作用。虽然已有报道开发出了能用于加速烟叶陈化的单一和复合酶制剂,并初步在工业上得到了验证,但依然存在酶性质不清、产量偏低、生产中许多因素不可控、生产成本较高等问题,同时由于原始菌株的长期使用从而导致品种的严重退化,给规模化生产带来重重困难。为了彻底解决烟叶陈化用酶产率低,品质不稳定等技术难关,本课题筛选到陈化烟叶中的一株产淀粉酶菌株,鉴定结果为枯草芽孢杆菌,在此基础上对其进行克隆与表达,达到利用淀粉酶高效降解淀粉以提高烟叶品质的目的,同时为指导烟草用酶制剂的开发提供理论依据。
1 实验材料
1.1 菌种与质粒
受体菌大肠杆菌DH5α、BL21(DE3)和质粒pET30α都为本实验室保存。
1.2 主要试剂
限制性核酸内切酶、ExTaq DNA聚合酶和质粒提取试剂盒购自TaKaRa生物工程有限公司,T4DNA连接酶,质粒提取、凝胶回收试剂盒及Ni-NTA购自上海生工生物工程公司,其余选用的实验试剂为国产分析纯。
2 方法
2.1 淀粉酶YX48-1菌株的筛选与鉴定
选取陈化烟叶样品并进行稀释涂布,初步筛选到6株产淀粉酶菌株。以此为基础,通过测定酶活在液体培养中复筛出1株高产淀粉酶的优质菌株,命名为AmyYX48-1。提取基因组DNA扩增其16S rRNA片段,扩增片段后测序参照《伯杰氏细菌鉴定手册》[6]再进行同源比对,可判断待测菌的种属类别[7]。
2.2 YX48-1的全基因组测序及淀粉酶基因分析
根据文献公布淀粉酶基因保守序列比对后,设计合成上下游引物,上游:5'- CGGGATCCATGTTTGCAAAACGATTCAAAA-3' ;下游:5'-CCCAAGCTTATGAGG AAGAGAACCGCTTA-3'。其中划线部分即为加入的BamH Ⅰ和Hind Ⅲ的酶切位点。再以高产淀粉酶菌株总DNA为模板,用ExTaq DNA聚合酶进行PCR扩增。扩增条件为:94℃预变性5 min;94℃变性30 s,50℃退火 30 s,72℃延伸90s,循环30次;72℃补充延伸10 min。扩增产物连接到T载体上,将样品通过Hiseq2000测序平台送华大基因公司进行测序分析。
2.3 烟用产淀粉酶基因的克隆、表达及纯化
2.3.1 烟用重组淀粉酶的质粒构建
将扩增得到的目的片段连接已经过双酶切的表达载体pET-30a,得到重组质粒pET。将重组质粒pET转入表达宿主E.coli BL21(DE3)中,经Kan抗性筛选、菌落PCR筛选得到克隆菌株E.coli BL21-pET。
2.3.2 重组淀粉酶的诱导表达及纯化
把重组载体pETamyYX48-1转化到大肠杆菌E .coli BL21感受态细胞中进行表达。将转化子于37℃振荡培养至对数中后期,其OD值约为1.0。加入终浓度为1mmol/L的IPTG,16℃、200r/min继续培养12h。把培养好的发酵液高速离心收集菌体,利用破胞缓冲液洗涤菌体;重悬后在冰浴条件下超声波破胞。当菌液澄清时离心收集上清,对上清液金属镍亲和层析法进行纯化。利用SDS-PAGE凝胶电泳来检测纯化效果及酶活性定性。
2.3.3 淀粉酶活性
将0.5mLpH6.8缓冲液配制的1%可溶性淀粉溶液作为底物,在37℃预热2min后加入稀释的酶液50μL,于37℃反应5 min,然后加入350μL的DNS[8]煮沸5min终止其反应。设定波长540nm处测OD值来计算产生的还原糖量。本法规定淀粉酶活力单位(U):在37℃ pH6.8条件下,每分钟生成1μmol葡萄糖所需的酶量为一个酶活单位(1U)。
3 结果与分析
3.1 淀粉酶YX48-1菌株的筛选与鉴定
根据菌落的形态与培养特征、生理与生化、提取基因组DNA扩增其16SrRNA后鉴定结果在进行同源序列比对,发现其与Bacillus subtilis同源性达到95%,故初步鉴定为枯草芽孢杆菌。
3.2 烟用重组淀粉酶的质粒构建
通过引物的设计,以筛选得到的产淀粉酶菌株总DNA为模版进行克隆,凝胶电泳结果(图1)所示,所得淀粉酶基因大小约为2000bp。双酶切结果(图2)都证明该基因已经克隆到质粒pET30α中(图3),后测序结果显示编码区全长1998bp,编码665个氨基酸,理论蛋白质分子量为73.12kD。
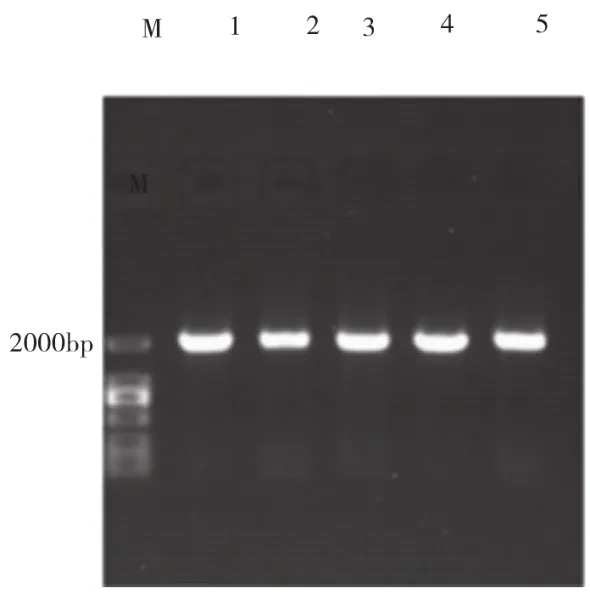
图1 淀粉酶基因片段PCR产物
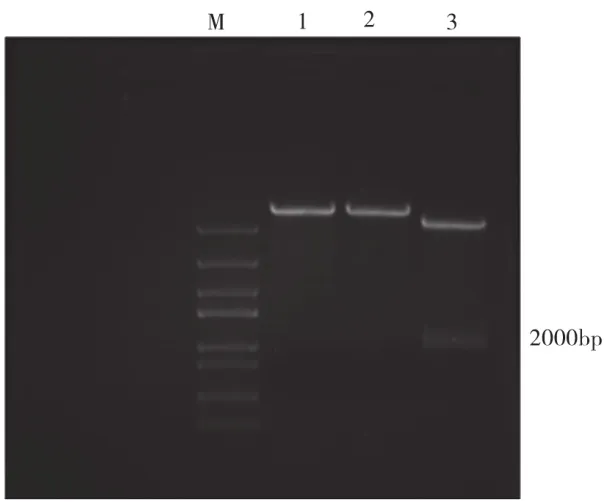
图2 淀粉酶表达载体单双酶切电泳验证图
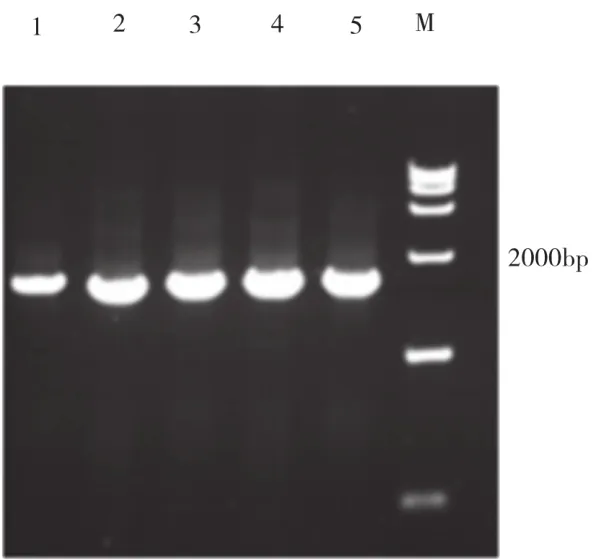
图3 PCR检测淀粉酶重组质粒
3.3 重组载体在大肠杆菌中的表达与纯化
重组载体pET48-1在大肠杆菌E.coliBL21(DE3)中表达、纯化后,经SDS-PAGE验证分析,在分子量约为72kD处有明显的特异条带,如图4所示。
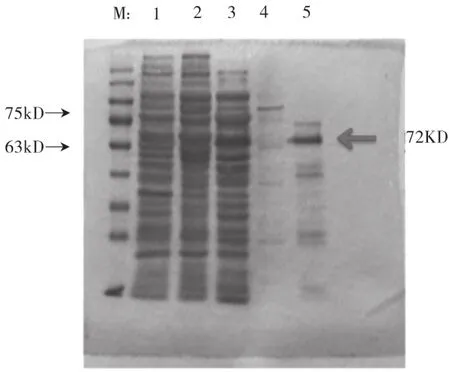
图4 SDS-PAGE电泳检测淀粉酶的表达
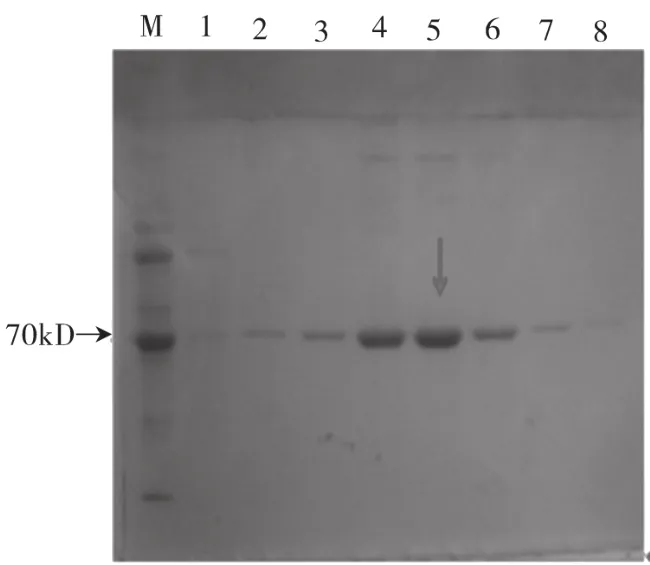
图5 蛋白纯化效果示意图
3.4 重组淀粉酶活性
经初步测定,采用DNS试剂法进行测定,通过对葡萄糖绘制吸光度-浓度曲线,37℃,pH7.0测定表达后结果显示重组蛋白量较高,淀粉酶活力约为1700U/mL,相比于初始菌株酶活力扩大10倍以上。
4 结论
根据文献报道,枯草芽孢杆菌可从产蛋白酶和产淀粉酶微生物中发现[9],本课题中结果也以此一致,本研究从烤烟叶片中取样筛选鉴定出高产淀粉酶的菌株,以产淀粉酶菌株的基因组DNA为模板进行基因克隆及异源高效表达,解决了酶产量偏低、酶活性不高等问题,将为以后规模化、工业化生产高品质烟叶奠定坚实的基础。
据研究,利用酶法降解烤烟内淀粉含量的方法中,所采用的酶大多为外源酶[10]。本研究结果从烟叶本身能得到重组淀粉酶高效表达,随之降解烟叶中淀粉,其优越性在于淀粉来源于烟叶本身,这样不但改善了烟叶的品质,人们吸食的安全性也得到足够的保障。后续,将针对所筛选的产淀粉酶微生物进行发酵条件优化、深入重组淀粉酶酶学性质研究等工作,将来为淀粉酶规模化、工业化应用于提高烟草制品的品质提供了有力依据。
[1]王怀珠,杨焕文,郭红英.烘烤过程中不同成熟度烟叶淀粉的降解动态[J].烟草科技,2004,10(5):36.
[2]姚光明,阎克玉,李晓,等.烤烟中残留淀粉的酶降解研究[J].郑州轻工业学院学报(自然科学版),2000,15(3):25-27.
[3]李晓,刘风珠,姜凌,等.淀粉类酶在烟叶中降解条件的研究[J].生物技术,2001,11(2):44-46.
[4]王怀珠,杨焕文,郭红英.烘烤过程中外加淀粉类酶对烤烟淀粉降解的影响[J].生物技术,2004,14(5):67-69.
[5]李晓,刘风珠,姜凌,等.淀粉类酶在烤烟中降解条件的研究[J].生物技术,2001,11(12):44-46.
[6]布坎R.E.,吉本斯NE.伯杰氏细菌鉴定手册[M].8版.北京:科学出版社,1984
[7]潘涛.一株酸α-淀粉酶产生菌的筛选,发酵条件及基因克隆研究[D].郑州:河南工业大学,2010.
[8]Nanmori T, Nagai M, Shimizu Y, et al. Cloning of the Beta-amylase Gene from Bacillus Cereus and Characteristic of the Primary Structure of the Enzyme[J].Applied and Environmental Microbiolo gy,1993,59(2):623-627.
[9]姚光明.降低烟叶中蛋白质含量的研究[J].烟草科技,2000,148(9):6-8.
[10]樊文举,高娟娟,张建新.外源酶制剂对烤烟烟叶化学品质的影响[J].福建农业学报,2017,32(6):652-659.
