对无菌生产洁净环境验证与监控的讨论
2018-07-09陈王露陈青青孙志勇汪霄峰戴志芳
陈王露,陈青青,孙志勇,汪霄峰,戴志芳
(浙江惠迪森药业有限公司,浙江杭州 311400)
药品作为一种特殊的商品,需要通过各种控制手段确保其有效性、稳定性和安全性。在药品有效性的前提下,安全性是至关重要的,对于无菌药品,无菌性是影响药品安全性的关键控制指标。无菌性的保障需要从整个生产过程进行全程控制,包括人员、设备、物料、环境、程序方法建立无菌控制策略。本文从环境控制策略角度来分别阐述无菌药品生产的洁净环境的验证和日常监控的流程和关键控制点。
HVAC系统通过空气净化过滤单元,去除空气中的微粒子、细菌,从而达到药品生产所需的环境。HVAC系统的组成包括洁净气体处理单元、热源、冷源等多个部分组成,如图1所示[1]。
1 洁净环境的验证
洁净厂房与空调净化系统验证和其他设备和设施的验证一样,客户需要在概念设计阶段提出书面的用户需求说明,并在项目设计、施工、调试验收过程中不断审核及更新。
供应商根据用户需求说明和详细的调研进行系统设计,再根据用户需求说明、技术文件、设计院施工图、二次深化设计图纸和相关施工说明文件进行设计确认,设计确认的形式多样化并不固定,会议纪要、参数计算书、技术交流记录、邮件等都是设计需确认的证明文件。设计确认一般包括对用户需求说明的审核确认和对GMP要求的符合确认。设计确认是一个动态的过程,应随着设计文件的不断澄清和细化逐渐深入进行[2]。
建设项目竣工后进行安装确认,目的在于检查并证明洁净厂房与空调净化系统中各组件自身以及装备关系、装配结果符合用户需求说明和施工设计文件的规定,如果在建设过程中在任何项目更改了原设计文件中所规定的指标,应有设计变更的批准文件。本文重点将对洁净厂房的运行确认和性能确认进行详细的描述。
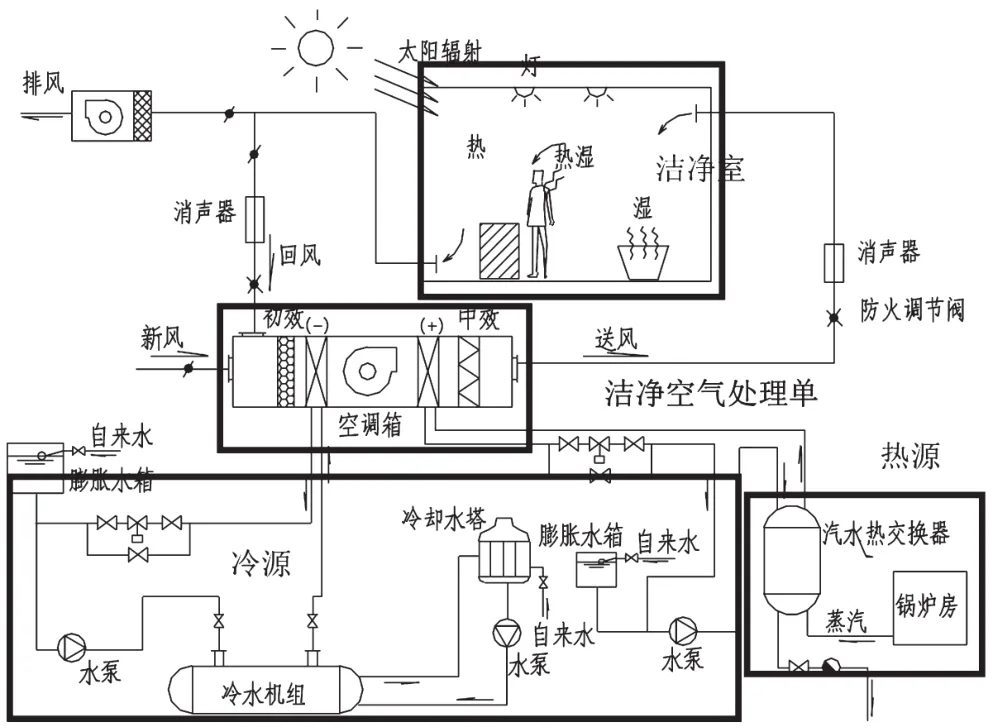
图1 HVAC系统的组成
1.1 运行确认
在运行确认之前,需草拟出洁净厂房和空调净化系统的标准操作规程,测试过程中使用到的仪器应满足仪器校准合格要求。
运行确认开始需要检查相关文件是否符合要求,包括安装确认是否完毕,文件是否已经审批结束;草拟的SOP是否已经存在并已经批准;测试过程的SOP是否已经存在并执行。
运行确认的测试项目包括:(1)互锁门功能检查;(2)房间内照度测试,确认房间内的照度符合设计的要求;(3)房间内噪音的测试,确保房间内在静态和动态情况下符合设计的要求。
1.1.1 风量和换气次数测试
确认房间的换气次数和风量符合设计的要求。风量测试一般采用风量罩风速测试一体的测试仪,通过测试面风速,计算送风量。换气次数通过测试单位时间内的送风量,结合房间的体积计算换气次数。
房间换气次数按式(1)来计算:

式(1)中,n为房间换气次数(次/h),L1、L2、……Ln为房间n个高效送风口风量(m3/h),V为房间体积(m3)。对于含有层流的房间,在算定房间换气次数时房间体积应扣除层流体积。
1.1.2 风速的测试
单向层流设备的风速应满足A级洁净区风速的要求。新版GMF附录1《无菌药品》中规定,A级为高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应用单向流操作台(罩)维持该区的环境状态;单向流系统在其工作区域必须均匀送风,风速为0.36~0.54 m/s(指导值),应有数据证明单向流的状态并经过验证[3]。
风速的测试项目和气流流型测试应该互相结合和验证,保证工作区域在一定风速的要求下,气流流型符合单向流的要求,一般可以用烟雾实验录像来证明。
风速的测试还包括了风速的均匀性要求,送风均匀性不好的单向流洁净区需要更高的送风速度才能维持所需求的洁净度,从而增加运行能耗。
风速测试的方法为主过滤器或扩散板下游100 mm处的平面的面积分成不得少于十二等分的面积,各面积中心点即为风速测点(见图2风速测试点)。但各测点间距不应大于25 cm。将各测点风速值计算出截面风速算术平均值:

风速均匀率按式(3)计算:

式中,p为风速的均匀率(%);Vmin/max为测点中最大或者最小风速(m/s);Var为风口处测得的平均风速(m/s)。

图2 风速测试点
1.1.3 房间压差测试
确认每个房间和外界的压差,与相邻或者相隔房间的压差符合设计和GMP的要求。一般使用离线的压差计或在线的HVAC自控系统进行确认。
1.1.4 温湿度测试
确保每个房间在静态和动态情况下温湿度符合设计的要求。目前,GMP并没有对房间的温湿度要求作出明确的规定,一般结合产品的生产工艺和人员的舒适度,尽量减少污染、交叉污染的可能性。
1.1.5 高效过滤器完整性检测
过滤器主体、过滤器边框以及安装边框必须保证密闭完好,防止任何微粒通过旁路泄露到下游。
高效过滤器的完整性测试一般采用计数器测试法和气浓胶光度计法,目前气浓胶法的应用比较普遍。在过滤器的上游释放PAO气浓胶烟雾,上游浓度一般保持在20~80 mg/m3,在下游通过光度计的采样头以一定的速度逐行扫描过滤器的主体和边框的穿透出的PAO气浓胶的浓度,采样头的扫描速度应根据采样头尺寸确定。H14的过滤器要求主体泄漏率≤0.005%,边框泄漏率≤0.01%。
1.1.6 气流流型的测试
对于乱流的洁净室,气流流型应该明确标识出房间的气流从出风口送出,经过房间的乱流形式,最终从回风口离开房间的整体趋势。
对于单向流的设备,气流流型需要明确的显示出单向流的形态:气流方向为直线型,各点风速均匀,没有死角和湍流。
气流流型一般采用烟雾发生器在出风口进行发烟,观察气流流型,并用摄像机对过程进行摄像,刻录光盘后和验证文件一起存档。
1.1.7 洁净级别的确认
根据中国2010版GMP无菌附录的要求,不同的生产工艺需要在相应的洁净级别中进行,洁净级别分为4个等级。(1)A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。单向流系统在其工作区域必须均匀送风,风速为0.36~0.54m/s(指导值);应当有数据证明单向流的状态并经过验证;在密闭的隔离操作器或手套箱内,可使用较低的风速。(2)B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。(3)C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。各级别空气悬浮粒子的标准规定见表1。

表1 各级别空气悬浮粒子的标准规定
运行确认中的洁净级别确认应该在静态条件下进行,按照ISO-14644-1中的详细流程进行洁净级别的确认,检测结果应该符合各级别的粒子标准要求[4]。
1.1.8 自净时间测试
自净时间测试常用的方法为100∶1的自净时间测试法,也就是环境从动态转变为符合静态要求情况下所需要的时间。先通过发尘的方式把房间内的粒子浓度达到该房间静态级别粒子浓度的100倍,也就是动态级别的要求(除D级区以外),然后通过房间内空调系统的空气置换,测试粒子浓度,计算粒子浓度下降100倍所需要的时间,即为该房间的自净时间。自净时间的结果可以用于日常环境控制的一个重要数据来源。
1.2 性能确认
性能确认一般包括静态和动态两种状态下的测试,一般由客户自己执行。
静态测试过程中,除了空调系统、设备层流系统开启外,其他的设备均已安装就绪,但没有生产活动且无人操作的房间状态,考虑测试和调试人员,一般要求一个房间内的人员不能超过两个。静态测试前,已经确认空调系统的运行模式,空调系统的操作程序已经获得批准并且执行,OQ已经完成并完成问题的整改和文件的审批。
动态测试在静态测试完成后,连续进行动态测试,动态测试过程中需要有生产活动,可以是模拟的生产活动,房间内按照正常最大人数的操作人员进行安排,必要时可以和培养基灌装验证同步进行动态测试。
性能确认的内容包括压差测试、温湿度测试、悬浮粒子测试、微生物项目的测试。微生物的监测项目包括接触碟、沉降菌、浮游菌。悬浮粒子和微生物的监测取样点应该结合风险评估确认最差条件的取样点进行监测[5]。
2 环境的日常监控
环境的日常监测在环境性能确认动态测试后开始进行,结果同时可以作为洁净厂房的定期回顾性验证。日常环境监控策略中需要包括监测点、监测频率、监测方法、监测标准、监测结果的处理等关键内容。
2.1 监测点确认
按照中国2010版GMP的要求,日常环境监测点的确认需要结合风险评估来确定,一般包括采用性能确认时的最差点、结合工艺评估的风险最高点确定日常监测的采样点数量,同时需要考虑厂房设施、生产线的设定、生产工艺、历史数据、测试方法等。测试点不能更多地增加生产的污染风险,在确定取样点时可以考虑以下问题:(1)在哪些点最有可能造成微生物的污染(包括生产活动的频率、清洁消毒最不能覆盖的地方等因素);(2)取样点在生产过程中最有可能发生最严重的微生物污染的繁殖;(3)什么样的活动会导致污染的扩散。
2.2 监测频率确认
关于监测频率,中国2010版GMP中有如下的规定,(1)在关键操作的全过程中,包括设备组装操作,应当对A级洁净区进行悬浮粒子监测。生产过程中的污染(如活生物、放射危害)可能损坏尘埃粒子计数器时,应在设备调试操作和模拟操作期间进行测试。A级洁净区监测的频率及取样量,应能及时发现所有人为干预、偶发事件及任何系统的损坏。灌装或分装时,由于产品本身产生粒子或液滴,允许灌装点≥5.0 μm的悬浮粒子出现不符合标准的情况。(2)在B级洁净区可采用与A级洁净区相似的监测系统。可根据B级洁净区对相邻A级洁净区的影响程度,调整采样频率和采样量。
除了法律的规定以外,公司可以参考相关的指导原则来确定取样频率,从风险分析的角度考虑,根据洁净区的重要性来确定。同时结合趋势分析回顾来评估取样频率的合理性,以保证监测行为的有效性。
2.3 监测方法
监测可以按照ISO14644中详细的测试标准流程进行。悬浮粒子的监测方式包括离线监测和在线监测,采用标准的粒子计数器进行监测。粒子监测需要采用等动力学探头,避免采样对周围的气流流型造成影响,或者造成粒子在管路内的沉积。
浮游菌采用浮游菌采样仪进行监测,一般采用直径90 mm的培养皿培养,采样方式包括了夹缝式和撞击式采样。沉降菌的采样方式为被动式,将90 mm直径的培养皿暴露在工作台面,监测4 h,培养观察监测结果。
表面微生物监测的方法一般包括直接擦拭法(适用于平整易清洁消毒的表面)、棉签擦拭法(适用于非平整的表面)、表面冲洗法(一般适用于不能被擦拭到的表面,如管路、罐体等)。
2.4 监测标准
监测的标准一般包括法定限度、行动限度和警戒限度。法定限度是根据国际标准、GMP等要求建立。行动限度根据历史数据以及环境的风险评估来制定,由企业自己建立,但不得高于标准限,一般可以参考历史数据平均值的3倍或6倍相对标准偏差来制定。警戒限度根据历史数据以及环境的风险评估来制定,由企业自己建立,但是不得高于行动限,一般可以参考历史数据平均值加2倍或者3倍相对标准偏差来制定。行动线和警戒线不是固定不变的,应该根据具体的情况进行调整,如季度或者年度的监控结果趋势分析。
对监测标准的设定有以下几点注意事项:(1)在没有大数据库的情况下,行动限和标准限设置可以是一致,但需要定期的回顾其合理性;(2)警戒线可以设置为行动限的一半,但需要对年度的数据进行回顾,参考UCL值来进行评估警戒线的合理性;(3)A级区微生物监测标准为<1,代表不得检出菌,如果检出,需要对产品进行调查和严格的评估;(4)A级送风环境应符合静态A级标准,动态应根据生产环境的性质制定动态的相应标准;(5)微生物限度法规只有动态监测的标准,需要根据企业生产环境的要求建立自身的静态标准;(6)每个限度都是有单位的,制定标准时需要和采样量、单位一并考虑。
2.5 监测结果的处理
对于日常环境监测的数据需要进行及时的统计,并定期进行趋势分析和结果分析,趋势分析的结果用于分析监测频率、监测标准的合理性。监测结果一般出现超过行动线,或者一日多点或者单点多日连续超过警戒线时,需要启动原因调查,并制定合理的纠正措施,如有必要需要增加预防措施。
调查超标原因时一般需要从人机料法环各方面进行调查,对相应的超标菌需要进行鉴别,并且需要对纠偏措施进行回顾,评估其有效性[6],并对该超标结果造成的对产品的影响进行评估。
3 结语
本文论述了洁净厂房的验证过程以及日常环境监测的基本制定策略,洁净环境是确保无菌产品生产的重要影响因素。在制药技术发展的同时,企业应该更加关注国内外的各种GMP的法规、标准、指南中对洁净厂房和空调系统的要求的不断更新。
制药企业也可以尝试更加先进的监测和控制技术,例如在线粒子监测、在线微生物监测、HVAC自动控制系统(EMS和BMS)等。有利于更好地控制无菌产品生产的洁净环境,并快速和准确的获得监控的结果[7]。
[1]陆亚俊.暖通空调[M].建筑工业出版社,2005:25-60.
[2]何国强.制药工艺验证实施手册[M].北京:化学工业出版社,2012:50-75.
[3]国家药品监督管理局.药品生产质量管理规范(2010年修订)[Z].卫生部令第79号,2011.
[4]ISO 14644 Cleanrooms and associated controlled environments,Biocontamination control[S].Switzerland:ISO,2015.
[5]ISO 14698 Cleanrooms and associated controlled environments[E].Switzerland:ISO,2015.
[6]范一灵.无菌药品生产企业核心区微生物污染调查与分析[J].中国药事,2014,6(2):586-590.
[7]崔菊霞.无菌操作技术在无菌制剂生产中的应用[J].中国药事,2013,27(2):158-162.
