桂枝茯苓胶囊对放置宫内节育器模型大鼠血液流变学的调控及子宫平滑肌细胞表型蛋白表达的影响
2018-07-09朱颖军岳秀英陈绍正
卢 颖,朱颖军,岳秀英,陈绍正,王 雄
1天津医科大学宝坻临床学院妇科,天津 301800 2天津中心妇产科医院普妇科,天津 300100 3天津医科大学宝坻临床学院超声科,天津 301800
放置宫内节育器(intrauterine device,IUD)避孕是世界范围内普遍使用的节育方法,中国约39.1%育龄期妇女选用IUD避孕,占全世界 IUD 避孕人数的 80%[1- 2]。IUD 避孕具有安全、有效、可逆等优势,但也存在非经期阴道出血、月经量多、经期延长等 IUD 出血(宫环出血)的不良反应,因此积极有效地避免和减少 IUD 出血,是目前急需解决的问题。IUD 出血的发生与血管结构和功能异常密切相关,而血管平滑肌细胞(vascular smooth muscle cells,VSMC)对子宫内膜血管所进行的表型调控逆转可能是导致本病的主要病理基础。桂枝茯苓胶囊由桂枝、茯苓、牡丹皮等中药组成,具有活血化瘀、缓消癥块的功效。研究显示,桂枝茯苓胶囊可通过改善子宫血管血液的黏滞性和血液动力学,改善微循环,从而改善大鼠子宫内膜局部瘀血状态[3]。本研究以 IUD 避孕大鼠为研究对象,观察了桂枝茯苓胶囊对IUD模型大鼠子宫VSMC表型标志物α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表型蛋白及外周血血栓素B2(thromboxane B2,TXB2)和6-酮-前列腺素F1α(6-keto-prostaglandinF1α,6-keto-PGF1α)浓度的影响。
材料和方法
试剂和仪器桂枝茯苓胶囊流浸膏:桂枝茯苓胶囊(成分相同)(0.31 g/ml,江苏康缘药业股份有限公司,国药准字 Z10950005),用量按成人与大鼠等效用量换算而成;氨基己酸片(0.5 g/片,浙江康乐药业股份有限公司,国药准字H11020560),配制成浓度为0.5 mg/ml 的药液备用;注射用青霉素钠(80万U/支,山东鲁抗医药股份有限公司,批号P0006306);甲硝唑注射液(100 ml/瓶,江苏正大天晴药业股份有限公司,批号01063945);无水乙醇(上海科丰化学试剂有限公司),二甲苯(天津市福晨化学试剂厂),戊巴比妥钠、中性甲醛(上海医药集团试剂公司)。SP试剂盒(美国Beckman Coulter公司),TXB2、6-keto-PGF1α、内皮素- 1(endothelin- 1,ET- 1),ELISA检测试剂盒(上海一研生物科技有限公司)。碘伏消毒液(山东利尔康消毒科技有限公司),组织剪、线剪、眼科剪,眼科直镊、组织钳、止血钳、持针器、注射器、灭菌缝合针、外科丝线(杭州华威医疗用品有限公司),TCU220IUD(江苏无锡市医疗器械有限公司,型号:30 mm,消毒批号:2016111456);TES99石蜡包埋机、BM2135 石蜡切片机(德国MEDITE公司),KD-PⅢ生物组织摊片机(浙江金华科迪仪器设备有限公司),HPIAS- 1000彩色病理图文分析系统(武汉同济医科大学千屏影像工程公司),BS- 224s 电子天平(德国Sartorius公司),Axiovert 200光学显微镜(德国ZEISS公司),超低温冰箱700(美国 Thermo Forma公司),超净工作台 JK001(安徽无尘净化有限公司),电热鼓风干燥机DHG- 9003(北京中科环试仪器有限公司),ASP300S全封闭自动脱水机(德国LEICA公司)。
实验动物及分组SPF级Wistar 雌性大鼠84只,体质量180~220 g,购自北京维通利华试验动物技术有限公司,动物许可证号:SCXK(京)2016- 0006,置于室温18℃~26℃,相对湿度40%~70%的条件下喂养,饲鼠所用颗粒饲料由天津中医药大学实验动物中心提供。采用随机数字表法随机分为正常组(n=17)和造模组(n=67):正常组正常饲养不作处理;造模组采用3%戊巴比妥钠(40 mg/kg)腹腔麻醉,取下腹正中切口暴露并固定子宫,于双侧子宫近卵巢端各剪一小口,将改造后的IUD(结合大鼠子宫生理特点将IUD剪去上半部分的T型,保留下端一孔棒状部分,含2节铜环,长1 cm)分别置于子宫中段,并固定于子宫壁,缝合切口,甲硝唑注射液5 ml腹腔冲洗后逐层关腹,术后青霉素2万U肌注3 d预防感染。饲养过程中正常组1只丢失(饲养过程中正常组体质量168 g不符合实验标准剔除1只),造模结束时正常组共16只;造模组丢失2只(造模过程中由于术中操作IUD放置失败剔除1只,造模结束时IUD脱落,剔除1只),意外死亡6只(因麻醉剂过量),共59只。造模结束后造模组59只大鼠再随机分为3组:(1)模型对照组(n=21):建模3 d后灌服0.9%生理盐水90 mg/(kg·d),连续4周;(2)桂枝茯苓胶囊组(n=19):建模3d后灌服桂枝茯苓流浸膏18.6 mg/(kg·d)(含药量1.85 mg/ml),连续4周;(3)氨基己酸片组(n=19):建模3 d后灌服氨基己酸片溶液100 mg/(kg·d)(含药量10 mg/ml),连续4周。灌胃结束时大鼠死亡6只,灌胃第1天因插管错误死亡2只,药液误入气管死亡3只,灌胃第4周末因连续灌胃用药时间长死亡1只,剩余正常组16只,模型对照组18只,桂枝茯苓胶囊组18只,氨基己酸片组17只。
大鼠子宫内膜α-SMA和PCNA表达的检测采用SP免疫组织化学法,于灌胃第5周颈椎脱臼法处死大鼠,取大鼠 IUD 接触区子宫组织,将 IUD 取出(未放置 IUD各组剪取相对应子宫组织)迅速放入中性甲醛溶液中固定,将标本用石蜡包埋后切片。将切片脱蜡水化后用0.3% H2O2甲醇处理切片水洗,PBS洗3次,加血清孵10 min后,PBS清洗3次后,加入PR单抗后置于湿盒中4℃放置过夜;PBS洗2次,加入SP复合物孵育20~30 min,再次PBS洗3次后,加入辣根酶标记的链霉卵白素孵于37℃孵育10~30 min,PBS洗3次,再予以Harris苏木素复染5~10 min,水洗分化,蓝化,脱水封片。结果判定:取切片中血管阳性细胞较多的区域→物镜为20倍光学显微镜(每片采集3个光镜视野)→输入计算机彩色病理图文分析系统→选择相应的参数→计算机完全定量分析→计算每张切片阳性细胞百分比含量,即:阳性目标总面积/统计场总面积(面密度)÷[阴性目标总面积统计场总面积(面密度)+阳性目标总面积/统计场总面积(面密度)]。
大鼠外周血TXB2和6-keto-PGF1α浓度的测定于灌胃第5周清晨禁食,将大鼠麻醉固定后,经心脏取血4~5 ml,抗凝,3000 r/min(r=10 cm)离心10 min,取上清液分装,置于-80℃以下保存。采用ELISA法检测血TXB2和6-keto-PGF1α浓度。
统计学处理采用SPSS 22.0统计软件,计量资料以均数±标准差表示,组间用药前后差异比较采用t检验和方差分析,P<0.05为差异有统计学意义。
结 果
造模情况术后1周后,随机选取模型对照组12只大鼠分为4笼饲养,每笼3只,每笼放入1只雄性大鼠共同饲养。第5周处死观察,结果显示12只大鼠无1只怀孕,仅1只大鼠IUD下移;取出的IUD表面光滑,无锈蚀现象;子宫组织外观基本正常,无明显脓肿、坏死。
各组大鼠子宫内膜中α-SMA的表达情况正常组、模型对照组、桂枝茯苓胶囊组和氨基己酸片组大鼠子宫内膜α-SMA的阳性表达率分别为(50.89±9.41)%、(26.93±6.80)%、(48.92±6.80)%和(34.63±7.26)%,其中,正常组(t=14.43,P=0.00)和桂枝茯苓胶囊组(t=11.37,P=0.00)明显高于模型对照组,正常组与桂枝茯苓胶囊组间差异无统计学意义(t=0.79,P=0.62),氨基己酸片组明显低于正常组(t=9.96,P=0.00)和桂枝茯苓胶囊组(t=8.23,P=0.00)(图1)。
各组大鼠子宫内膜中PCNA的表达情况正常组、模型对照组、桂枝茯苓胶囊组和氨基己酸片组大鼠子宫内膜中PCNA的阳性表达率分别为(25.66±7.24)%、(61.26±9.98)%、(28.36±9.17)%和(50.23±8.71)%,其中,正常组(t=20.86,P=0.00)和桂枝茯苓胶囊组(t=19.12,P=0.00)明显低于模型对照组,正常组和桂枝茯苓胶囊组间差异无统计学意义(t=1.13,P=0.52),氨基己酸片组明显高于正常组(t=17.82,P=0.00)和桂枝茯苓胶囊组(t=16.05,P=0.00)(图2)。
各组大鼠血清TXB2和6-keto-PGF1α浓度检测结果正常组、模型对照组、桂枝茯苓胶囊组和氨基己酸片组大鼠的血清TXB2浓度分别为(445.86±24.43)、(508.78±12.42)、(448.11±9.63)和(498.11±13.63)ng/L,其中,模型对照组明显高于正常组(t=16.55,P=0.00)和氨基己酸片组(t=-4.12,P=0.00),桂枝茯苓胶囊组与正常组间差异无统计学意义(t=1.24,P=0.37);桂枝茯苓胶囊组明显低于模型对照组(t=-15.23,P=0.00)和氨基己酸片组(t=-12.08,P=0.00)。正常组、模型对照组、桂枝茯苓胶囊组和氨基己酸片组大鼠的血清6-keto-PGF1α浓度分别为(23.17±1.93)、(18.09±0.93)、(22.70±1.61)和(20.70±1.41)ng/L,其中,模型对照组明显低于正常组(t=-13.98,P=0.00)和氨基己酸片组(t=5.26,P=0.00),桂枝茯苓胶囊组与正常组间差异无统计学意义(t=-1.12,P=0.42);桂枝茯苓胶囊组明显高于模型对照组(t=11.43,P=0.00)和氨基己酸片组(t=8.76,P=0.00)。
讨 论
育龄妇女子宫放置 IUD后,会造成子宫内膜各种血管活性物质及血管内皮生长因子的异常,导致子宫内膜和血管发育不良、功能异常,引起子宫异常出血[3]。桂枝茯苓胶囊由桂枝、茯苓、丹皮、赤芍、桃仁等中药组成,具有活血化瘀、缓消癥块之功效,能够有效改善血液流变作用,同时通过减轻内膜形态学损伤,消除子宫血管构筑异常,防治 IUD 出血不良反应,其中消除子宫血管构筑异常是其作用的重要靶点。祖国医学认为,实验IUD模型大鼠子宫内膜因金刃内伤、瘀血内阻、血不循经,而致宫环出血,瘀久化热聚而生湿,故除了活血化瘀的桃仁、赤芍等药物外,还有温通经脉的桂枝、凉血清热的丹皮和健脾利湿的茯苓以协同奏效,故而桂枝茯苓胶囊可通过改善子宫血管血液的黏滞性、血液动力学,改善微循环,从而达到改善大鼠子宫内膜局部瘀血状态目的[4]。有临床及实验研究证明,活血化瘀中药能降低血液黏稠度,改善血液流变学指标,促进血液循环[5]。蒋时红等[6]研究显示,实验大鼠模型服用桂枝茯苓胶囊混悬液后,全血黏度(高切、低切)、血浆黏度(比)和红细胞压积均降低。TXA2具强有力的血小板聚集作用,前列环素(prostacyclin,PGI2)具强力的舒张血管和抑制TXA2对血小板的聚集作用。在生理情况下循环血液中TXA2/PGI2浓度处于相对动态平衡,对维持血管张力、血流量调节和组织灌注起重要作用[7]。本研究结果显示,正常组和模型对照组大鼠的血清TXB2和6-keto-PGF1α浓度均有显著差异,桂枝茯苓胶囊组大鼠血清TXB2浓度明显低于模型对照组和氨基己酸片组,6-keto-PGF1α浓度则明显高于模型对照组和氨基己酸片组,正常组和桂枝茯苓胶囊组大鼠血清TXB2和6-keto-PGF1α浓度无明显差异,提示桂枝茯苓胶囊能有效改善大鼠子宫瘀血状态。

A.正常组;B.模型对照组;C.桂枝茯苓胶囊组;D.氨基己酸片组
A.normal group;B.model group;C.Gui Zhi Fu Ling Jiao Nang group;D.aminocaproic acid tablets group
图1给药后第5周子宫内膜α-平滑肌肌动蛋白免疫组织化学染色结果(×400)
Fig1Immunohistochemical staining of α-smooth muscle actin in endometrium at the fifth week after administration (×400)
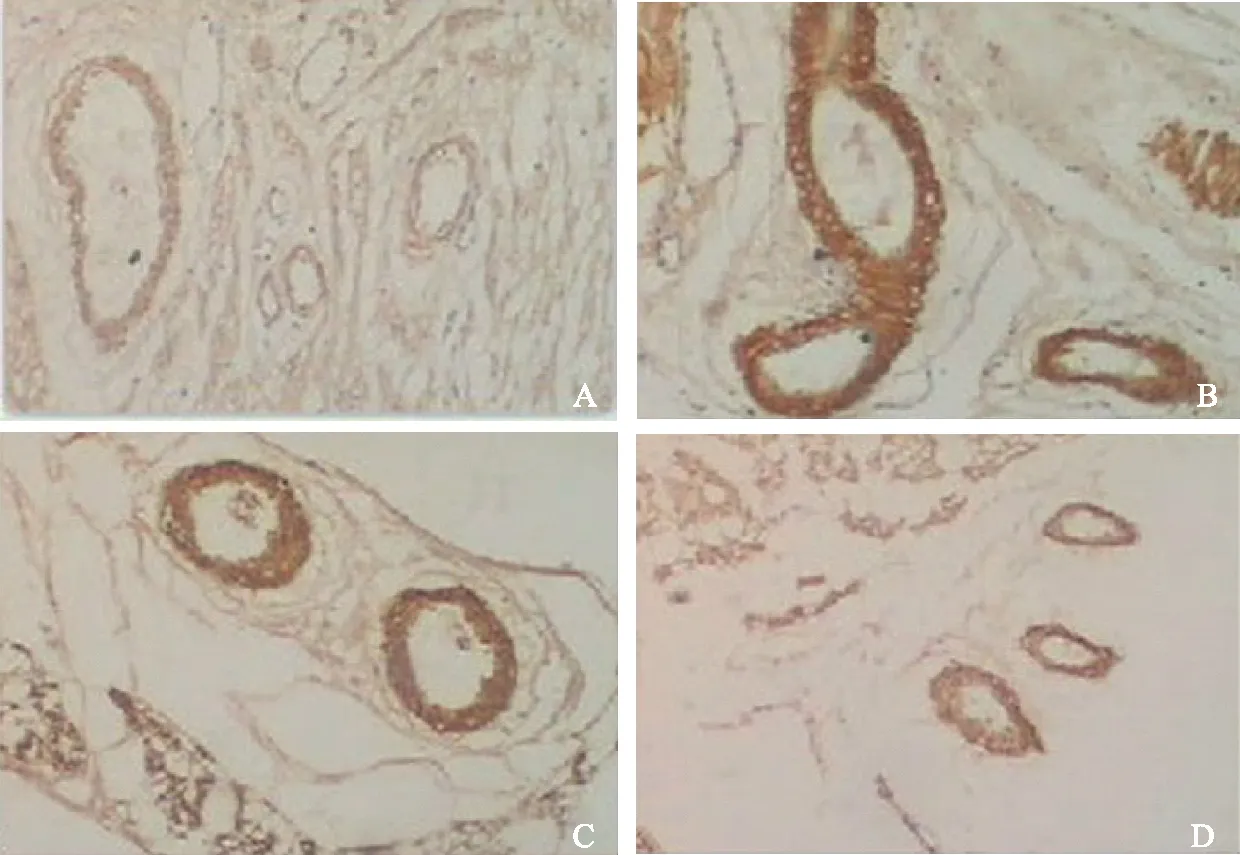
A.正常组;B.模型对照组;C.桂枝茯苓胶囊组;D.氨基己酸片组
A.normal group;B.model group;C.Gui Zhi Fu Ling Jiao Nang group;D.aminocaproic acid tablets group
图2给药后第5周子宫内膜增殖细胞核抗原免疫组织化学染色结果(×400)
Fig2Immunohistochemical staining of proliferating cell nuclear antigen in endometrium at the fifth week after administration (×400)
据临床文献报道,IUD出血的发生与血管结构和功能异常密切相关[8- 9]。放置IUD后,子宫内膜血管增生,密度增加,螺旋动脉在平面和三维空间结构中空间的扭曲程度增加,管径变细,血管呈团网状迂曲走行,螺旋状盘曲不均匀,导致血流速度减慢阻力增加,影响子宫内膜及血管的发育[10]。子宫内膜致密层不仅变薄且致密层与海绵层组织结构排列松散,窦样毛细血管与螺旋动脉扩张充血明显,导致异常子宫内膜出血[11]。因此,子宫内膜血管的表型调控逆转被认为可能是导致本病的主要病理基础,PCNA是VSMC细胞增殖的核心因素,是评价细胞增殖状态的直接、可靠的指标[12]。处于收缩表型VSMC状态的 PCNA表达降低,而处于合成表型的VSMC对PCNA表达调控出现了失常,造成PCNA表达明显上调,引起细胞外基质大量合成及细胞过度增殖,导致血管内膜增厚,新生内膜增生及管腔狭窄的主要原因[13]。VSMC表达分化标志蛋白α-SMA可促进VSMC合成细胞外基质和表达SMA。切断传入神经,可使各种平滑肌组织生长减慢并丧失收缩能力[14],其表达下调是 VSMC表型从收缩型向合成型转化的最重要标志[15]。有研究表明,干扰VSMC 增殖、凋亡的平衡是影响血管重建的重要原因[16]。当血管受到损伤时,正常的 VSMC能够从收缩表型转变成合成表型,导致 VSMC大量增生[17- 19]。本研究结果显示,正常组和模型对照组大鼠的α-SMA和PNCA的阳性表达率均有显著差异,桂枝茯苓胶囊组大鼠PNCA的阳性表达率明显低于模型对照组和氨基己酸片组,α-SMA的阳性表达率明显高于模型对照组和氨基己酸片组,而正常组与桂枝茯苓胶囊组大鼠的α-SMA和PNCA阳性表达率无明显差异,推测其原因可能是由于桂枝茯苓胶囊抑制VSMC的增殖作用更明显,从而使受损的模型大鼠子宫内膜血管由病理性向正常状态逆转,减轻了模型组大鼠子宫内膜 VSMC的显微超微结构形态学损伤,改善大鼠子宫内膜局部瘀血状态,抑制细胞增殖状态,从而改善大鼠子宫内膜瘀血状态,达到调控模型组大鼠子宫血管由病理性向正常生理功能恢复的目的。
综上,本研究结果显示,桂枝茯苓胶囊可调控IUD 模型大鼠子宫内膜 VSMC 的α-SMA和PCNA 表达,调节血清TXB2和6-keto-PGF1α的浓度变化,有效改善IUD大鼠子宫瘀血状态,促进IUD大鼠子宫血管由病理性向正常生理功能的恢复。
[1] Zhang LF,Yang J,Hong Z,et al. Proportion of different subtypes of stroke in China[J].Stroke,2003,34(9):2091- 2096. DOI:10. 1161/01. STR. 0000087149. 42294. 8C.
[2] 王莉,杨素勉,李季滨,等. 瘢痕子宫放置吉妮致美IUD避孕临床效果研究[J].中国妇幼保健,2011,26(18):2783- 2784.
[3] 孙卫华,赵琳,田小平,等. 桂枝茯苓胶囊治疗原发性痛经90例临床观察[J].中国中西医结合杂志,2004,24(12):1121-1123.DOI:10. 3321/j. issn:1003-5370. 2004. 12. 020.
[4] 岳恒学,师伟,刘瑞芬,等. 宫内节育器出血不良反应发病机制的研究现状[J].山东中医杂志,2012(10):767- 769. DOI:10. 16295/j. cnki. 0257- 358x. 2012. 10.003.
[5] 王清波,李慧云,贾玉礼. 中药煎剂灌肠治疗慢性盆腔炎42例临床观察[J].工企医刊,2008,21(1):41- 42. DOI:10.3969/j. issn. 1001- 814X. 2008. 01. 036.
[6] 蒋时红,刘旺根,杨丽萍,等. 桂枝茯苓胶囊对大鼠乳腺增生病治疗作用的实验研究[J]. 中成药,2004,26(12):1040- 1042.DOI:10. 3969/j. issn. 1001- 1528. 2004. 12. 018.
[7] 〗张璇,胡长林. 疏血通注射液对脑梗死患者TXB_2及6- Keto-PGF1a的影响[J].临床医药实践,2005,14(5):336- 337. DOI:10. 3969/j. issn. 1671- 8631. 2005. 05. 005.
[8] 刘瑞芬,栾跃芳,李继风. 宫宁颗粒剂治疗使用宫内节育器出血副反应的临床研究[J].中医杂志,1998(5):292- 294. DOI:10. 13288/j. 11- 2166/r. 1998. 05. 026.
[9] 师伟,徐丽,陈磊. 宫宁颗粒对放置宫内节育器大鼠模型子宫血管构筑的影响[J].中华临床医师杂志:电子版,2007,1(6):23- 26. DOI:10. 3969/j. issn. 1674- 0785. 2007. 06. 009.
[10] 黄丽丽,陈凌钧. 放置宫内节育器后子宫内膜螺旋动脉的三维空间形态[J].中华妇产科杂志,1996,31(9):523- 525.
[11] 刘志成,陈湫波,倪秀生. 放置γCuI和TCu 220C宫内节育器前后子宫内膜螺旋动脉形态计量学研究[J].中华妇产科杂志,1998,4(4):232- 234. DOI:10. 3760/j. issn:0529- 567X. 1998. 04. 012.
[12] 车贤达,梁西蒙,高瑞兰,等. 麝香保心丸对血管平滑肌细胞表型转化的影响[J].中国病理生理杂志,2010,26(11):2149- 2154. DOI:10. 3969/j. issn. 1000- 4718. 2010. 11. 013.
[13] Fukuda N,Hu WY,Satoh C,et al. Contribution of synthetic phenotype on the enhanced angiotensin II-generating system in vascular smooth muscle cells from spontaneously hypertensive rats[J]. J Hypertens,1999,17(8):1099- 1107.
[14] Tokunou T,Shibata R,Kai H,et al. Apoptosis induced by inhibition of cyclic AMP response element-binding protein in vascular smooth muscle cells[J].Circulation,2003,108(10):1246- 1252. DOI:10. 1161/01. CIR. 0000085164. 13439. 89.
[15] Li X,Van Putten V,Zarinetchi F,et al. Suppression of smooth-muscle alpha-actin expression by platelet-derived growth factor in vascular smooth-muscle cells involves Ras and cytosolic phospholipase A2[J].Biochem J,1997,327(Pt3):709- 716.
[16] Rensen SS,Doevendans PA,van Eys GJ. Regulation and characteristics of vascular smooth muscle cell phenotypic diversity[J].Neth Heart J,2007,15(3):100- 108.
[17] Hao H,Gabbiani G,Bochaton-Piallat ML. Arterial smooth muscle cell heterogeneity:implications for atherosclerosis and restenosis development[J].Arterioscler Thromb Vas Biol,2003,23(9):1510- 1520. DOI:10. 1161/01. ATV. 0000090130. 85752. ED.
[18] Owens GK,Kumar MS,Wamhoff BR. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J].Physiol Rev,2004,84(3):767- 801. DOI:10. 1152/ physrev. 00041. 2003.
[19] Miano JM,Cserjesi P,Ligon KL,et al. Smooth muscle myosin heavy chain exclusively marks the smooth muscle lineage during mouse embryogenesis[J]. Circ Res,1994,75(5):803- 812.
