11例肺腺癌脑膜转移的综合治疗
2018-07-09李文郝学志席小明米玉玲李伟功王静北京市朝阳区三环肿瘤医院肿瘤内科北京0002
李文,郝学志,席小明,米玉玲,李伟功,王静北京市朝阳区三环肿瘤医院肿瘤内科,北京0002
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科,北京100021
肺癌是影响国民健康最常见的恶性肿瘤,发病率及病死率呈逐年上升趋势。根据肺癌病理类型不同分为小细胞肺癌和非小细胞肺癌,非小细胞肺癌包括鳞癌、腺癌和大细胞癌等。脑膜转移是肺癌最严重的并发症之一,患者预后极差,未接受治疗的患者中位生存期仅为4~6周[1],5%~18%的肺癌患者会发生脑膜转移,以腺癌和小细胞肺癌常见[2]。脑膜转移的患者缺乏标准、有效的治疗手段,目前常用的治疗方法包括鞘内注射化疗药物、靶向治疗、全脑放疗、全身化疗和脑室腹腔分流术等。本文回顾性分析11例肺腺癌脑膜转移患者的病历资料,现报道如下。
1 资料与方法
1.1 一般资料
收集2012年11月至2016年9月在北京市朝阳区三环肿瘤医院肺癌中心收治的11例肺腺癌脑膜转移患者的临床资料,所有患者均有肺原发肿瘤的影像学诊断,且病理学诊断均证实为腺癌,脑脊液脱落细胞学检查均发现癌细胞。其中男性7例,女性4例;年龄43~62岁,中位年龄52岁;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分1~2分。随访截止时间为2016年10月。单纯脑膜转移1例,脑膜转移合并脑外转移4例,同时合并脑实质及脑外转移6例,脑外转移部位包括双肺、肝脏、骨、肾上腺、胸膜、颈部及腹膜后淋巴结。确诊肺腺癌至出现脑膜转移的时间为0~63个月,中位时间为13个月。确诊脑膜转移前接受过根治性手术3例,接受过靶向治疗6例,接受过系统性全身化疗9例,化疗周期数为2~29个周期,中位周期数为10个周期,全身化疗药物包括培美曲塞、多西他赛、紫杉醇及长春新碱。2例表皮生长因子受体(epidermal growth factor receptor,EGFR)检测阳性的患者均为EGFR19号外显子突变,1例间变性淋巴瘤激酶(anaplasticlymphoma kinase,ALK)检测阳性患者采用荧光原位杂交(fluorescence in situ hybridization,FISH)检测方法,详见表1。
1.2 临床表现
11例患者均有头痛、恶心、呕吐等颅内压升高的表现。复视1例,视物模糊5例,脑膜刺激征(+)7例,乏力5例,进食呛咳1例,面部麻木、吞咽困难1例,癫痫发作2例,言语不清2例。
1.3 脑脊液检查
11例患者脑脊液脱落细胞学检查均发现癌细胞,脑脊液压力≥300 mmH2O(1 mmH2O=0.098 kPa)6例,脑脊液压力160~299 mmH2O 3例;11例患者中10例患者脑脊液氯化物均低于120 mmol/L(正常值为120~130 mmol/L);脑脊液蛋白增高4例(最高可达3018 mg/L);脑脊液葡萄糖降低4例(最低达0.83 mmol/L)。
1.4 治疗情况
11例患者均接受鞘内注射化疗药物治疗,10例患者诊断脑膜转移后接受靶向治疗(埃可替尼、吉非替尼、厄洛替尼、AZD9291、CT707及艾乐替尼),其中3例接受靶向治疗+替莫唑胺+西妥昔单抗/白蛋白紫杉醇治疗,1例仅接受靶向治疗+替莫唑胺治疗,3例先后接受靶向治疗及全身化疗,3例仅接受靶向治疗,详见表2。
1.5 疗效观察
观察患者治疗后临床症状的改善及脑脊液压力的改变;记录患者的总生存期(overall survival,OS),本研究总生存期定义为患者从确诊脑膜转至患者到死亡的时间。
1.6 统计学方法
采用SPSS 19.0统计软件进行数据分析。
2 结果
11例患者均在随访期间死亡,OS为1.4~26.0个月,中位OS为7.1个月。所有患者头痛、恶心、呕吐等颅内高压症状均有明显改善;5例乏力患者症状亦有不同程度改善;2例癫痫发作患者联合抗癫痫药物治疗,未再次出现癫痫发作;复视、视物模糊及吞咽困难等症状无明显改善。其中5例患者的脑脊液压力由≥300 mmH2O下降至≤180 mmH2O,脑脊液蛋白及葡萄糖无明显变化趋势。治疗前后患者脑脊液压力的变化及OS详见表3。
3 讨论
脑膜转移是晚期恶性肿瘤的一种严重并发症,病情发展迅速,死亡率高,如不进行积极治疗,脑膜转移患者的中位OS为4~6周,死亡原因多为与脑膜转移相关的进行性神经功能障碍和(或)全身肿瘤进展[2-3]。有效的治疗可以不同程度地稳定和(或)改善神经功能和症状,提高患者的生活质量,但即使接受包括放疗、鞘内注射化疗等传统的治疗方法,患者生存期仅延长至12~14周[4-5]。对于肺癌出现脑膜转移的诊断目前尚无统一的标准,主要依靠有明确的肺原发恶性肿瘤病史;出现多样性和多发性脑实质转移难以解释的神经系统症状和(或)体征;增强脑核磁表现的典型影像学特征;脑脊液中肿瘤标志物及脑脊液生化指标(包括蛋白质、氯化物及葡萄糖)水平的异常;脑脊液中发现癌细胞。诊断的金标准仍为在脑脊液中发现癌细胞,但阳性检出率低。本组11例患者脑脊液中均查到癌细胞,其中脑脊液蛋白增高者4例(36.36%),葡萄糖降低者4例(36.36%),氯化物降低者10例(90.91%)。上述脑脊液生化指标异常对于脑膜转移诊断有一定的提示意义,但缺乏特异性。
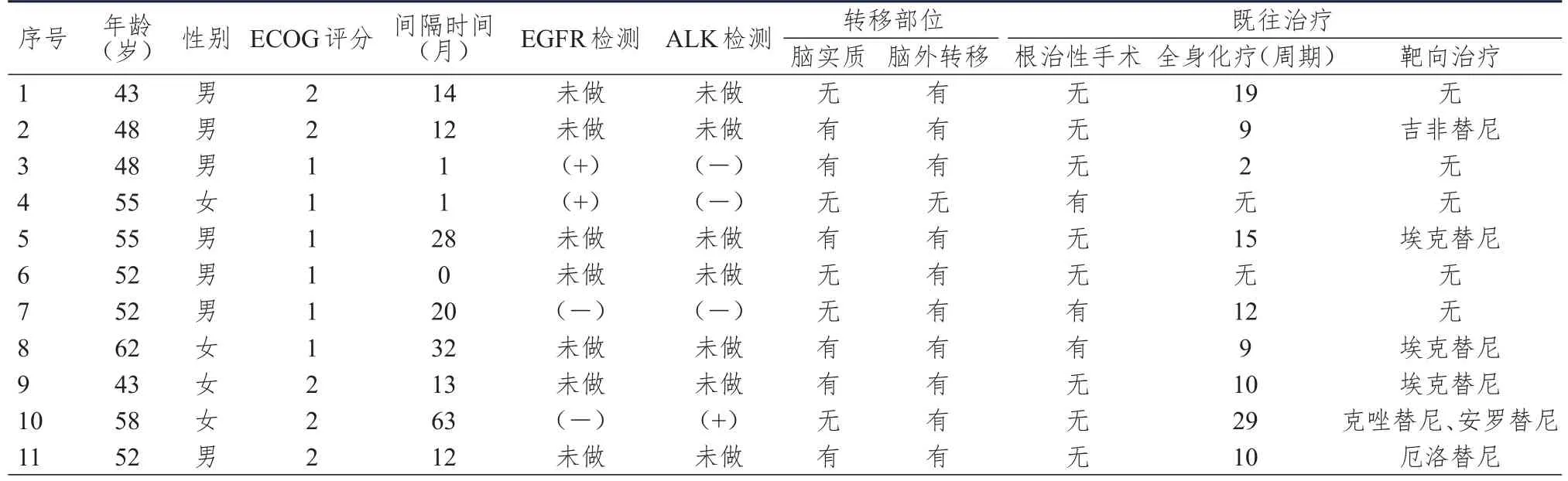
表1 11例肺腺癌脑膜转移患者的临床资料
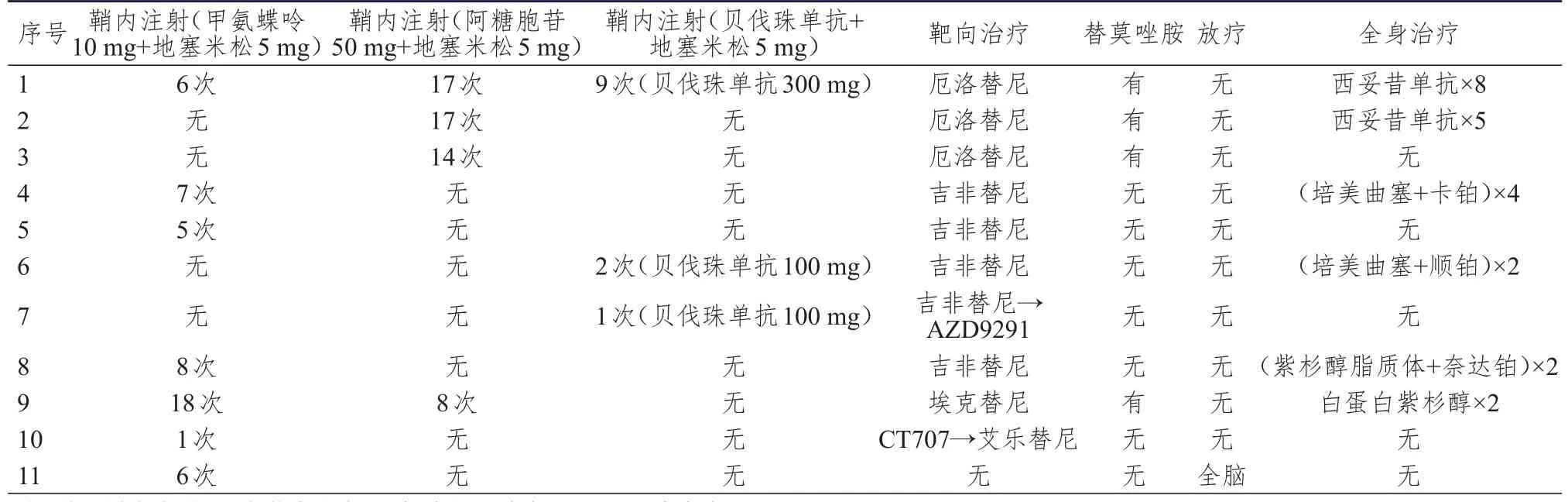
表2 11例肺腺癌脑膜转移患者的综合治疗情况
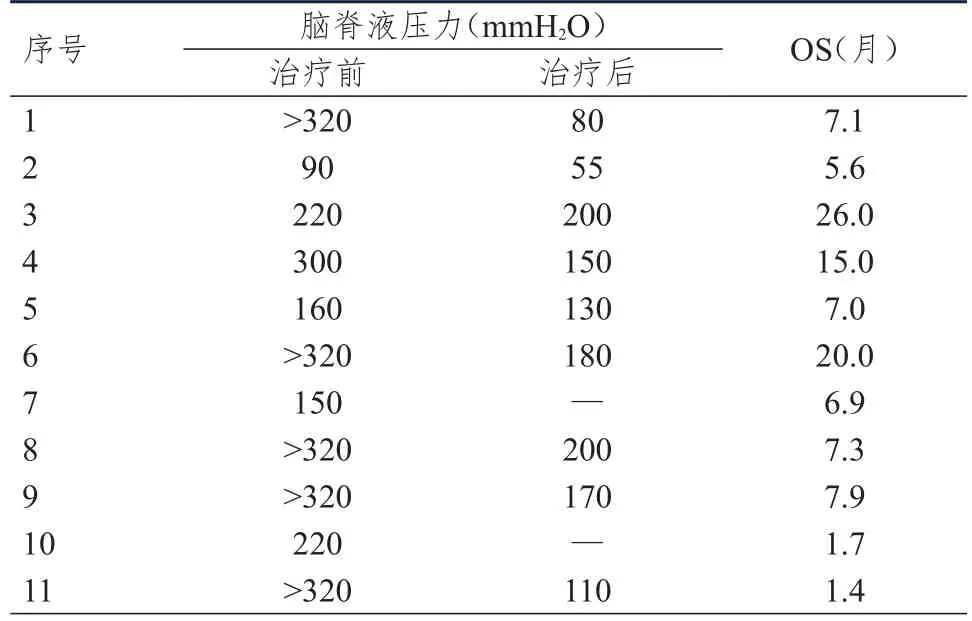
表3 11例患者治疗前后脑脊液压力变化及OS
鞘内注射化疗药物是治疗脑膜转移的主要措施之一,将药物直接注入蛛网膜下腔,提高局部药物的浓度,从而杀伤肿瘤细胞。常用于鞘内注射的药物包括甲氨蝶呤、阿糖胞苷、阿糖胞苷脂质体及塞替哌等,鞘内注射化疗药物同时给予鞘内注射糖皮质激素,可减轻化疗药物对神经系统的不良反应。行鞘内注射化疗可改善脑膜转移患者预后,但不同药物对于患者生存期的影响差异不明显[6]。贝伐珠单抗是一种抑制肿瘤新生血管生成和肿瘤生长的重组人源化IgG1单克隆抗体。贝伐珠单抗可与血管内皮生长因子(vascular endothelial growth factor,VEGF)结合,阻碍VEGF与其受体在内皮细胞表面相互作用,从而达到抑制肿瘤增殖或转移的目的。在最初的临床应用中,贝伐珠单抗被禁止用于脑转移患者,但在BRAIN研究中,贝伐珠单抗联合化疗或联合二线厄洛替尼治疗,对未经治疗的无症状脑转移非鳞癌非小细胞肺癌患者疗效良好,安全性可接受。且陆续有临床研究显示对贝伐珠单抗敏感的肺癌脑膜转移患者使用贝伐珠单抗治疗后,脑脊液VEGF下降水平与临床疗效呈正相关[7]。本研究中7例患者接受鞘内注射甲氨蝶呤治疗,4例患者鞘内注射阿糖胞苷治疗,3例患者鞘内注射贝伐珠单抗等联合治疗后,OS均长于6.9个月,其中仅第3例患者第14次鞘内注射治疗后半小时内出现双下肢痉挛,其余患者均未出现药物相关不良反应。
全身化疗所采用的多数药物不能透过血脑屏障,目前能透过血脑屏障的化疗药物有培美曲塞、卡莫司汀、洛莫司汀、长春新碱、卡培他滨、拓扑替康和大剂量甲氨蝶呤等,培美曲塞已被证实在肺癌脑膜转移治疗中发挥重要作用。虽然化疗药物在脑脊液中的浓度明显低于血浆药物浓度,但其可以作用于脑外肿瘤病灶,联合鞘内注射化疗药物,延长患者总生存时间。Park等[8]回顾性分析了50例细胞学证实的非小细胞肺癌脑膜转移患者的治疗过程,发现系统性化疗能显著延长生存时间。但很可惜的是,脑膜转移的患者一般情况相对较差,能耐受系统性全身化疗的患者例数偏少。
替莫唑胺是一种咪唑并四嗪类具有抗肿瘤活性的烷化剂,动物实验证明替莫唑胺能很好地穿透血脑屏障,中枢药物浓度约为血浆药物浓度的30%。口服替莫唑胺具有100%的生物利用度,并且进入中枢后能自发转换为活性代谢物,这些药理特性使其成为治疗中枢转移的理想药物[9]。国外的两个临床试验研究表明,替莫唑胺联合放疗治疗脑转移瘤,尤其是肺癌脑转移,显示了较好的临床抗癌活性、安全性和耐受性,加入替莫唑胺比单纯放疗提高了完全缓解(complete response,CR)率和部分缓解(partial response,PR)率[10]。但目前仍缺乏替莫唑胺用于治疗脑膜转移的临床研究。本研究11例肺腺癌脑膜转移患者中4例规律服用替莫唑胺胶囊治疗,均显示临床获益,其中2例患者出现恶心,1例患者出现轻度头痛,停药后头痛消失。
埃克替尼、吉非替尼与厄洛替尼是一种能够透过血脑屏障的选择性第一代EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI),在脑组织和脑脊液中的药物浓度相对较高。有研究显示吉非替尼治疗肺癌脑膜转移的疾病控制率超过50%,亦显示吉非替尼治疗失败的肺癌脑转移患者,继续使用厄洛替尼疗效显著[11]。本研究9例患者均在不同治疗基础上加用EGFR-TKI药物治疗,其中3例加用厄洛替尼,5例加用吉非替尼,1例加用埃克替尼,9例患者的临床症状均得到不同程度的改善,OS均达到5个月以上,其中2例EGFR19号外显子突变的患者OS分别达到26个月及15个月。但EGFR-TKI的中位无进展生存期(progressionfree survival,PFS)通常为9~13个月。多项研究显示,第一代EGFR-TKI治疗后有>50%的患者会出现EGFR T790M突变而导致获得性耐药[12]。AZD9291是一种口服的、第三代的EGFR抑制剂,通过消耗EGFR蛋白强有效地抑制细胞的生长和阻断EGFR信号通路。因为该药物可选择性抑制EGFR敏感突变和T790M耐药突变,因此对既往EGFR-TKI治疗后出现T790M获得性耐药的脑膜转移患者,可尝试口服AZD9291治疗,但需要较多的临床数据进一步证实。《新英格兰医学杂志》发表的两项研究中显示部分T790M阴性的患者口服AZD9291同样有效,该研究第7例患者病理组织及外周血EGFR基因检测结果均为阴性,该患者口服吉非替尼治疗后临床症状改善不明显,但改服AZD9291治疗后,脑膜刺激征明显改善,且OS达到了6.9个月,提示治疗获益。
艾乐替尼是一种治疗ALK阳性口服的小分子抑制剂,可用于经克唑替尼治疗后疾病进展或不能耐受的非小细胞肺癌患者,其作用机制是抑制ALK蛋白的活性,从而阻止肺癌细胞的生长和转移。虽然第一代ALK抑制剂(克唑替尼)在多项临床试验中显示出了良好的临床疗效和安全性,但由于其透过血脑屏障的药物浓度较低,对中枢神经系统转移的患者疗效有限,因此中枢神经系统(CNS)的复发进展较为常见[13-14]。与第一代ALK抑制剂相比,艾乐替尼最大的优势在于,其在ALK阳性的NSCLC患者脑脊液中的浓度近似于血浆游离浓度,因此艾乐替尼对中枢神经系统转移的非小细胞肺癌有效。多项临床研究显示,口服艾乐替尼治疗后,CNS缓解率为61%(46%~74%),其中CR为18%,PR为43%,平均缓解时间9.1个月[15-16]。该研究中第10例患者行FISH检测显示ALK融合基因突变,口服艾乐替尼治疗后OS仅为1.7个月,考虑与患者多个周期治疗后ECOG评分低有关,但患者临床症状改善明显。
随着靶向治疗药物的不断问世及化疗药物的不断更新,肺癌患者OS较前显著延长,这也是脑膜转移的发病率呈上升趋势的一个重要原因,目前脑膜转移的治疗手段包括保守治疗、手术治疗、放射治疗、鞘内化疗、全身化疗和分子靶向治疗等。但整体治疗效果不理想,治疗相关不良反应大,亦无统一的治疗原则,经综合治疗后患者的中位OS为4~6个月。治疗的主要目标是改善和(或)稳定神经功能,延长生存时间,提高患者生活质量。部分靶向药物因其在脑脊液中分布较高的优势,能够较好地延长脑膜转移患者的OS,改善患者的生活质量。在既往治疗过程中,由于既往组织标本不足、再次取活检受限及基因检测费用昂贵等原因,未能很好地完善相关的基因检测,但随着精准医学时代的到来,液体活检和二代测序开始步入临床,目前液体活检的检测对象主要包括以下3种:循环肿瘤细胞(circulating tumor cell,CTC)、血浆游离DNA(cell free DNA,cfDNA)和外泌体。液体活检能便捷、准确且较为经济地显示患者的基因突变情况,能更好地发现未知基因,探索疗效监测、预后判断和发现耐药机制等[17]。这将为患者及医务工作者提供更多的信息,指导靶向药物的选择;期待更多药物及检测手段用于诊治肺腺癌脑膜转移,且取得更好的抗癌疗效。
[1]Grossman SA.Advances in the treatment of central nervous system metastases:treatment of neoplastic meningitis[C].Alexandria:Am Soc Clin Oncol,2001:598-604.
[2]ChamberlainMC.Leptomeningealmetastasis[J].SeminNeurol,2010,30(3):236-244.
[3]Gleissner B,Chamberlain MC.Neoplastic meningitis[J].Lancet Neurol,2006,5(5):443-452.
[4]Morris PG,Reiner AS,Szenberg OR,et al.Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy[J].J Thorac Oncol,2012,7(2):382-385.
[5]Lee SJ,Lee JI,Nam DH,et al.Leptomeningeal carcinomatosis in non-small-cell lung cancer patients:impact on survival and correlated prognostic factors[J].J Thorac Oncol,2013,8(2):185-191.
[6]ChamberlainMC.Leptomeningealmetastasis[J].SeminNeurol,2010,30(3):236-244.
[7]Groves MD,Hess KR,Puduvalli VK,et al.Biomarkers of disease:cerebrospinal fluid vascular endothelial growth factor(VEGF)and stromal cell derived factor(SDF)-1 levels in patients with neoplastic meningitis(NM)due to breast cancer,lung cancer and melanoma[J].J Neurooncol,2009,94(2):229-234.
[8]Park JH,Kim YJ,Lee JO,et al.Clinical outcomes of leptomeningeal metastasis in patients with non-small cell lung cancer in the modern chemotherapy era[J].Lung Cancer,2012,76(3):387-392.
[9]PatelM,McCullyC,GodwinK,etal.Plasmaandcerebrospinal fluid pharmacokinetics of intravenous temozolomide in non-humanprimates[J].JNeurooncol,2003,61(3):203-207.
[10]Abrey LE,Christodoulou C.Temozolomide for treating brain metastases[J].Semin Oncol,2001,28(4 Suppl 13):34-42.
[11]Masuda T,Hattori N,Hamada A,et al.Erlotinib efficacy and cerebrospinal fluid concertration in patients with lung adenocarcinoma developing lepotmeningeal metastases during gefitinib therapy[J].Cancer Chemothera Pharmacol,2011,67(6):1465-1469.
[12]Ku BM,Bae YH,Koh J,et al.AZD9291 overcomes T790 M-mediated resistance through degradation of EGFR(L858R/T790M)in non-small cell lung cancer cells[J].Invest New Drugs,2016,34(4):407-415.
[13]Metro G,Lunardi G,Bennati C,et al.Alectinib’s activity against CNS metastases from ALK-positive non-small cell lung cancer:a single institution case series[J].J Neurooncol,2016,129(2):355-361.
[14]Ou SH,Weitz M,Jalas JR,et al.Alectinib induced CNS radiation necrosis in an ALK+NSCLC patient with a remote(7 years)history of brain radiation[J].Lung Cancer,2016,96:15-18.
[15]FULL PRESCRIBING INFORMATION.ALECENSA(alectinib)capsules,for oral use Initial U.S.Approval:2015[EB/OL].[2015-12-11].http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/208434s000lbl.pdf.
[16]Song Z,Wang M,Zhang A.Alectinib:a novel second generation anaplastic lymphoma kinase(ALK)inhibitor for overcoming clinically-acquired resistance[J].Acta Pharm Sin B,2015,5(1):34-37.
[17]中国临床肿瘤学会,中国抗癌协会肺癌专业委员会.液体活检:规范与精准同行[J].循证医学,2016,16(4):193-197.
