结直肠癌患者术后营养状态对放化疗耐受性的影响研究
2018-07-07潘永传
张 勇 谭 勇△ 潘永传
(1重庆黔江中心医院重症医学科 重庆 409099;2阳春市人民医院外二科 广东阳春 529600)
结直肠恶性肿瘤可引起食欲减退、消化道梗阻及味觉改变,造成摄食减少和体重降低,肿瘤细胞还可通过神经内分泌系统影响机体正常代谢功能,最终导致营养不良甚至恶病质[1]。肿瘤切除术后放化疗虽有助于控制肿瘤进展及降低复发率,但放化疗引起的不良反应可能进一步加重营养不良[2],而长期营养不良也可能使患者对放化疗不能耐受,部分结直肠癌患者可能因放化疗不良反应和营养不良而终止治疗[3],因而了解术后营养状态与放化疗耐受性的关系对保障治疗的顺利进行具有重要意义。本研究纳入本院180例结直肠癌术后放化疗患者作为研究对象,在评估患者营养状态基础上分析其与放化疗耐受性的关系,以期为临床提供参考,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2013年4月至2017年4月本院180例结直肠癌患者临床资料,其中男103 例,女 77 例;年龄(58.64±12.23)岁;肿瘤位置:结肠癌101例,直肠癌79例;美国肿瘤研究联合会推荐第7版肿瘤分期标准[4]:Ⅱ期104例,Ⅲ期76例;肿瘤分化程度:高分化54例,中分化79例,低分化47例;手术方式:腹腔镜Miles术120例,腹腔镜Dixon术60例;管状腺癌73例,黏液腺癌58例,乳头状腺癌 49 例;Karnofsky(KPS)评分为(85.94±8.94)分; 白蛋白 (Alb) 为 (35.91±6.03)g/L; 前白蛋白(PAB)为(138.65±34.42) g/L。
1.2 纳入标准 (1)均经术前结肠镜和手术病理证实为结直肠癌;(2)均签署知情同意书;(3)能配合随访,完成资料收集;(4)预计生存期超过半年。
1.3 排除标准 (1)术前已发生远处转移或广泛器官粘连;(2)合并有其他恶性肿瘤者;(3)既往接受激素、免疫抑制剂及分子靶向治疗者。
1.4 术后治疗方案与耐受性 化疗:待生命体征平稳,术后4~8 w开始化疗:第1 d,静脉滴注奥沙利铂 130 mg/m2;滴注时间>2 h;第 1~5 d静脉滴注四氢叶酸0.2 g/m2,2 h内滴完,静脉滴注5-氟嘧啶,0.5 mg/m2;滴注时间>8 h。每21 d为1个周期。放疗:患者取仰卧位,采用Somatom Sensation 16型CT机进行扫描,层厚3 mm,依次扫描盆腔和下腹部,将数据传至.Pinnacle治疗计划系统,确定肿瘤体积(GTV)、治疗临床靶区(CTV)及计划靶体积(PTV)。单次剂量1.8~2 Gy,总剂量 45~54 Gy,每周 5 次。放化疗开始
1.6 统计学方法 选用SPSS 19.0统计学软件对数据进行处理。计量资料以()表示,组间比较行 t检验;计数资料以[n(%)]表示,组间比较行 χ2检验;多因素分析采用Logistic分析;相关性采用Spearman等级相关分析。以p<0.05为差异有统计学意义。后记录毒副反应,毒副反应采用CTCAE 4.0标准评估[5],Ⅰ级:放化疗后无明显临床症状,无需干预;Ⅱ级:放化疗中有不适症状,需临床干预,不影响日常活动;Ⅲ级症状较重,需临床干预,需延迟给药;Ⅳ级:严重影响健康,需终止化疗甚至威胁生命。以患者顺利完成放化疗或延迟完成为耐受性良好,以治疗期间中断治疗为耐受性差。
1.5 术后营养状态 根据营养风险筛查表(nutritional risk screening 2002,NRS 2002)记录放化疗前1 w患者营养状态,NRS 2002风险筛查包括营养不良程度(0~3 分)、疾病严重程度(0~3)分及年龄(0~1分)3个方面,以NRS 2002评分≥3分为营养不良,有营养风险[6]。
2 结 果
2.1 患者术后营养状态及耐受性评估结果 180例结直肠癌患者中NRS 2002评分≥3分者97例,占53.89%,视为有营养风险组;83例NRS 2002评分<3分,占46.11%,视为无营养风险组。180例患者中129例结直肠癌患者按计划顺利完成放化疗,12例延迟完成,共141例耐受性良好,为耐受性良好组,另39例因毒副反应终止治疗,为耐受性差组。经Spearman等级相关分析,结直肠癌患者术后营养状态与耐受性呈正相关(r=0.426,P=0.023)。见表1。

表1 营养状态与耐受性相关性分析
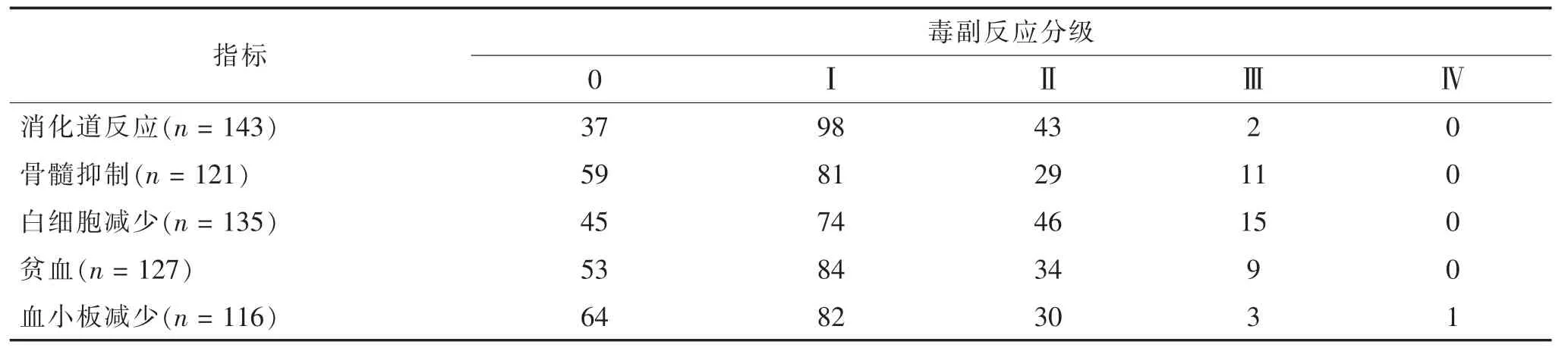
表2 180例患者放化疗毒副反应发生情况(n)
2.2 术后放化疗毒副反应发生情况 结直肠癌放化疗毒副反应以消化道反应、骨髓抑制、白细胞减少、贫血及血小板减少为主,见表2。经Spearman等级相关分析显示,毒副反应分级与放化疗耐受性呈正相关(r=0.507,P=0.000),见表 3。
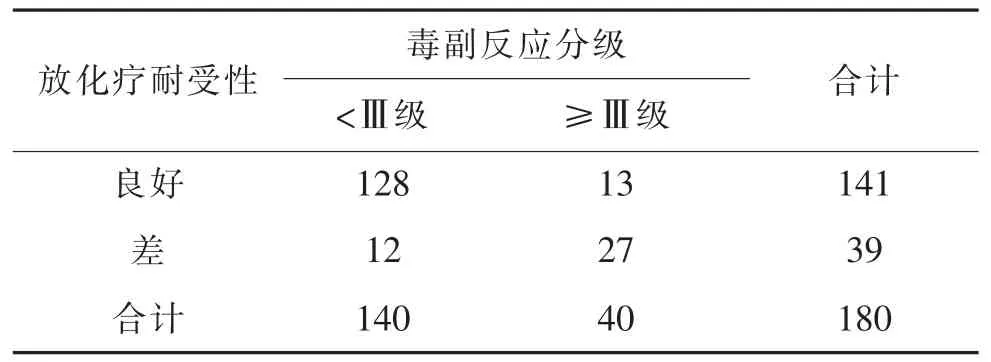
表3 放化疗毒副反应与耐受性相关性分析
2.3 结直肠癌根治术后放化疗耐受性单因素分析不同耐受患者的NRS评分、不良反应分级、KPS评分、肿瘤分化程度及PAB水平差异均有统计学意义(均p< 0.05)。 见表 4。
2.4 结直肠癌耐受性多因素分析 将NRS 2002评分、KPS评分、不良反应分级及分化程度赋值,PAB以原始数据纳入多因素分析模型,结果显示NRS 2002评分<3分是影响患者耐受性的独立保护因素(p<0.05),不良反应分级≥Ⅲ级是影响患者耐受性的独立危险因素(p<0.05)。见表5、表6。
3 讨 论
术后复发和远处转移是结直肠癌治疗失败的主要原因,根治术后辅助放化疗对降低术后复发和远处转移率具有重要意义,而术后良好的营养状态和对治疗的耐受性是术后放化疗顺利进行的重要保障[7]。NRS 2002具有操作简便、无创有效、患者配合度高的特点,是由欧洲营养学会推荐的用于评估住院患者营养状态的首选工具,已被广泛用于胃癌、食管癌、肺癌等多种恶性肿瘤患者的临床评估[8-10]。本研究采用这一量表对180例结直肠癌患者术后营养状态进行调查,发现结直肠癌术后具有营养风险的患者达53.89%,提示结直肠根治术患者多存在营养不良问题。
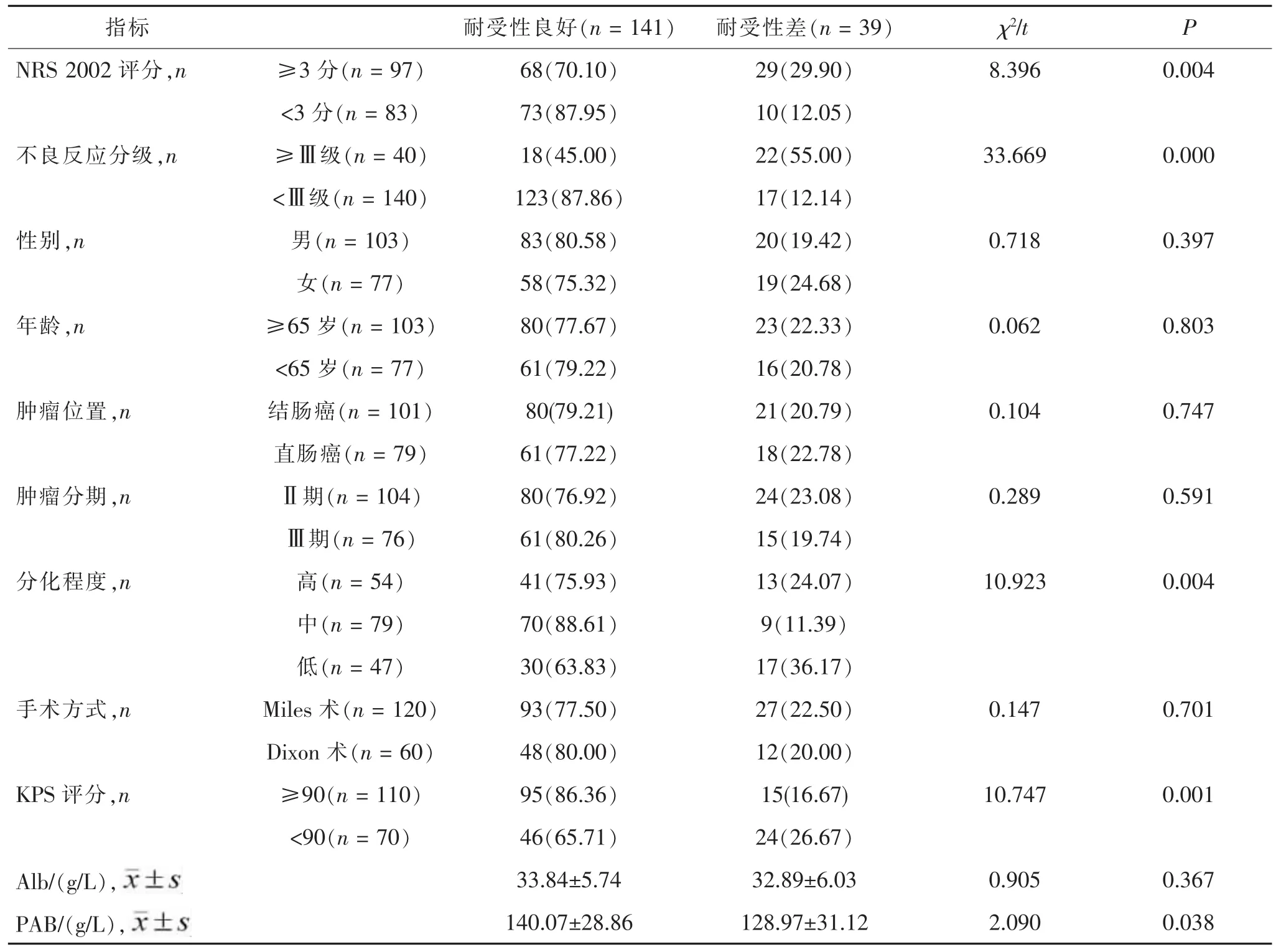
表4 结直肠癌患者放化疗耐受性单因素分析

表5 结直肠癌耐受性多因素分析赋值表
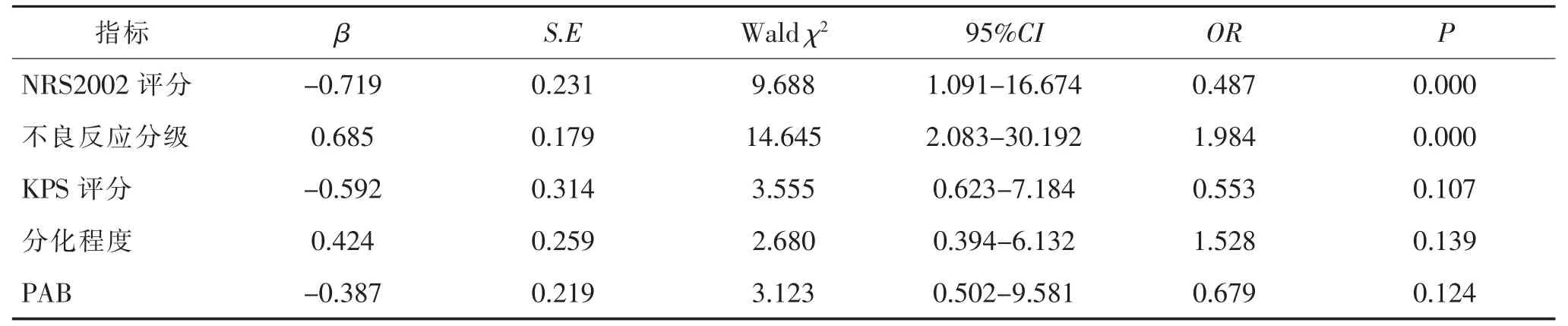
表6 结直肠癌患者术后放化疗耐受性多因素分析
围手术期因手术所致的急性应激反应和对胃肠功能的损伤增加营养消耗,往往使患者营养状态持续恶化,其中体重下降是重要表现,且随着体重降低,患者营养风险对放化疗期间毒副反应的影响逐渐增强[11],最终可造成患者对疾病不能耐受而终止治疗。本研究采用等级相关分析发现营养状态与耐受性具有相关性,提示随着营养状态的恶化,患者因耐受性差而发生终止放化疗治疗的风险将显著增加。本研究还显示NRS 2002评分是患者治疗耐受性的独立影响因素,说明随着机体营养状况的恶化,患者对放化疗的依从性逐渐降低,甚至中断治疗。因而放化疗前充分了解营养状态对指导临床术后辅助治疗具有较高应用价值。朱文强等[12]也认为化疗前进行整体规划并动态分析调整营养状态,提高机体免疫功能,有助于减轻毒副反应,保障放化疗顺利开展,本文观点与之一致。另外,本研究还显示不良反应分级也是影响患者治疗耐受性的独立因素,随着毒副反应加重,对机体正常机能破坏力度逐渐增加,同时影响患者心理状态,焦虑、抑郁、恐惧等负性情绪加重[13],使患者不能坚持放化疗方案,因而早期营养调查和营养支持应是结直肠癌患者综合治疗方案的重要内容,监测患者营养状态并进行合理的营养干预有助于提高机体总体质量,减轻因放化疗导致不良的反应,提高患者治疗的耐受性。
综上所述,结直肠癌根治术后患者多存在营养不良风险,NRS 2002评分和不良反应分级是影响患者放化疗耐受性的独立影响因素,应将营养状态监测和干预纳入结直肠癌综合治疗方案。
[1]王芳.术前营养风险筛查用于结肠癌患者围手术期营养支持的临床效果[J].中国地方病防治杂志,2017,32(2):227.
[2] RATTI F,CATENA M, PALO S D,et al.Laparoscopic approach for primary colorectal cancer improves outcome of patie-nts undergoing combined open hepatic resection for liver met-astases[J].World Journal of Surgery,2015,39(10):2573-2582.
[3]王尧,陈艳红,陈宏,等.结肠癌患者外周血DPYD基因多态性与5-FU敏感性和毒副作用相关性分析[J].山东大学学报(医学版),2014,52(1):18-21.
[4] EDGE S B,BYRD D R,COMPTON C C, et al.AJCC cancer staging manual.7th ed.New York:Springer.2010.
[5] ZHU A X, FINN R S, MULCAHY M, et al.A phase II and biomarker study of ramucirumab,a human monoclonal antibody targeting the VEGF receptor-2,as first-line monotherapy in patients with advanced hepatocellular cancer[J].Clinical Cancer Research,2013,19(23):6614-6623.
[6]费伯健,潘菊萍,吴浩荣,等.术前营养风险筛查对结直肠癌患者围手术期营养支持治疗的临床意义[J].中华胃肠外科杂志,2014,17(6):582-585.
[7]李绮雯,李桂超,王亚农,等.胃癌辅助放化疗患者的营养状态与放化疗不良反应及治疗耐受性的关系[J].中华胃肠外科杂志,2013,16(6):529-533.
[8]黄进林,严伟华,伍志辉.胃肠外科手术患者营养风险发生研究[J].结直肠肛门外科,2014,20(3):105-108.
[9] YU B,WANG J,XIE S,et al.Nutritional risk screening 2002 asanutritionalriskscreeningmethodinesophagealcancerpatients treated with radiation therapy[J].International Journal of Radiation Oncology Biology Physics, 2015,93(3):E156.
[10]韩菊平,刘晋.上消化道出血患者营养状态对临床结局的影响[J].中国全科医学,2016,19(3):282-284.
[11]黄彪,王琦三.结直肠癌患者营养风险筛查和营养支持状况研究[J].中国全科医学,2014,17(6):656-658.
[12]朱文强,吴震峰,曹勤洪,等.营养支持联合新辅助化疗在结直肠癌伴不全梗阻病人中的应用[J].肠外与肠内营养,2016,23(5):290-293.
[13] REYNOLDS L M, MCCAMBRIDGE S A, BISSETT I P,et al.Trait and state disgust:an experimental investigation of disgust and avoidance in colorectal cancer decision scenarios[J].Health Psychology,2014,33(12):1495-1506.
