沉默STC2对裸鼠结肠癌模型中肝转移瘤形成情况及IL-10和VEGF表达水平的影响
2018-07-07龚立刚王梦萍刘文俊
龚立刚 王梦萍 刘文俊 李 菲 任 斌
(1武汉市第八医院病理科 湖北武汉 430010;2武汉市汉口医院病理科 湖北武汉 430012)
结直肠癌是全球最常见的恶性肿瘤之一,根据世界卫生组织(WHO)报道,结直肠癌是男性第三位和女性第二位常见的恶性肿瘤[1]。结直肠癌肝转移是影响患者预后的主要因素之一,手术切除是其主要的有效干预手段,但未达20%的患者可有指征接受根治性肝切除术,大部分仅能进行姑息性治疗,其5年生存率低于 10%[2]。 斯钙素 2 (Stanniocalcin 2,STC2)是一种糖蛋白分泌激素,在诸如乳腺癌、卵巢癌、肝癌等多种恶性肿瘤中发现其明显高表达,且其高表达与肿瘤大小有关[3]。因此本研究利用慢病毒载体将shRNA转染入HCT116细胞以沉默STC2,构建沉默STC2的HCT116细胞系,建立结肠癌肝转移动物模型,分析STC2在结肠癌肝转移中的作用,现报告如下。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 6~8周龄的雄性 Balb/c裸鼠24只,体重 16~20 g,购自武汉市第八医院动物实验中心,均放置于SPF3级实验室饲养。
1.1.2 实验细胞 人结肠癌细胞HCT116,由武汉市第八医院病理科提供。
1.1.3 实验试剂 胎牛血清购自Hyclone公司;RPMI-1640培养基购自Hyclone公司;McCoy 5A培养基购自GIBCO公司;胰蛋白酶(Trypsin)购自吉诺生物医药技术有限公司;琼脂糖 (Agarose)购自Biowest Agarose公司;高效真核转染试剂购自威格拉斯生物技术有限公司;双荧光报告测试系统(Dual-LuciferaseReporter Assay System)购自 Promega公司;DNA Marker DL 2000购自宝生物工程有限公司;限制性内切酶(KpnⅠ、Sal I等)购自Takara公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)购自Duchefa公司;DNA Marker DM8000购自全式金生物公司;dNTPs购自Takara公司;ExTaq DNA聚合酶购自Takara公司;Taq DNA聚合酶购自Fermentas公司;甘氨酸、三羟甲基氨基乙烷(Tris)购自Amresco公司;丙烯酰胺、甲叉双丙烯酰胺、苯甲基磺酰氟 (PMSF)购自Promega公司;二硫苏糖醇(DTT)、β-巯基乙醇购自武汉天源生物技术有限公司;Revert AidTM First Strand cDNA synthesis kit(#K1622)购自Fermentas公司;PCR产物胶回收试剂盒购自Biospin公司;质粒提取试剂盒购自天根生化科技有限公司;HRP显色试剂盒购自Millipore公司;Moncolonal Anti-STC2 antibody produced inmouse购自Sigma公司;Matrigel胶购自BD公司。
1.2 实验方法
1.2.1 HCT116细胞的培养和传代 HCT116细胞用含10%FBS的1640培养基于37℃、5%CO2培养箱中进行培养。在高倍镜下观察,取对数生长期的细胞,培养瓶内细胞密度达到80%~90%时,吸出原有旧培养基,用PBS缓冲液冲洗一遍后,加入含EDTA的胰酶消化细胞,旋转培养瓶使溶液覆盖整个细胞面,在高倍镜下观察细胞变圆后吸出胰酶,再加入培养液基终止消化。用移液管轻轻吹打培养基,使细胞团分散成单细胞悬液,并按照实验需要,接种2.5 mL细胞悬液于新的细胞培养瓶中,轻轻晃动培养瓶,使细胞分布均匀,放置于37℃、5%CO2细胞培养箱中继续培养。
1.2.2 慢病毒 (Lentivirus)介导的基因沉默及验证根据pLL3.7载体及STC2基因上的酶切位点,设计STC2敲降引物,引物由上海生工生物工程股份有限公司合成。引物序列如下:lenti-STC2-F:TGTGGAGATGATCCATT TCATTCAAGAGATGAAAT GGATCATCTCCACTTTTTTC;lenti-STC2-R:TCGAGAAAAAAGTGGAG ATGATCCATTTCATCTCT TAGGTGAAATGGATCATCTCCACA。取pLL3.7-STC2 10 μL送上海美吉生物公司测序(正向、反向双向测序)。打开DNAStar软件中的Sequence程序,对测序结果进行分析。点击“File”中的“EnterSequence”导入测序结果,与NCBI网站上给出的STC2基因碱基序列进行对比。选择所测结果第40~50位碱基开始比对 (测序结果从第40~50位碱基开始比较稳定),结果提示测序结果与NCBI网站STC2的序列完全吻合。具体步骤:①实验组:200 μL无 血 清 DMEM 稀 释 10 μg pLL3.7-STC2+5 μg pMDLg-pRRE+5 μg VSVG+5 μg pRSV-Rev。 对照组:200 μL 无血清 DMEM 稀释 10 μg pLL3.7+5 μg pMDLg-pRRE+5 μg VSVG+5 μg pRSV-Rev。 ②100 μL无血清 DMEM 稀释 7.2 μL VigoFect。 ③5 min后,将①、②溶液混合,室温静止15 min。④将实验组和对照组250 μL质粒和脂质体混合物分别加入2盘10 cm皿的HCT116细胞的培养皿中,做好标记。⑤6~10 h后,移除含有DNA-脂质体复合物的培养基,代之以正常培养液DMED+10%FBS(从此刻开始算时间)。⑥转染24 h后,荧光显微镜下观察,转染效率应达到70%以上,如未达到,重复上述实验。⑦48 h后将2个10 cm培养皿中的培养液转移至2个15 mL离心管中,1 000 g离心5 min后,将上清转移至2个新的15 mL离心管中,此时收获含病毒的上清2管(沉默组 pLL3.7-STC2、对照组 pLL3.7-Con,每组2管),置于4℃冰箱备用。48 h之内若观察细胞状态欠佳,可每孔加入1 mL的相应完全培养基。传代培养,得到稳定沉默STC2的HCT116细胞系(HCT116 pLL3.7-STC2、 HCT116 pLL3.7-Con)。
1.2.3 Western Blot验证沉默STC2效果 取6孔板中要收集的沉默STC2的细胞 (HCT116 pLL3.7-STC2、HCT116 pLL3.7-Con),去掉培养基,用预冷的PBS轻轻洗涤一遍,然后将液体去除干净。每孔样品中分别加入300 μL RIPA裂解缓冲液+3 μL NaVO3+3 μL PMSF+3 μL PIC,置于冰上裂解 1~2 h,裂解在摇床上进行。将6孔板内细胞碎片和裂解液转移至1.5 mL离心管中,10 000 g,4℃,离心15 min,取上清分装后于-80℃保存。临用前于10 000 g、4℃离心1 min取上清,用于Western Blot分析。采用Millipore的HRP显色试剂盒进行显色,用凝胶扫描分析系统(LAS4000mini luminescent image analyzer)扫描存图。
1.2.4 建立结肠癌肝转移动物模型 取雄性Balb/c裸鼠共 24 只,体重 16~20 g,6~8 周龄,随机分为实验组及对照组,每组各12只,分别以能稳定沉默STC2的细胞HCT116 pLL3.7-STC2及细胞HCT116 pLL3.7-Con应用脾脏注射并保留脾脏建立结肠癌肝转移动物模型。结肠癌肝转移动物模型参考文献方法[4]并做适当改进,将测定细胞浓度为2.5×107/mL的癌细胞悬液 (实验组和对照组分别使用HCT116 pLL3.7-STC2细胞和HCT116 pLL3.7-Con)0.2 mL(5×106个)缓慢注射于脾内,3~5 min 后见注射部位发白、肿胀后拔针,立即用酒精棉球按压针眼直至无活动性出血,依次间断缝合肌肉、皮肤,关腹。将小鼠置入温箱中保暖,腹腔注射1%哌拉西林0.1 mL,苏醒后给予葡萄糖盐水饲养,继续在SPF3级实验室IVC内独立饲养。3 w后颈脱臼处死后立即剖腹,观察肝脏表面转移癌结节数目、大小、位置,双肺、大肠、小肠、肠系膜受累情况,有无腹腔淋巴结转移及腹水,将转移瘤用10%福尔马林固定后石蜡包埋,连续组织切片,后行HE染色,光镜下观察,以明确肝转移情况。双肺及小肠均进行病理学检查,以明确有无转移情况。
1.2.5 免疫组织化学方法检测转移灶中白介素-10和VEGF的表达 将石蜡切片放置于染色架上,放在65℃烘箱中烘片2 h,待冷却后脱蜡,然后将切片放入PBS中,在摇床上洗3次,每次5 min。在微波修复盒中配制少许的EDTA缓冲液,将切片放入其中,行微波修复,中火至缓冲液煮沸后断电,间隔10 min后使用低火至煮沸。自然冷却后使用PBS洗涤3次,每次5 min。将切片放置入3%过氧化氢溶液中,室温下避开光线孵育10 min,以阻断内源性过氧化物酶的作用。再用PBS洗3次,每次5 min,甩干后用组画笔将组织圈起来,以防止之后步骤中组织上所孵育的液体流出,在组织上加适量的5%BSA然后封闭20 min。甩去BSA液,每张切片加入50 μL稀释的一抗,完全覆盖组织,在4℃环境里过夜。再用PBS洗3次,每次5 min。去除PBS液,每张切片加50~100 μL相应种属的二抗,在4℃环境里孵育50 min。PBS洗3次,每次5 min。然后去除PBS液,每张切片加50~100 μL新鲜配制的DAB溶液,显微镜控制显色。观察显色完全后,使用蒸馏水或自来水冲洗,然后使用苏木素复染,1%盐酸短暂酒精分化数秒,用自来水冲洗,然后氨水返蓝,流水冲洗。切片经过梯度酒精(70%~100%)10 min一个梯度,脱水干燥,二甲苯透明10 min,中性树胶封固,镜下观察拍照。结果判定:根据IL-10和VEGF的分泌特点,阳性结果判定为细胞膜或细胞质中出现棕黄色颗粒,在400倍光学显微镜下观察,每张切片取10个视野,使用专业图像处理分析软件Imageproplus 6.0进行分析,计数每个视野积分光密度值(IOD),以平均值作为每张切片的阳性细胞积分光密度值。
1.3 统计学分析 本实验所有数据均采用SPSS 17.0软件进行分析。计数资料采用(n)表示,采用Fisher检验进行比较;计量资料采用()表示,采用t检验进行比较。以p<0.05为差异有统计学意义。
2 结 果
2.1 WesternBlot验证沉默 STC2结果HCT116pLL3.7-STC2细胞中STC2蛋白的表达量少于HCT116pLL3.7-Con,提示沉默STC2成功。见图1。
2.2 两组造模后肝脏转移瘤形成情况的比较 实验组肝转移瘤发生率为41.67%(5/12),对照组为91.67%(11/12),组间差异有统计学意义 (Fisher检验,P=0.027)。实验组肝转移瘤数量少于对照组(p<0.05),两组肝转移瘤大小和肝脏重量的差异均无统计学意义(均P>0.05)。见表1。
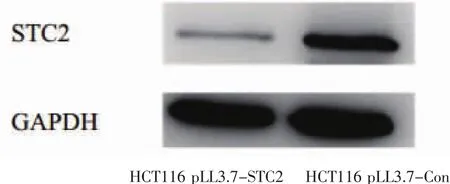
图1 Western Blot验证图
2.3 IL-10和VEGF在转移瘤组织中的表达情况两组肝转移瘤组织中IL-10的表达均为阳性,在肿瘤细胞胞质和细胞间质内可见有棕黄色染色颗粒,而在未出现转移灶的正常肝脏中未见棕黄色颗粒,见图2。实验组与对照组两组切片的阳性细胞积分光密度值分别为 (8 459.55±2 598.32)、(14 503.69±4 786.58), 组间差异有统计学意义 (t=3.509,P=0.042)。两组转移瘤组织中VEGF的表达均为阳性,主要表达于细胞胞浆,实验组与对照组切片的阳性细胞积分光密度值分别为(11 219.22±3 046.39)、(20 602.19±5 150.73), 组间差异有统计学意义 (t=4.958,P=0.031)。
3 讨 论
STC是一种最初在硬骨鱼中发现的糖蛋白激素,在鱼的腮和肠道中起到抑制钙摄取的作用,还能促进肾脏对磷酸盐的吸收。随后有研究发现,人和其它哺乳动物体内也存在STC,并且在肿瘤的发生发展中也有重要作用[3]。STC主要包括STC1和STC2两种,研究证实人STC2基因定位于人染色体5q35.1,其序列中组氨酸和半胱氨酸的排列非常独特,是区分其他STC的关键[5]。STC2广泛存在于人体多种组织细胞中,但主要集中于肾脏的肾小管与集合管的主细胞和α闰细胞中以及十二指肠、脑、子宫、卵巢等组织中[5-7]。 已有研究显示[6-8],STC2 的不同表达水平对多种恶性肿瘤的进展预测、转移、预后以等方面有一定的指导意义。Ieta[9]等通过基因芯片及qRT-PCR的方法检测了139例结直肠癌患者癌组织与癌旁正常组织中STC2的表达水平发现,结直肠癌患者中STC2的表达水平高于癌旁正常组织,其与淋巴结转移、肿瘤浸润深度、肿瘤大小及AJCC分期有关,且STC2高表达的患者其总体生存率也低于低表达组。Hashemzadeh等[10]研究结果也表明,结直肠癌患者中STC2的表达水平比癌旁正常组织高,并且STC2的表达水平与肿瘤大小和病理分级有关。在本研究中,实验组肝转移率和肝转移瘤数量少于对照组的结果,则提示了沉默STC2后结肠癌细胞肝转移能力的下降。
表1 两组肝脏转移瘤形成情况的比较()

表1 两组肝脏转移瘤形成情况的比较()
观察指标 实验组(n=12) 对照组(n=12) t P肝转移瘤数目/个 5.41±1.16 10.91±2.18 7.043 0.032肝转移瘤体积/cm3 0.05±0.01 0.04±0.02 1.414 0.283肝脏重量/g 1.53±0.12 1.59±0.14 1.528 0.261
IL-10作为一种具有抗炎作用的抑制性细胞因子,广泛参与调节免疫细胞的生长和分化,抑制T细胞的杀伤功能,对IL-12、IL-18等促炎因子的作用有拮抗效应,其所介导的抗炎反应将诱导免疫细胞对癌细胞的免疫耐受,在肿瘤的侵袭和转移过程中发挥重要作用[11]。IL-10 在结肠癌组织中呈高表达[12],术后患者血清中IL-10水平持续升高提示复发可能[13],并且结肠癌患者血清中IL-10水平与预后有关,随着IL-10水平升高,患者发生肝转移的风险增加,癌细胞侵袭能力更强[14]。本研究中,实验组裸鼠肝脏IL-10的表达水平低于对照组,或与其抗炎作用及诱导免疫耐受能力减弱,令更多的癌细胞在肝脏局部免疫微环境的作用下被杀伤,从而导致聚集和形成肝转移灶减少有关。
肿瘤新生血管的形成是肿瘤侵袭和转移过程中的关键步骤之一。肿瘤细胞和宿主细胞的内皮细胞、上皮细胞及白细胞等都可以分泌释放多种细胞活性因子,这些细胞因子可以调控并促进肿瘤新生血管的形成,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)是最重要的细胞因子之一。多种肿瘤细胞高表达VEGF,其生成的VEGF通过旁分泌的方式作用于内皮细胞上的VEGF受体,促进肿瘤血管增生并诱导新生血管形成,与多种恶性肿瘤的转移和预后有关[15]。在结肠癌中,VEGF和其受体的高表达与肝转移的发生有关,动物实验[16]研究结果表明稳定转染VEGF基因的结肠癌细胞增殖和转移能力明显升高。目前,在结直肠癌肝转移的治疗中,以贝伐单抗为代表的抗血管生成的药物主要集中于靶向VEGF及VEGF-R信号通路,通过阻断VEGF所介导的信号转导通路,抑制肿瘤新生血管的形成,有利于降低结肠癌细胞的增殖能力,一定程度上可改善不可切除的结直肠癌肝转移患者的预后[17]。本研究结果发现,沉默STC2后肝脏转移瘤VEGF表达水平低于未沉默者,与其肝转移潜能的下降相符。

图2 IL-10和VEGF在转移瘤组织中的表达情况(×400)
基于本研究,在裸鼠中将STC2沉默后结肠癌细胞的肝转移潜能下降,且其肝转移瘤中IL-10及VEGF的表达水平低于未沉默者,提示STC2或有望作为应用于结肠癌肝转移治疗的潜在治疗靶点之一。
[1]郑树,张苏展,黄彦钦.结直肠癌研究30年回顾和现状[J].实用肿瘤杂志,2016,31(1):2-5.
[2]中华医学会外科学分会胃肠外科学组,中华医学会外科学分会结直肠肛门外科学组,中国抗癌协会大肠癌专业委员会等.结直肠癌肝转移诊断和综合治疗指南(V2010)[J].中华胃肠外科杂志,2010,13(6):457-470.
[3]马翔,陈双倩,王国洲,等.斯钙素2蛋白在结直肠癌中表达及其临床意义[J].中华实验外科杂志,2015,(7):1701-1703.
[4]王理,张文斌.结肠癌肝转移动物模型的研究进展[J].中国现代普通外科进展,2014,17(2):162-165.
[5] HASHEMZADEH S, ARABZADEH A A, ESTIAR M A,et al.Clinical utility of measuring expression levels of Stanniocalcin 2 in patients with colorectal cancer[J].Medical Oncology,2014,31(10):237.
[6] NA S S, ALDONZA M B, SUNG H J, et al.Stanniocalcin-2 (STC2):A potentiallung cancer biomarker promotes lung cancer metastasis and progression[J].BiochimBiophys Acta,2014,1854 (6):668-676.
[7] LIN S, GUO Q, WEN J, et al.Survival analyses correlate sta nniocalcin 2 overexpression to poor prognosis of nasopharyngeal carcinomas[J].Journal of Experimental&Clinical Cancer Research,2014,33:26.
[8] ARIGAMI T, UENOSONO Y, ISHIGAMI S, et al.Clinical significance of stanniocalcin 2 expression as a predictor of tumorprogressioningastriccancer[J].OncologyReports,2013,30(6):2838-2844.
[9] IETA K, TANAKA F, YOKOBORI T, et al.Clinicopathological significance of stanniocalcin 2 geneexpression in colorectal cancer[J].Int J Cancer,2009,125(4):926-931.
[10] HASHEMZADEH S, ARABZADEH A A, ESTIAR M A,et al.Clinical utility of measuring expression levels of Stanniocalcin 2 in patients with colorectal cancer[J].Medical Oncology,2014,31(10):237.
[11]朱平,杜小萍,鞠吉雨,等.IL-10与疾病关系的研究进展[J].国际免疫学杂志,2012,35(1):14-17,28.
[12]檀谊洪,邱万寿,杜国能,等.小鼠结肠癌肝转移前肝脏Th1/Th2细胞因子的变化及与门静脉IL-10、TGF-β1的相关性[J].肿瘤防治研究,2012,39(10):1166-1169.
[13] MITEVA L D, STANILOV N S, DELIYSKY T S, et al.Significance of 1082A/G polymorphism of IL10,gene for progression of colorectal cancer and IL-10 expression[J].Tumor Biology,2014, 35(12):12655-12664.
[14]邓菲丹,罗建业.结肠癌组织IL-10和IFN-γ mRNA的表达及其临床意义[J].中国医学创新,2015,12(14):60-63.
[15]王旭东,侯懿,陈静,等.结肠癌组织中血小板应答蛋白-1和血管内皮生长因子的表达及其预后分析[J].山西医药杂志,2017,46(16):1932-1935.
[16]张子杰.结肠癌组织VEGF表达与树突状细胞浸润的临床意义及与血清VEGF浓度及其活化水平的相关性[J].中国免疫学杂志,2015,31(9):1257-1261.
[17] LOUPAKISF,CREMOLINIC,MASIG,et al.Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer[J].New England Journal of Medicine,2014,371(17):1609-1618.
