hTERT启动子驱动TRAIL基因表达载体对结肠癌HT-29细胞的抑制作用研究*
2018-07-07周联明张学利单远洲张吉发朱光辉
周联明 张学利 单远洲 张吉发 朱光辉
(上海交通大学附属六院南院上海奉贤区中心医院普外科 上海 201499)
结肠癌是常见消化道恶性肿瘤,临床治疗以手术为主,辅以结合放疗和化疗[1],由于肿瘤干细胞对化疗不敏感而容易造成复发。基因治疗作为一种新兴的治疗方法,其靶向性与安全性正逐渐引起人们的关注,极有可能成为未来肿瘤治疗的发展趋势。细胞凋亡在结肠癌的发生和发展中扮演重要的角色,与凋亡有关的基因或蛋白已成为肿瘤治疗的研究热点[2]。肿瘤坏死因子相关凋亡诱导配体(tumornecrosis factor related apoptosis-inducingligand,TRAIL) 能选择性介导肿瘤细胞凋亡而对正常组织和细胞无损伤,其抗肿瘤的优势已受到研究者的重视[3]。人端粒酶逆转 录酶 (human telmoerase reserse transcriptase,hTERT)是人端粒酶活性的中心,是最重要、最普遍的肿瘤特异性的生化标志之一[4]。端粒酶的活化是细胞永生化和癌变的重要因素,由于端粒酶启动子仅能在肿瘤细胞中启动基因转录而在正常细胞中不启动,因此本研究通过观察hTERT启动子驱动TRAIL基因体外对结肠癌细胞的抑制作用,以期为结肠癌的靶向基因治疗提供理论依据,现报告如下。
1 材料和方法
1.1 实验材料 结肠癌HT-29细胞购于中科院细胞所。Pshuttle载体和重组质粒pcDNA3.1+-GFP由本实验室构建。RPMI1640购自Gibco公司;胎牛血清(FBS)、碘化丙啶(PI)、LipofectamineTM2000 和Trizol试剂购自美国 Invitrogen公司;PI试剂盒,MTT、逆转录酶、RNA酶购自sigma;胰蛋白酶、DMSO购自百灵威。
1.2 实验方法
1.2.1 细胞培养及传代 将人结肠癌细胞HT-29复苏后,置于在RPMI-1640培养液(含10%胎牛血清、100U/mL链霉素、100U/mL青霉素),在温度37℃、CO2体积5%(v/v)的细胞培养箱中培养,取对数生长期细胞进行试验。
1.2.2 细胞转染及检测 取对数生长期HT-29细胞消化为单细胞悬液,以4×105个/mL接种至6孔板,24 h后使用脂质体Lifopect进行瞬时转染,操作严格按照LipofectamineTM2000试剂说明书进行。本实验设未转染的空白对照组;转染pshuttle的空白质粒组,转染pshuttle-TRAI重组质粒组以及转染pshuttle-hTERT-TRAIL重组质粒组。
1.2.3 转染前后细胞增殖变化 采用MTT法进行细胞增殖检测。方法:取对数生长期HT-29细胞,按实验分组接种于96孔培养板并调整细胞个数为5.0×104/mL 每孔 100 μL,设 6 个复孔。 于转染 12、24和48 h后没空加入MTT10 μL,培养箱设置温度37℃、5%(v/v)CO2的条件下继续培养 4 h,后弃上清液,添加100 μL DMSO溶解,避光震荡15 min,使用酶标仪测定490 nm波长处各孔的OD值,重复三次。计算细胞抑制率,重复三次。
1.2.4 转染前后细胞凋亡测定 取对数生长期HT-29细胞,调整细胞密度至3.0×105个细胞/孔,接种于24孔板中,培养12 h待完全贴壁厚进行转染,8、16 h后移去培养基,收集细胞,PBS离心洗涤细胞,重悬于 500 mL缓冲液中。调整细胞数为 (0.5~1)×109细胞/L。 加入 5 μL Annexin V-FITC 和 5 μL PI,混匀,避光室温孵育 30 min,用流式细胞仪分析细胞凋亡率。
1.3 统计学分析 实验数据采用SPSS 19.0分析软件进行统计分析。计数资料以()表示,样本均数两两比较采用SNK-q检验,并采用单因素方差分析法进行统计学分析。当p<0.05表示差异具有统计学意义。
2 结 果
2.1 载体的构建及鉴定
2.1.1 重组质粒pshuttle-TRAIL的构建与鉴定以pshuttle-hTERT-TRAIL质粒为模板,用hTERT的上下游引物进行PCR扩增,得到大小约为861 bp片段,见图1;重组质粒pshuttle-hTERT-TRAIL用Kpn I和Xho I双酶内切得到861和7480 bp 2个片段,见图2;测序后经Blast比对序列,正式插入片段与预计插入序列具有100%同源性。
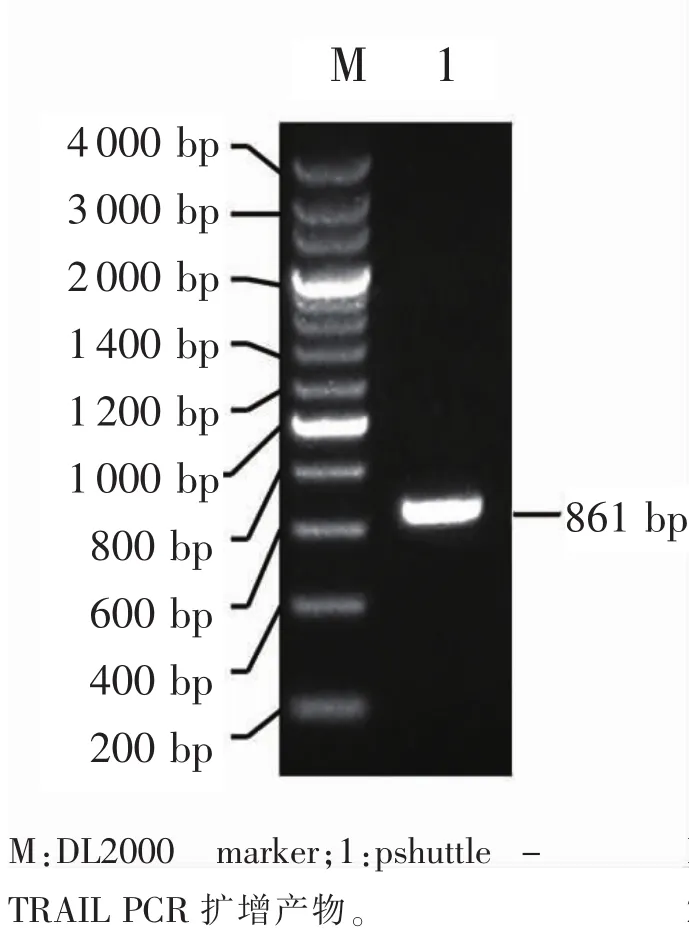
图1 PCR鉴别pshuttle-TRAIL
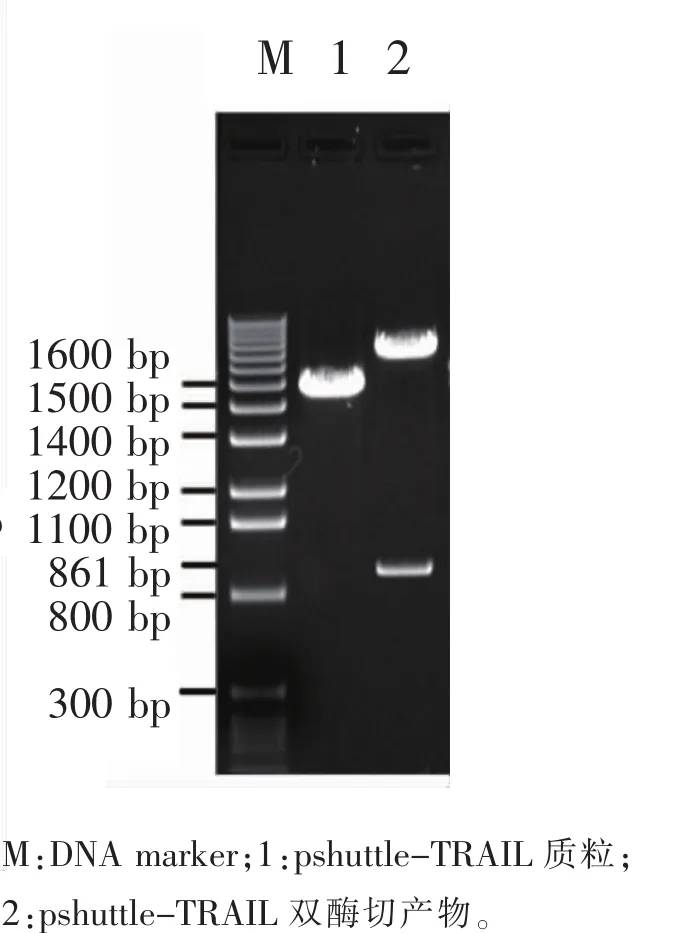
图2 限制性内切酶切鉴定pshuttle-TRAIL
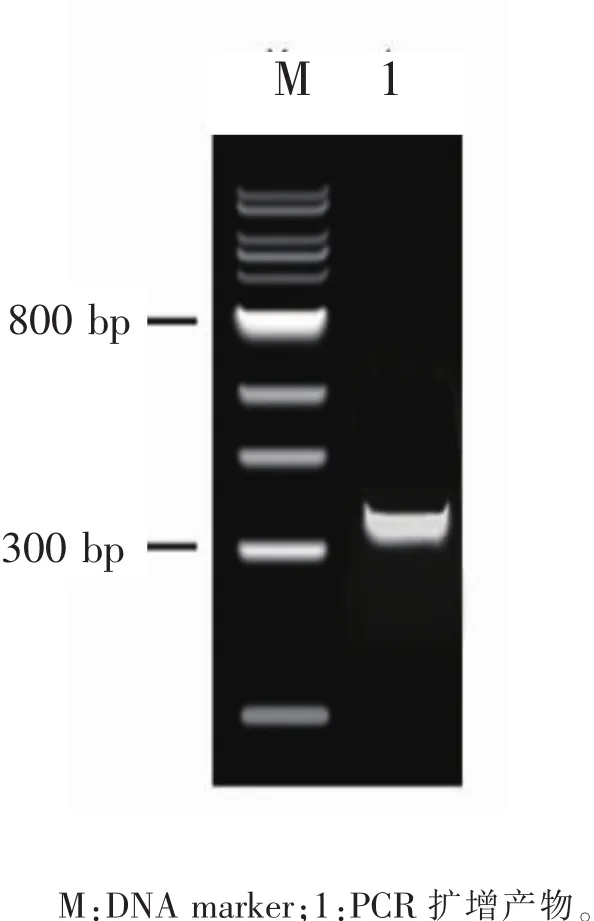
图3 PCR鉴别pshuttle-hTERT-TRAIL

图4 限制性内切酶切鉴定pshuttle-hTERT-TRAIL
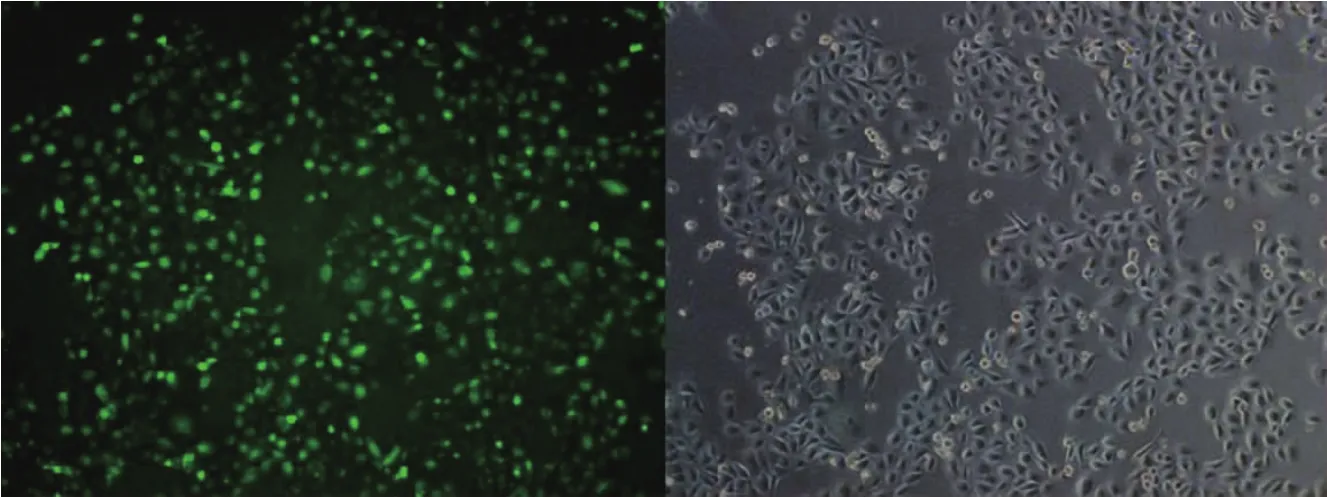
图5 荧光显微镜下质粒转染图(×200)
2.1.2 重组质粒pshuttle-hTERT-TRAIL的构建与鉴定 重组表达质粒pshuttle-hTERT-TRAIL分别进行PCR和酶切鉴定,PCR扩增得到398 bp片段;用Kpn I和Xho I进行双酶切鉴定得到358 bp和7480 bp 2个片段,PCR和没切鉴定结果与预期结果相符,见图3、图4。
2.2 重组质粒对结肠癌HT-29细胞转染效率
本研究将质粒与脂质体混合形成复合体,转染24 h后于OlympusCKX41荧光显微镜下观测绿色荧光蛋白表达。结果显示转染细胞可观察到明亮绿色荧光,证明该方法可行。分别选用质粒:脂质体=1:1,1:1.5,1:2,1:2.5,1:3,1:3.5 的梯度比例检测最佳转染比例,通过荧光强弱判断转染效率,结果当质粒与脂质体比例为1:3时荧光效率最高,视野中超过50%细胞显示绿色荧光,因此确定质粒与脂质体最佳比例为1:3,见图5。
2.3 转染对细胞增殖的影响 MTT实验结果显示在12 h、24 h和48 h时的OD值空质粒转染组细胞与空白对照组比较,差异均无统计学意义(均P>0.05),在三个时间点pshuttle-TRAIL组细胞增殖受到明显抑制,与空质粒组比较,OD值差异均有统计学意义 (均p<0.05);pshuttle-hTERT-TRAIL重组质粒组细胞细胞生长抑制最为明显,与pshuttle-TRAIL比较,三个时间点的OD值差异均有统计学意义(均p<0.05)。见表1。
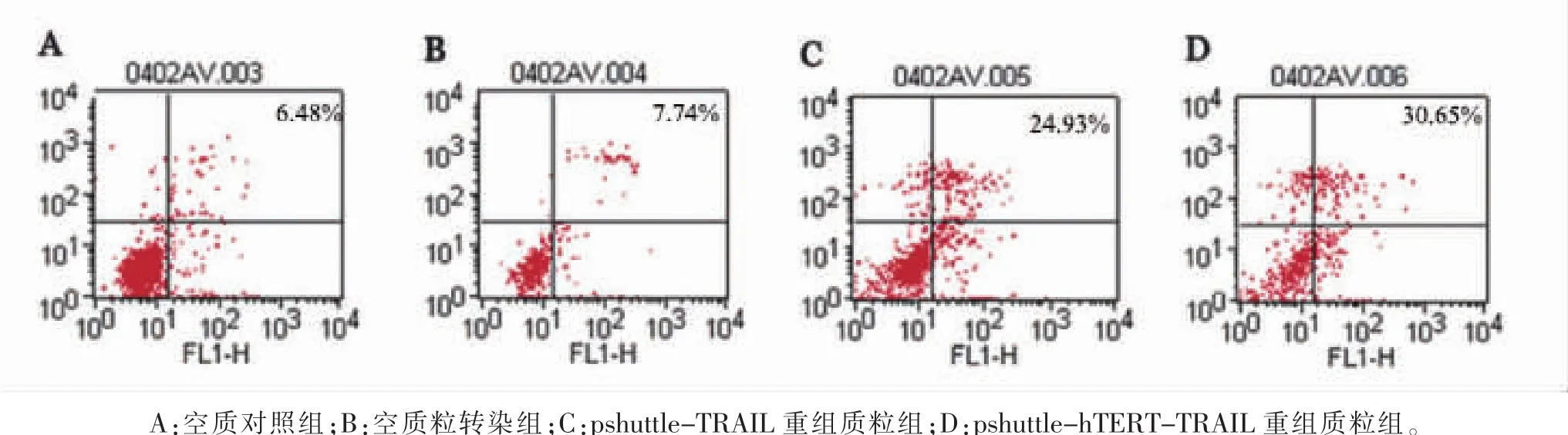
图6 流式细胞检测HT-29细胞凋亡
表1 各组细胞OD490值比较()

表1 各组细胞OD490值比较()
与空质粒转染组比较*p<0.05;与pshuttle-TRAIL重组质粒组比较,#p<0.05。
组别 空白对照 空质粒转染组 pshuttle-TRAIL重组质粒组 pshuttle-hTERT-TRAIL重组质粒组12 h 0.45±0.03 0.42±0.03 0.39±0.02* 0.35±0.02*#24 h 0.56±0.03 0.52±0.02 0.41±0.03* 0.37±0.02*#48 h 0.64±0.04 0.64±0.03 0.56±0.04* 0.51±0.01*#
2.4 转染前后细胞凋亡率的变化 四组细胞经Annexin V-FITC/PI双染后,流式细胞术检测空白对照组、空质粒转染组、pshuttle-TRAIL重组质粒组和pshuttle-hTERT-TRAIL重组质粒组凋亡率分别为6.48%、7.74%、24.93%、30.65%,pshuttle-TRAIL 重组质粒组和pshuttle-hTERT-TRAIL重组质粒组细胞凋亡率高于空白对照组和空质粒转染组 (均p<0.05)。见表2及图6。
表2 转染后对HT-29细胞凋亡率的影响(%,)

表2 转染后对HT-29细胞凋亡率的影响(%,)
与空质粒转染组比较,*p<0.05;与pshuttle-TRAIL重组质粒组比较,#p<0.05;与空白对照组比较,△p<0.05。
组别 凋亡率空白对照 6.18±1.12空质粒转染组 7.74±1.52 pshuttle-TRAIL 重组质粒组 24.93±4.12*△pshuttle-hTERT-TRAIL 重组质粒组 30.65±5.67*#△
3 讨 论
结肠癌是常见的消化道恶性肿瘤,在北美、澳洲和西欧具有较高的发病率,死亡率仅次于胃癌,而在我国的发病率呈现逐年增加的趋势。目前结肠癌临床治疗方式多样化,首选结肠肿瘤根治术,同时结合术后放疗和化疗。然而结肠癌手术治疗后的复发和转移十分常见,有研究指出结肠癌术后复发风险高达60%,结肠癌患者死亡的主要原因是术后癌细胞的转移和肿瘤复发[5]。因此,探索新的治疗方法以有效延长癌症患者生存期成为肿瘤治疗的一大目标。近年来随着分子生物学研究的深入,基因治疗开始受到人们的关注[6]。
基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的疾病,以达到治疗目的[7],也就是将外源基因通过基因转移技术将其插入患者适当的受体细胞中,使外源基因制造的产物能治疗某种疾病。从广义说,基因治疗还可包括从DNA水平采取的治疗某些疾病的措施和新技术。基因治疗与常规治疗方法不同,一般意义上疾病的治疗针对的是因基因异常而导致的各种症状,而基因治疗针对的是疾病的根源——异常的基因本身[8]。其中,体细胞基因治疗是基因治疗的一种形式,已成为研究的热点。
TRAIL基因广泛分布于人体多个器官,是新近发现的肿瘤坏死因子(TNF)家族的又一成员,但与TNF家族其他成员不同的是,TRAIL是由三个单体通过230位半胱氨酸 (Cys230)螯合一个锌离子(Zn2+)形成的三聚体,这个结构对诱导肿瘤凋亡有着重要的意义[9]。TRAIL诱导肿瘤凋亡通过死亡受体途径、线粒体途径和旁路激活途径实现,具有强大的诱导肿瘤凋亡的能力,但对正常细胞基本无影响。与TNF家族的另外两个成员FasL和TNF-α相比,TRAIL不表达于免疫细胞,对核因子NF-κB也仅有很微弱的激活作用,因此不会像TNF-α那样产生严重炎症反应,而且比FasL有更广的抗癌谱[10-11]。因TRAIL表达于人体多个器官,因此需在较大浓度下发挥效应,但近期研究结果发现TRAIL使用过量也会引发正常细胞凋亡,因此降低TRAIL对正常组织的毒副作用及增强靶向性成为亟待解决的问题[12-13]。
端粒酶是目前发现的恶性肿瘤最广谱的分子标记物,可在绝大多数肿瘤中被激活[13]。在大多数肿瘤细胞中hTERT的活性显著升高,而hTERT基因启动子对肿瘤细胞具有特异性,可靶向端粒酶阳性的肿瘤细胞,通过在转录水平调控目的基因表达,避免对正常细胞造成杀伤,是进行基因治疗新的理想靶点[14]。近年来利用hTERT启动子调控溶瘤病毒、凋亡基因、抑癌基因和自杀基因等抗肿瘤基因,均在实验中显现出明显的抗肿瘤作用[8,15-16]。
本研究通过构建pshuttle-hTERT-TRAIL特异性基因治疗载体,通过脂质体转染至人结肠癌细胞HT-29细胞系中,在MTT实验中观察到转染细胞生长受到抑制,且具有时间依赖性,在与空白对照和空质粒转染组的比较中,转染pshuttle-TRAIL和pshuttle-hTERT-TRAIL质粒的细胞受抑制作用更加明显。通过流式细胞法检测转染24 h后细胞凋亡率,空白对照组与空质粒转染组细胞凋亡率明显低于pshuttle-TRAIL和pshuttle-hTERT-TRAIL组,而pshuttle-hTERT-TRAIL诱导肿瘤细胞凋亡作用最为明显,体现了端粒酶启动子的靶向性。
综上所述,本研究通过构建hTERT启动子驱动的TRAIL基因载体,证明其具有靶向结肠癌细胞的能力,体外实验结果初步证明该载体具有抑制肿瘤生长及诱导肿瘤细胞凋亡的能力,可为未来结肠癌的基因治疗提供一定的理论依据。
[1]胡盛,于恩达.结肠癌治疗方法研究进展[J].结直肠肛门外科,2016,22(06):673-675.
[2]DE MIGUEL D,GALLEGO-LLEYDA A,AYUSO J M,et al.High-order TRAIL oligomer formation in TRAIL-coated lipid nanoparticles enhances DR5 cross-linking and increases antitumour effect against colon cancer[J].Cancer Lett, 2016,383(2):250-260.
[3] MOUZAKITI A,PACKHAM G.Regulation of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-induced apoptosis in Burkitt’s lymphoma cell lines[J].Annals of Thoracic Surgery,2015,33(4):797-803.
[4]高晓东,陈一戎.端粒酶hTERT反义核酸对TRAIL诱导的氟他胺耐受型前列腺癌LNCaP细胞凋亡作用的研究[J].中国男科学杂志,2014,28(5):20-23.
[5]任镜清,周志伟,万德森,等.结肠癌根治术后复发转移的单因素和多因素分析[J].癌症, 2006,25(05):591-595.
[6]孙朝文,周崇民,张皓,等.晚期结肠癌患者生物治疗临床应用的研究进展[J].重庆医学,2017,46(8):1123-1125.
[7] LI Y B,GUO C X,WANG Z C,et al.Radiosensitization of breast cancer cells by TRAIL-endostatin-targeting gene therapy[J].Neoplasma,2013,60(6):613.
[8] DOSS C G, DEBAYJOT C, DEBOTTEM S.The impact of gold nanoparticles on hTERT gene expression leading to terminationofmalignanttumor[J].Gene,2012,493(1):140-141.
[9]刁建东.hTERT启动子调控的TRAIL基因诱导乳腺癌细胞凋亡作用的研究[D].吉林大学,2009.
[10]李金华.hTERT启动子调控的TRAIL基因对肝癌细胞作用的实验研究[D].吉林大学,2010.
[11]朱玮,史懿,朱必俊,等.携带TRAIL的溶瘤腺病毒治疗三阴性乳腺癌的研究[J].中国临床医学,2013,20(5):620-625.
[12] SUN N F,MENG Q Y,TIAN A L,et al.Nanoliposomemediated FL/TRAIL double-gene therapy for colon cancer:in vitro and in vivo evaluation[J].Cancer Letters,2012,315(1):69-77.
[13]张明.hTERT启动子调控TRAIL基因表达载体诱导宫颈癌细胞凋亡的研究[D].第四军医大学,2007.
[14]王巍,陈文庆,王长青,等.双靶向TRAIL过表达联合辐射对乳腺癌MDA-MB-435细胞增殖和凋亡的影响[J].中国实验诊断学,2013,17(10):1755-1758.
[15] WANG T,XUE Y,WANG M, et al.Silencing of the hTERT gene through RNA interference induces apoptosis via Bax/Bcl-2 in human glioma cells[J].Oncology Reports,2012,28(4):1153.
[16] HIGASHI K, HAZAMA S,ARAKI A,et al.A novel cancer vaccine strategy with combined IL-18 and HSV-TK gene therapy driven by the hTERT promoter in a murine colorectalcancermodel[J].InternationalJournalofOncology,2014,45(4):1412.
