无机盐在提高合成高分子微球包封率的应用与机理
2018-07-06,,2
,,2
(1.浙江工业大学 药学院,浙江 杭州 310014;2.沈阳药科大学 药学院,辽宁 沈阳 110016)
微球(microspheres)是指药物溶解或者分散在高分子材料基质中形成的骨架型微小球状实体.微球的材料按来源分可分为天然高分子材料,如明胶(gelatin)、海藻酸钠(alginate)、壳聚糖(chitosan)等;半合成高分子材料,如甲基纤维素(MC)、乙基纤维素(EC)、羟丙甲纤维素(HPMC)等;合成高分子材料,如聚乳酸(PLA)、聚乳酸-聚乙醇酸共聚物(PLGA)等[1].合成材料中以PLGA最为常用,PLGA由乳酸(lactic acid, LA)和羟基乙酸(glycolic acid, GA)以不同比例聚合而来,具有良好的生物相容性与可降解性、成囊和成膜的性能,获美国食品药品管理局(FDA)和欧洲药监局批准用于人体各种给药系统[2].包封率是指制剂包封的药物占总投药量的百分比,一般要求不小于80%.Tu等[3]以明胶与海藻酸钠混合物为囊材,通过乳化/内部凝胶化方法制备了载枯草芽孢杆菌SL-13的微球,调节囊材混合物中明胶的比例至1.5%时,达最大包封率为93.44%.Filipovic-Grcic等[4]以低、中、高分子量的壳聚糖和羟丙基甲基纤维素(HPMC)及其混合物为囊材,运用喷雾干燥技术制备微球.实验结果表明:当使用低分子量的壳聚糖或者HPMC进行载药时,微球的包封率最高.Oz等[5]以W1/O/W2乳化法制备艾塞那肽多糖微球时,发现包封率主要取决于多糖的乙酰化程度.乙酰化程度越高,两者间的氢键作用与疏水相互作用增强,使亲和力增强,包封率提高.以壳聚糖为载体材料制备载亲水性药物的微球时,壳聚糖分子量越大,亲水性减弱,包封率越低[6].
虽然近年来微球的研究取得了较大的进展,但其制备仍然面临载药量与包封率低下的问题,影响微球制剂的应用.笔者主要回顾以往合成高分子微球制剂研究中各种提高包封率的办法,进行归纳、概括与分析,为将来制备高包封率的合成高分子微球制剂提供参考与可行性办法,并对其前景作出展望.
1 微球的制备方法
乳化-溶剂挥发法制备合成高分子材料微球,是由乳化作用形成的乳状液中除去挥发性有机溶剂、乳滴固化形成微球的过程,可分为简单乳化法和复乳法.O/W简单乳化法[7-8],主要适用于疏水性药物.而对于亲水性和两亲性药物主要采用W1/O/W2复乳法[9],但许多研究[5,10-11]发现,运用S/O/W法、W/O1/O2复乳化法或S/O1/O2复乳化法制备载药微球,比W1/O/W2复乳法的包封率显著提高.Nafea等[9]采用W/O1/O2复乳化法,连续相为非水溶性的液态石蜡,药物溶解度减小,损失减少,包封率增加.Yang等[12]通过S/O1/O2复乳化法制备载BSA-PEG的PLGA微球,该方法制备而来的微球包封率大于90%.当所载药物为蛋白质、多肽等时,S/O/W法有利于维持它们的生物活性[13].其他的微球制备方法如:喷雾干燥法[14]是指将聚合物溶解于有机溶剂中,药物充分分散或溶解其中,进行喷雾、溶剂挥发形成微球,该法对药物、聚合物和溶解度要求不高,适于工业化生产,但使用有机溶剂较多;在超临界流体法[15-16]中,聚合物和药物均需溶于超临界状态的二氧化碳,该法适用于低分子量的药物,不需有机溶剂,较环保;相分离法[17]是指将高分子溶于、药物溶解或混悬于某有机溶剂中,然后加入与有机溶剂互溶但不能溶解聚合物和药物的非溶剂,使聚合物因溶解度降低迅速发生凝聚,实现固液分离,得到载药微球,该法适用于亲水性药物.
2 包封率影响因素与无机盐的应用及机理
2.1 影响因素与提高办法
因合成高分子材料微球以PLGA微球居多,故主要以乳化-溶剂挥发法制备PLGA载药微球为例进行讨论.对于乳化-溶剂挥发法,包封率主要取决于药物在分散相和连续相间的分布状况[18]
微球的固化过程是影响包封率的一个重要阶段,其过程分两步,有机溶剂进入水相与溶剂的挥发.随着微球的固化,药物被载体材料包载形成微球[40].凡影响微球固化速度的因素,均会影响包封率的大小,微球固化越快,药物损失越少,包封率越高.例如有机溶剂的种类、连续相体积和温度等.有机溶剂的水溶性越低,微球固化越慢,药物损失越多,包封率越低[32,41];连续相体积越大,有机溶剂溶于外水相的速度越快,微球固化越快,药物损失减少;另外在一定范围内的温度越高,溶剂挥发越快,微球固化越快,药物损失减少.
2.2 无机盐对包封率的影响
2.2.1 无机盐的应用
Luan等[39]研究发现:当W2相中NaCl的浓度为0.05 mol/L时,相比于不加NaCl,微球包封率由88.7%增大至99.0%.但当浓度继续增大至0.5 mol/L时,包封率不再增加.Manoharan等[43]研究3种锌盐(氧化锌、碳酸锌和醋酸锌)对胰岛素包封率的影响,结果发现在没有加入锌盐时,微球包封率为69%,当锌盐加入后,包封率显著增加.Al-Maaieh等[38,44]采用O/W溶剂挥发法制备PLA微球时,研究不同浓度的Na2SO4,NaBr,NaClO4和NaSCN对离子型药物——硫酸奎尼丁的水溶性和微球包封率的影响,发现盐主要通过改变药物和有机溶剂二氯甲烷在外水相的溶解度来影响微球包封率.

表1 微球包封率的影响因素与机理Table 1 Influence factors and mechanisms of encapsulation efficiency of microspheres
2.2.2 作用机理
无机盐用于提高合成高分子微球包封率的作用机理主要分两大方面:1) 无机盐引起的渗透压的变化;2) 无机盐对药物溶解度的影响.后者根据文献资料,又可细分为同离子效应、盐析作用和新盐的生成3种.其中渗透压原理主要针对亲水性药物,同离子作用和盐析作用主要影响疏水性药物的固化过程.
对于渗透压原理,油相在微球没有完全固化时,像一张半透膜分隔内外水相[45].分散相中的药物导致其渗透压常高于连续相,因此在两相间形成的渗透压差会促进药物由分散相向连续相扩散,同时渗透压的存在又会使连续相中的水分向内分散迁移,形成的“孔道”进一步加剧药物的损失,从而降低微球包封率.在微球固化过程中,在外水相加入无机盐可以减小这种渗透压,增大包封率.如周香莲等[46]研究发现在外水相中加入NaCl,微球电镜照片显示表面孔洞明显减少、内部骨架致密.为了确认由于微球内部内外相物质交换产生的“通道”的存在,又在微球固化完成后,在外水相中加入荧光染料硫磺素-T,观察荧光染料进入微球内部的情况.结果发现:不加NaCl时微球内部有大量的荧光,随着外水相NaCl浓度的提高,微球内部的荧光呈逐渐减少的趋势.另外,一些非电解质的加入,如山梨醇等,也具有增大渗透压的作用,从而增大包封率[32].
1) 同离子效应
在外水相中加入与离子型药物具有相同离子的盐能够抑制药物的溶解.药物盐溶解度可以用沉淀平衡常数(溶度积)Ksp°表示,它的大小反映了物质的溶解能力,只受温度影响,与其他因素无关.药物(MzXy)的解离表示为

Ksp°的计算公式为
Ksp°=(a(M+y))z(a(X-z))y=(M+y)z(X-z)y(γ±)z+y
式中:a为活度;γ±为平均离子活度系数;M+y为阳离子的摩尔浓度;X-z为阴离子的摩尔浓度.
在电解质溶液中,离子相互作用使得离子通常不能完全发挥其作用.离子实际发挥作用的浓度称为有效浓度,或称为活度(activity),显然活度的数值通常比其对应的浓度数值要小些.活度系数指物质的化学活度对其浓度之比.由公式可知,当加入同离子的盐时,其中某一离子的摩尔浓度增大,γ±不变,Ksp°不变,另一离子的摩尔浓度就要减小,即药物溶解度减小[38].药物在连续相中的溶解度减小,损失减少,包封率增大.
2) 盐 析
盐析:由于无机盐的加入,增大了非电解质的活度系数,从而降低了非电解质的溶解度[47].有机溶剂作为非电解质,无机盐的加入会对其产生盐析作用,影响有机溶剂在外水相中的溶解度,从而对包封率造成影响.加入无机盐,离子溶于水以后,由于离子的溶剂化效应,离子会和水分子结合形成溶剂壳层(Hydration shell).这种壳层结合会减少自由活动的水分子,即减少可供有机溶剂分子表面结合的水分子数量.水相与有机溶剂的亲和力降低.如NaCl的加入增大了二氯甲烷的活度系数,使二氯甲烷的溶解度减小[48].有机溶剂从乳滴中扩散进入水相的速度减慢,微球固化随之减慢,包封率减小.
将离子按照其使蛋白质变性能力的大小排序,得到了霍夫梅斯特序列(Hofmeister series).盐离子不仅影响蛋白质胶体的稳定性,稀的盐溶液还可以增加或减小蛋白质的溶解度.在同等浓度下,按照对蛋白质的溶解度改变程度的大小排列,得到了相同的离子序列.另外,除了蛋白质溶液,离子对小分子或盐溶液的稳定性和溶解度,都有相同的序列[49].该序列如图1所示.
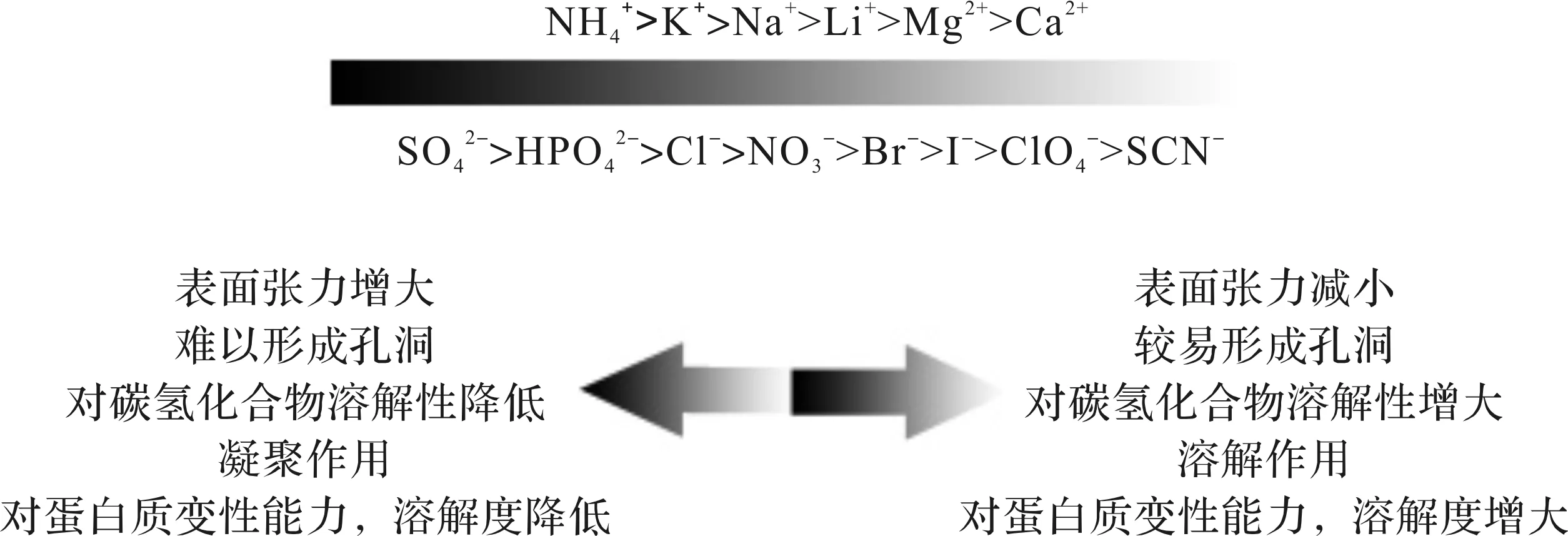
图1 霍夫梅斯特序列Fig.1 Hofmeister series
在对有机试剂在盐溶液的溶解度研究中,无机盐对各有机试剂的水溶性抑制程度通过霍夫梅斯特序列描述如下:苯(1/2 Na2SO4>NaCl>NaBr>NaClO4),氨和苯酚(1/2 Na2SO4>NaCl>NaBr),二丙酮醇(1/2 Na2SO4>NaCl>NaBr>NaSCN)[47].在制备小分子药物载体微球时,由于盐析作用,有机溶剂在水相中的溶解性降低,微球固化减慢,包封率随之减小.而在制备载蛋白质类微球时,盐析作用使包封率增大.王亚军等[50]报道盐离子可以作为酶蛋白的保护剂,加入非特异性结合的离子,与蛋白质带电基团和偶极子产生盐析作用,使酶的结构更加紧凑,达到稳定作用.故可在制备载蛋白微球时,通过加入盐类来提高包封率的同时,也能提高其稳定性.
3) 新盐的生成
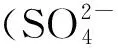

表2 硫酸奎尼丁在各盐溶液中的溶解度Table 2 Solubility of quinidine sulfate in each salt solution
2.3 其他提高微球包封率的办法
改变制备方法:喷雾干燥法,制得的微球的包封率可高达100%,有研究报道确定不同物料生产所适合的喷雾干燥塔捕粉结构,采用两级旋风加布袋捕粉,产品得率达100%,无损失[51];静电喷雾[52],该技术可一步成形,不需要额外添加模板或后处理步骤,药物的损失减少,包封率普遍高达90%;3D打印制备微球[53],以药物和载体材料溶于有机试剂的溶液为“打印油墨”,也可一步成形,另外,加入水溶性药物使外水相饱和,使用药物的饱和溶液也可减少药物在固化过程中的损失.
3 结 论
微球制剂具有广阔的应用前景,其载药范围包括小分子化药、蛋白质、多肽和核苷酸等,给药途径多,能减轻毒副作用、提高疗效和生物利用度等,能起到靶向作用,例如当微球粒径小于10 μm时,能被巨噬细胞和树突状细胞摄取[54],且定位在淋巴结[55].使用特定的载体材料或对材料进行修饰所制备得来的微球也能起到靶向作用,如带正电荷的壳聚糖与表面很多负电荷的肿瘤细胞,两者定向结合,使制剂具有靶向性[56].解决制备过程中包封率低这一主要问题对微球制剂的研发具有重要意义.药物在分散相和连续相这两相之间的分布状况决定了微球的包封率.笔者简述了影响乳化-溶剂挥发法制备微球的包封率的影响因素与机理,从渗透压、同离子效应、盐析作用和新盐的生成四个角度详细阐述了无机盐在提高微球包封率时发挥的作用,旨在微球的研究中,为解决包封率低下这一问题提供参考与建议.由于包封率受诸多因素的影响,故在实际操作中应全面考虑聚合物、药物、溶剂和工艺等多方面因素.相信鉴于微球制剂的诸多优点与发展潜力,未来的科学研究会充满无限可能与挑战.
参考文献:
[1] 崔福德.药剂学[M].第7版.北京:人民卫生出版社,2011:379-380.
[2] RUMA M, NILADRI S D, BHABANI S S, et al. Preparation and characterization of Tamoxifen citrate loaded nanoparticles for breast cancer therapy[J].International journal of nanomedicine,2014,9(1):3107-3118.
[3] TU L, HE Y, YANG H, et al. Preparation and characterization of alginate-gelatin microencapsulatedBacillussubtilisSL-13 by emulsification/internal gelation[J].Journal of biomaterials science polymer edition,2015,26(12):735-749.
[4] FILIPOVIC-GRCIC J, PERISSUTTI B, MONEGHINI M, et al. Spray-dried carbamazepine-loaded chitosan and HPMC microspheres: preparation and characterisation[J].Journal of pharmacy & pharmacology,2003,55(7):921-931.
[5] OZ U C, DEVRIM B, BOZKIR A, et al. Development of reconstitutable suspensions containing diclofenac sodium-loaded microspheres for pediatric delivery[J].Journal of microencapsulation,2015,32(4):317-328.
[6] 郎轶咏,王强.双氯芬酸钠壳聚糖-海藻酸钠微球的制备和性质[J].解放军药学学报,2014,30(1):48-51.
[7] MAO S, SHI Y, LI L, et al. Effects of process and formulation parameters on characteristics and internal morphology of poly(D,I-lactide-co-glycolide)microspheres formed by the solvent evaporation method[J].European journal of pharmaceutics & biopharmaceutics,2008,68(2):214-223.
[8] WISCHKE C, SCHWENDEMAN S P. Principles of encapsulating hydrophobic drugs in PLA/PLGA microparticles[J].International journal of pharmaceutics,2008,364(2):298-327.
[9] NAFEA E H, ELMASSIK M A, ELKHORDAGUI L K, et al. Alendronate PLGA microspheres with high loading efficiency for dental applications[J].Journal of microencapsulation,2007,24(6):525-538.
[10] TURINO L N, MARIANO R N, MENGATTO L N, et al.Invitroevaluation of suspoemulsions for in situ-forming polymeric microspheres and controlled release of progesterone[J].Journal of microencapsulation,2015,32(6):1-9.
[11] VILLANUEVA J R, BRAVOOSUNA I, HERREROVANRELL R, et al. Optimising the controlled release of dexamethasone from a new generation of PLGA-based microspheres intended for intravitreal administration[J].European journal of pharmaceutical sciences,2016,92:287-297.
[12] YANG C Y, TSAY S Y, TSIANG R C. An enhanced process for encapsulating aspirin in ethyl cellulose microcapsules by solvent evaporation in an O/W emulsion[J].Journal of microencapsulation,2000,17(3):269-277.
[13] YE C, CHI H. A review of recent progress in drug and protein encapsulation: approaches, applications and challenges[J].Materials science & engineering C,2018,83:233-246.
[14] 钦富华,蔡雁,计竹娃.喷雾干燥法制备天麻素壳聚糖微球[J].广东药科大学学报,2015,31(3):291-295.
[15] DAVIES O R, LEWIS A L, WHITAKER M J, et al. Applications of supercritical CO2in the fabrication of polymer systems for drug delivery and tissue engineering[J].Advanced drug delivery reviews,2008,60(3):373-387.
[16] 颜庭轩,王志祥,黄德春,等.超临界流体技术制备辛伐他汀/PLLA-PEG缓释复合微球[J].高校化学工程学报,2014,28(2):401-406.
[17] 查涛,宋林勇,周艺峰,等.非溶剂/溶剂界面诱导相分离法制备多孔磺化聚苯乙烯微球[J].应用化工,2015,44(8):1445-1448.
[18] BODMEIER R, MCGINITY J W. Polylactic acid microspheres containing quinidine base and quinidine sulphate prepared by the solvent evaporation technique. I. methods and morphology[J].Journal of microencapsulation,1987,4(4):279-288.
[19] 罗宇燕,成晓岚,郭喆霏,等.微球中聚乳酸羟基乙酸共聚物浓度与微球结构、释药、降解的关系研究[J].中国药房,2015(7):986-991.
[20] SAXENA V, SADOQI M, SHAO J. Indocyanine green-loaded biodegradable nanoparticles: preparation, physicochemical characterization andinvitrorelease[J].International journal of pharmaceutics,2004,278(2):293-301.
[21] ZOLNIKk B S, BURGESS D J. Evaluation ofinvivo-invitrorelease of dexamethasone from PLGA microspheres[J].Journal of controlled release,2008,127(2):137-145.
[22] HU L, ZHANG H, SONG W. An overview of preparation and evaluation sustained-release injectable microspheres[J].Journal of microencapsulation,2013,30(4):369-382.
[23] CHO M, SAH H. Formulation and process parameters affecting protein encapsulation into PLGA microspheres during ethyl acetate-based microencapsulation process[J].Journal of microencapsulation,2005,22(1):1-12.
[24] MJ B P, CAMPANERO M A, BESSEGHIR K, et al. Importance of single or blended polymer types for controlledinvitrorelease and plasma levels of a somatostatin analogue entrapped in PLA/PLGA microspheres[J].Journal of controlled release,2004,96(3):437-448.
[25] BUDHIAN A, SIEGEL S J, WINEY K I. Production of haloperidol-loaded PLGA nanoparticles for extended controlled drug release of haloperidol[J].Journal of microencapsulation,2005,22(7):773-785.
[26] GANG R, FENG S S, LI Q T. Effects of material hydrophobicity on physical properties of polymeric microspheres formed by double emulsion process[J].Journal of controlled release,2002,84(3):151-160.
[27] SIRSI S R, SCHRAY R C, WHEATLEY M A, et al. Formulation of polylactide-co-glycolic acid nanospheres for encapsulation and sustained release of poly(ethylene imine)-poly(ethylene glycol) copolymers complexed to oligonucleotides[J].Journal of nanobiotechnology,2009,7(1):1-12.
[28] 高颖,吴艺君,南开辉,等.吲哚美辛微球的制备及其包封率和释放性能[J].中国组织工程研究,2012,16(12):2212-2216.
[29] RAMAZANI F, CHEN W, VAN NOSTRUM C F, et al. Formulation and characterization of microspheres loaded with imatinib for sustained delivery[J].International journal of pharmaceutics,2015,482(1/2):123-130.
[30] XUAN J, LIN Y, HUANG J, et al. Exenatide-loaded PLGA microspheres with improved glycemic control:invitrobioactivity andinvivopharmacokinetic profiles after subcutaneous administration to SD rats[J].Peptides,2013,46(14):172-179.
[31] 徐红,高萌,关欣,等.槲皮素PLGA-TPGS纳米粒处方筛选及体外稳定性[J].医药导报,2018,37(3):345-350.
[32] FREYTAG T, DASHEVSKY A, TILLMAN L, et al. Improvement of the encapsulation efficiency of oligonucleotide-containing biodegradable microspheres[J].Journal of controlled release,2000,69(1):197-207.
[33] VLUGT WENSINKAB K D F, MEIJER Y J, VAN STEENBERGEN M J V, et al. Effect of excipients on the encapsulation efficiency and release of human growth hormone from dextran microspheres[J].European journal of pharmaceutics & biopharmaceutics,2007,67(3):589-596.
[34] FU X, PING Q, GAO Y. Effects of formulation factors on encapsulation efficiency and release behaviourinvitroof huperzine A-PLGA microspheres[J].Journal of microencapsulation,2005,22(1):57-66.
[35] RAWAT A, BURGESS D J. Effect of ethanol as a processing co-solvent on the PLGA microsphere characteristics[J].International journal of pharmaceutics,2010,394(1/2):99-105.
[36] JARASWEKIN S, PRAKONGPAN S, BODMEIER R. Effect of poly(lactide-co-glycolide) molecular weight on the release of dexamethasone sodium phosphate from microparticles[J].Journal of microencapsulation,2007,24(2):117-128.
[37] WISCHKE C, ZHANG Y, MITTAL S, et al. Development of PLGA-based injectable delivery systems for hydrophobic fenretinide[J].Pharmaceutical research,2010,27(10):2063-2074.
[38] AL-MAAIEH A, FLANAGAN DR. Salt and cosolvent effects on ionic drug loading into microspheres using an O/W method[J].Journal of controlled release,2001,70(1):169-181.
[39] LUAN X, SKUPIN M, SIEPMANN J, et al. Key parameters affecting the initial release(burst) and encapsulation efficiency of peptide-containing poly(lactide-co-glycolide) microparticles[J].International journal of pharmaceutics,2006,324(2):168-175.
[40] RAMAZANI F, CHEN W, VAN NOSTRUM C F, et al. Strategies for encapsulation of small hydrophilic and amphiphilic drugs in PLGA microspheres: state-of-the-art and challenges[J].International journal of pharmaceutics,2016,499(1-2):358-367.
[41] RAVI S, PEH K K, DARWIS Y, et al. Development and characterization of polymeric microspheres for controlled release protein loaded drug delivery system[J].Indian journal of pharmaceutical sciences,2008,70(3):303-309.
[42] QIN F, WU J, FAN Q Z, et al. Preparation of uniform-sized exenatide-loaded PLGA microspheres as long-effective release system with high encapsulation efficiency and bio-stability[J].Colloids & surfaces b, biointerfaces,2013,112(12):492-498.
[43] MANOHARAN C, SINGH J. Insulin loaded PLGA microspheres: effect of zinc salts on encapsulation, release, and stability[J].Journal of pharmaceutical sciences,2009,98(2):529-542.
[44] AL-MAAIEH A, FLANAGAN D R. New drug salt formation in biodegradable microspheres[J].International journal of pharmaceutics,2005,303(1/2):153-159.
[45] HE J T, TAO X M, MO W, et al. Preparation and characterization of PLGA microspheres containing a staphylokinase variant(K35R)[J].Acta pharmaceutica sinica,2006,41(1):12-18.
[46] 周香莲,贺进田,周志涛,等.外水相中NaCl对S/O/W法制备的牛血清白蛋白PLGA缓释微球性质的影响[J].药学学报,2010,45(8):1057-1063.
[47] LONG F A, MCDEVIT W F. Activity coefficients of nonelectrolyte solutes in aqueous salt solutions[J].Chemical reviews,1952,51(1):119-169.
[48] BRENDEL M L, SANDLER S I. The effect of salt and temperature on the infinite dilution activity coefficients of volatile organic chemicals in water[J].Fluid phase equilibria,1999,165(1):87-97.
[49] COLLINS K D, WASHABAUGH M W. The Hofmeister effect and the behaviour of water at interfaces[J].Quarterly reviews of biophysics,1985,18(4):323-422.
[50] 王亚军,曹块.添加剂提高酶稳定性研究进展[J].发酵科技通讯,2016,45(3):188-192.
[51] 刘殿宇.喷雾干燥连续生产的条件[J].发酵科技通讯,2015,44(3):37-39.
[52] BOHR A, KRISTENSEN J, STRIDE E, et al. Preparation of microspheres containing low solubility drug compound by electrohydrodynamic spraying[J].International journal of pharmaceutics,2011,412(1/2):59-67.
[53] LEE B K, YUN Y H, JI S C, et al. Fabrication of drug-loaded polymer microparticles with arbitrary geometries using a piezoelectric inkjet printing system[J].International journal of pharmaceutics,2012,427(2):305-310.
[54] SINGH M, O’HAGAN D. Advances in vaccine adjuvants[J].Nature biotechnology,1999,17(11):1075-1081.
[55] MEN Y, TAMBER H, AUDRAN R, et al. Induction of a cytotoxic T lymphocyte response by immunization with a malaria specific CTL peptide entrapped in biodegradable polymer microspheres[J].Vaccine,1997,15(12/13):1405-1412.
[56] 王浩.壳聚糖及其衍生物在医药领域的应用研究进展[J].发酵科技通讯,2015,44(1):58-61.
