植物激素对微拟球藻油脂及二十碳五烯酸积累的影响
2018-07-06,,,,,,,
, ,,,, , ,
(1.青岛琅琊台集团股份有限公司,山东 青岛 266400;2.中国科学院青岛生物能源与过程研究所,山东 青岛 266101;3.黄岛出入境检验检疫局,山东 青岛 266400;4.青岛市黄岛区食品药品监督管理局,山东 青岛 266400)
二十碳五烯酸(C20∶5,n-3,EPA),是一种ω-3多不饱和脂肪酸,具有重要的生理功能,已被广泛应用于食品、医药等行业[1-2].由于生物法生产EPA具有培养周期短、不受季节和来源限制等特点,受到国内外学者的广泛关注[3].微拟球藻是一种重要的海产经济微藻,其脂肪酸组成简单,富含EPA,已在中国、日本和澳大利亚等国家实现了大规模养殖[4].然而,在自养培养条件下,微拟球藻的生长缓慢,油脂及EPA的产率较低,因此,提高在大规模培养中的生产效率,降低生产成本是本行业急需克服的关键问题[5-7].除改善培养条件,添加促生长、促油脂积累的物质外,改变微藻培养方式也是可行的方案,目前已有学者开始尝试密闭管道式培养与异养发酵培养方式[6],一旦有所突破,必将大大提高我国微拟球藻的产业化水平.目前微拟球藻已经成为工业化生产EPA的最佳藻株,然而,产量低和成本高仍然是利用微拟球藻大规模生产EPA的瓶颈.因此提高在大规模生产中的效率,降低成本,成为本领域的研究热点[8-9].植物激素是一类能以极低的浓度来调节植物的生理过程的微量活性物质,目前已发现的植物激素主要有细胞分裂素、生长素、赤霉素、乙烯和落叶酸5类,以及水杨酸、茉莉酸类物质、油菜素甾醇和多胺等新型植物激素[10].许多植物激素能够在大规模的微藻培养中改善高价值生物制品的积累.刘飞等发现萘乙酸可以提高小球藻的生长,对蛋白质、单糖、叶绿素a和b、总类胡萝卜素等必需代谢物的含量有积极的影响[11].杨青等发现在适宜的浓度条件下,6种植物激素都能不同程度地提高裂壶藻的生长速度和DHA含量,但是浓度过高会产生抑制作用[12].
笔者研究了赤霉素(GA)、脱落酸(ABA)、细胞分裂素6-苄基腺嘌呤(BA)、糠基腺嘌呤(KT)、细胞生长素吲哚乙酸(IAA)和吲哚丁酸(IBA)6种植物激素对微拟球藻生长与EPA产量的影响,并初步探讨其提高油脂产量的背后机理,为利用植物激素提高微拟球藻生产EPA提供了实验依据和理论基础.
1 材料与方法
1.1 藻种与培养条件
本实验藻种来源于经重离子诱变得到的EPA高产藻株,微拟球藻NannochloropsisoceanicaM44,培养基为BG -11海水培养基,培养温度25 ℃,光强为150 μmol/(m2·s).
1.2 植物激素的添加
种子在25 ℃,200 r/min条件下培养2 d,然后按体积分数10%的接种量接到摇瓶培养基中,并在摇瓶中添加不同质量浓度的植物激素.6种植物激素的添加量为0,1,3,6,10,15,20 mg/L,25 ℃,200 r/min条件下培养8 d.每个实验设3个平行,重复2次.
1.3 细胞干重、含油率及脂肪酸组成的测定
1.3.1 细胞干重测定
培养物经8 000g离心10 min后,弃上清,加入等体积去离子水洗涤1次,-40 ℃真空冷冻干燥48 h,称其干质量.生物量=干质量(g)÷培养物体积(L).
1.3.2 脂质提取、薄层色谱(TLC)和脂肪酸组成分析
脂质提取和脂肪酸甲酯化参照文献方法并作适当改进[13].脂质提取步骤:首先称取100 mg的藻粉到2 mL离心管里,加入600 μL 6 mol/L盐酸,振荡混匀,室温放置30 min.沸水煮沸10 min,-80 ℃冻存5 min,此过程重复2次.加入900 μLV(氯仿)∶V(甲醇)=2∶1的溶液,漩涡振荡15 s,12 000 g离心5 min,取下层液相到另一个2 mL离心管中,加入等体积的饱和NaCl,漩涡振荡15 s,12 000g离心5 min,将下层液相转移到已经称重好的玻璃小瓶中,50 ℃真空干燥至恒重,称量.含油率=油脂质量(g)÷藻粉质量(g)×100%.
薄层色谱(TLC)分析油脂组成变化实验根据参考文献[13]方法,中性脂展层剂组分为V(正己烷)∶V(乙醚)∶V(乙酸)=70∶30∶1.
脂肪酸甲酯化步骤:称重完成后,在玻璃小瓶中加入1 mL氯仿和2.5 mLV(硫酸)∶V(甲醇)=1∶50的溶液,并压盖,在85 ℃下甲酯化反应2.5 h,获得脂肪酸甲酯(FAME).冷却后加入1 mL饱和NaCl混匀,加入1 mL正己烷振荡混匀后静止分层,吸取上层液相至色谱瓶中.使用装有HP-INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm)的气相色谱(Agilent Technologies,7890B)进行分析[14].柱箱温度设定为100 ℃保持1 min,以每分钟15 ℃的速度升温至250 ℃,然后在250 ℃下保持5 min.分流比为1∶19,载气为氮气.进样体积为1 uL.峰值检测用火焰离子化检测器(FID),检测器和进样口的温度为280 ℃.
1.4 油脂相关基因的表达检测
通过实时定量PCR进一步检测油脂合成相关基因的表达水平.根据基因组测序数据设计引物序列(表1).使用试剂盒RNeasy Mini Kit(QIAGEN,Germany)提取总RNA.使用Revert Aid First Strand cDNA Synthesis Kit(Thermo scientific)逆转录试剂盒逆转录总RNA.反转录的体系:5 μg总RNA,1 μL Oligo dT,1 μL 随机引物,4 μL 5×buffer,1 μL RiboLock RNase Inhibitor,1 μL Revert Aid Reverse Transcriptase,用RNAase free water补齐20 μL体系.25 ℃,5 min;42 ℃,1 h;70 ℃, 5 min.

表1 实时定量PCR引物序列1)Table 1 The primer sequences of RT-qPCR
注:1) 18 s为18S rDNA;Fas为脂肪酸合酶;Δ5,Δ6,Δ9,Δ12为Δ5,Δ6,Δ9,Δ12去饱和酶;Acc为乙酰辅酶A羧化酶;Dgat为二酰甘油酰基转移酶;EL1,EL2为延长酶1和延长酶2.
在LightCycler R480实时检测系统(Roche)进行qPCR反应.反应体系:10 μL FastStart Universal SYBR Green Master(ROX),1 μL qRT-PCR正向引物,1 μL qRT-PCR反向引物,9 μL 50×cDNA.在LightCycler R480实时检测系统(Roche)中进行qPCR,并用扩增产物的融合曲线分析以确认扩增的特异性.最后以18S rRNA作为内参,使用CT方法(2-ΔΔCT)分析计算基因表达差异.所有反应一式三份,数据用内标平均值标准化.
2 实验结果
2.1 植物激素对微拟球藻生长及油脂合成的影响
不同质量浓度的6种植物激素对微拟球藻生长及油脂积累的影响,如图1所示.在适宜的质量浓度条件下,6种植物激素均能促进微拟球藻的生长,在不同程度上提高微拟球藻的生物量以及油脂和EPA的产量,而在质量浓度过高时抑制微拟球藻生长,这符合植物激素在低浓度时促进生长、高浓度时抑制生长的规律.表2中详细说明了每种植物激素在最佳质量浓度下对微拟球藻生长以及油脂和EPA积累的促进效果,其中添加20 mg/L IBA时油脂质量分数最多提高20.94%,其次是质量浓度为15 mg/L的BA,油脂质量分数提高了20.27%.同时,当BA在质量浓度为15 mg/L时,EPA质量分数最多提高29.50%.综合两项指标,6-苄基腺嘌呤(BA)对微拟球藻的生长以及油脂和EPA的产量影响最大,最佳添加量为15 mg/L.而脱落酸(ABA)效果最差,油脂和EPA质量分数只分别提高了8.14%和3.78%.
表2最佳质量浓度下植物激素对微拟球藻油脂和EPA产量的影响
Table2TheeffectsofplanthormonesonthelipidandEPAyieldofNannochloropsisoceanicaM44undertheoptimumconcentration

植物激素名称最佳添加量/(mg·L-1)油脂产量提高百分比/%EPA产量提高百分比/%KT118.0620.52BA1520.2729.50GA315.2919.79ABA158.143.78IAA1019.4222.05IBA2020.9413.87
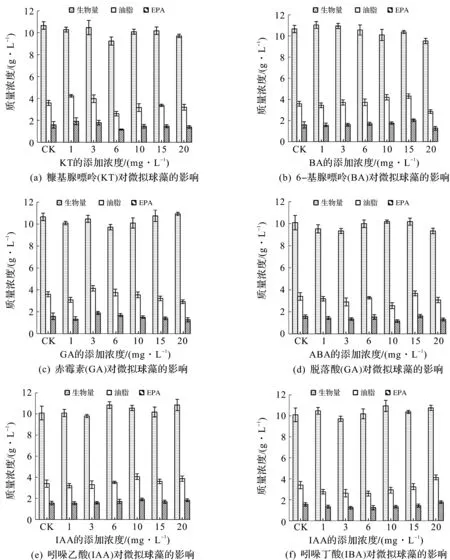
图1 不同植物激素对微拟球藻生长以及油脂和EPA产量的影响Fig.1 The effects of different plant hormones on the growth, lipid and EPA yield of Nannochloropsis oceanica M44
2.2 植物激素对微拟球藻油脂及脂肪酸组成的影响
利用薄层色谱分析6种激素对微拟球藻油脂组成的影响发现,与对照相比,添加植物激素后油脂组成没有发生显著变化,都是以甘油三酯(TAG)为主要的油脂储存形式,但从图2中看出:添加植物激素后TAG的量明显高于对照组.
从表3中看出:添加植物激素后微拟球藻脂肪酸的组成并没有发生变化.脂肪酸合成途径中积累比较多的仍是棕榈酸(C16∶0)、棕榈油酸(C16∶1)、硬脂酸(C18∶0)、油酸(C18∶1)和二十碳五烯酸(C20∶5,EPA).EPA的含量占总脂肪酸的40%以上.
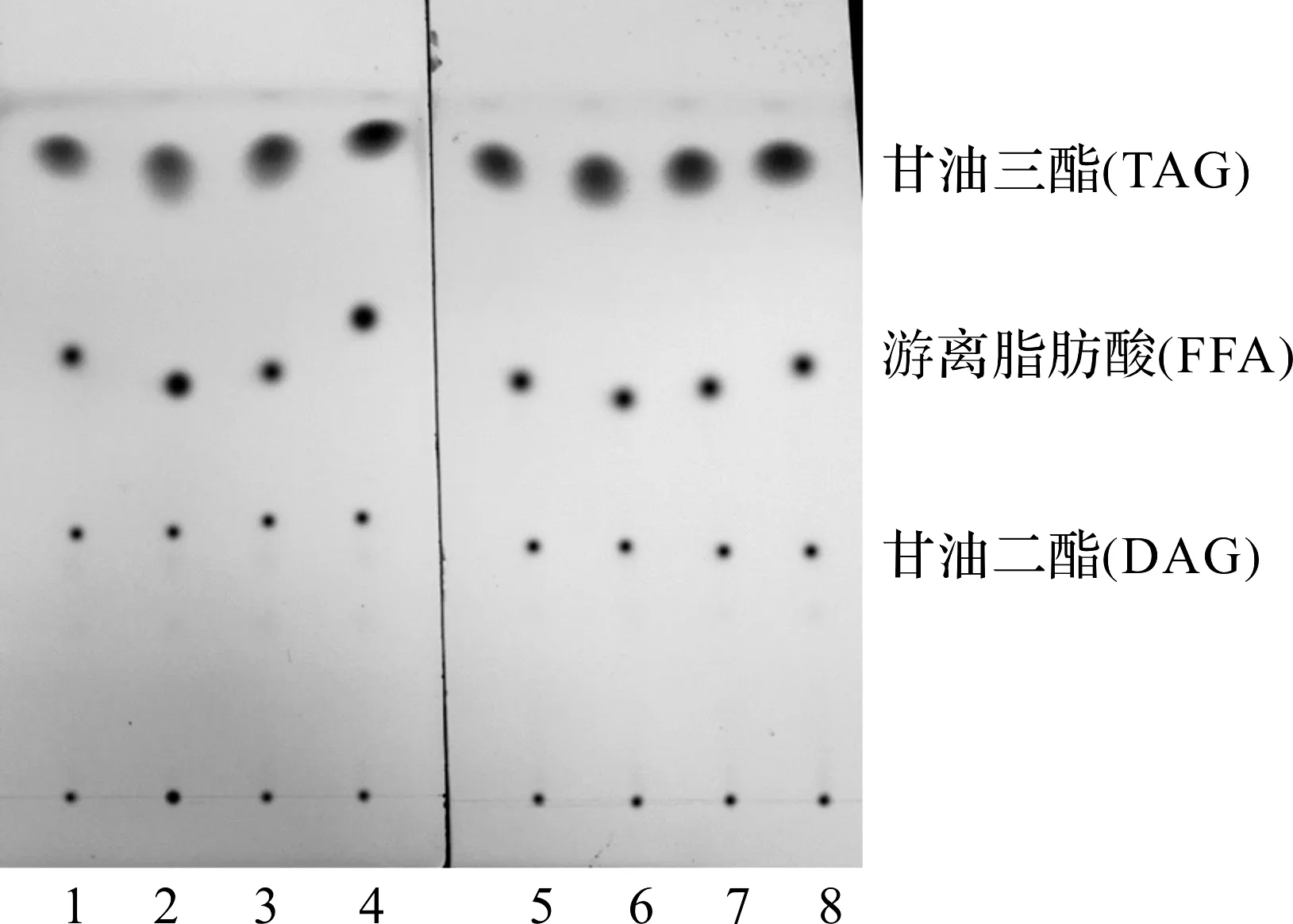
Lane 1,5—对照组;Lane 2~4,6~8—KT1,BA15,GA3,ABA15,IAA10,IBA20图2 薄层色谱分析6种激素对微拟球藻油脂组成的影响Fig.2 TLC analysis of the effects of plant hormones on the lipid composition of Nannochloropsis oceanica M44

脂肪酸总脂肪酸质量分数/%CKKT1BA15GA3ABA15IAA10IBA20C14∶08.34±0.117.24±0.175.01±0.085.84±0.115.18±0.085.22±0.125.05±0.09C16∶018.34±0.1519.16±0.4117.07±0.2718.85±0.2817.63±0.0717.40±0.6116.80±0.85C16∶1Δ99.61±0.119.25±0.1510.28±0.099.77±0.2310.34±0.479.78±0.1810.79±0.69C18∶04.51±0.284.90±0.324.68±0.104.99±0.386.38±0.155.47±0.496.29±0.14C18∶1Δ98.18±0.177.79±0.038.74±0.217.78±0.399.53±0.258.18±0.5511.17±1.13C18∶2Δ9,123.40±0.103.57±0.153.74±0.013.75±0.213.65±0.043.67±0.053.43±0.08C20∶4Δ5,8,11,143.11±0.032.92±0.362.88±0.292.92±0.133.01±0.012.97±0.033.12±0.05C20∶5Δ5,8,11,14,17(EPA)44.25±0.3845.17±0.2247.52±0.1945.97±0.1444.05±1.4446.91±0.3743.22±0.64
2.3 植物激素对微拟球藻油脂合成相关基因转录水平的影响
为了阐明植物激素促进微拟球藻油脂及EPA产量增加的分子机制,笔者选取了脂肪酸及油脂合成过程中起重要作用的各个关键酶[15]:乙酰辅酶A羧化酶(ACC)、脂肪酸合酶(Fas)、脂肪酸延长酶1(EL1)和延长酶2(EL2)、脂肪酸去饱和酶(Δ5,Δ6,Δ9,Δ12去饱和酶)以及二酰甘油酰基转移酶(DGAT),研究添加不同植物激素(选取对油脂合成影响最显著的糠基腺嘌呤(KT),6-苄基腺嘌呤(BA),吲哚乙酸(IAA))后,它们各自转录水平的变化.通过定量PCR结果分析发现(图3):从转录水平上看,添加BA时各基因转录水平变化最大,其中Δ9去饱和酶、FAS和DGAT转录水平分别提高了9.3,9.6,7.7倍,其次为IAA,Δ9去饱和酶、FAS和DGAT转录水平分别提高了2.1,8.9,2.7倍.这说明BA和IAA对微拟球藻油脂合成的影响是一致的,两者都通过影响Fas的转录水平提高了软脂酸C16∶0的合成,再通过影响去饱和酶及DGAT的转录水平增加了TAG的合成.
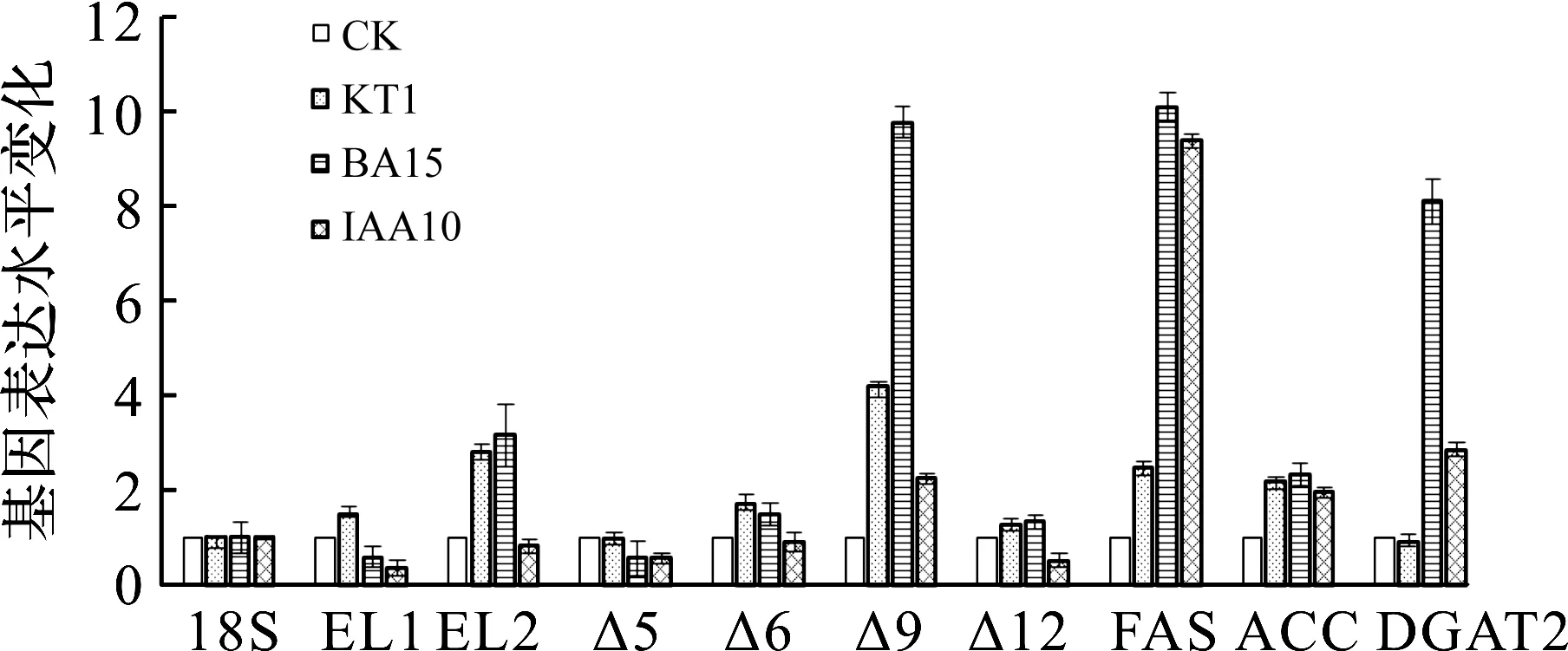
CK—对照组;KT1—1 mg/L糠基腺嘌呤;BA15—15 mg/L6-苄基腺嘌呤;IAA10—10 mg/L吲哚乙酸 图3 3种植物激素对微拟球藻油脂合成关键基因转录水平的影响 Fig.3 The effects of plant horones on the gene transcriptions of lipid synthesis in Nannochloropsis oculata M44
而KT对微拟球藻油脂合成的影响与BA和IAA不同,主要通过增强脂肪酸延长及去饱和途径关键酶的转录水平来实现增加油脂产量的目的,表现为延长酶2、Δ9去饱和酶、Fas的转录水平分别提高了2.7,4.0,2.4倍.
3 结 论
植物激素对细胞生长发育的调控一般通过调控细胞分裂、细胞分化、胞内代谢和环境胁迫响应机制等方式实现[16-17].不同的激素有可能通过调控相同的下游基因的表达来控制相同生理过程[18].本研究证实植物激素对微拟球藻的影响主要是集中在对微拟球藻油脂合成途径的改变上,BA和IAA通过影响Fas的转录水平提高了脂肪酸合成的总量,增加了油脂合成的底物供应,再通过增加DGAT的转录水平,促进了甘油三酯的合成,增加了细胞中油脂的产量.而KT对油脂合成的影响与BA和IAA不同,主要是影响脂肪酸延长及去饱和途径的活力,通过增加软脂酸向下游脂肪酸的持续转化来推动油脂的合成过程.
参考文献:
[1] DEACON G, KETTLE C, HAYES D, et al. Omega 3 Polyunsaturated fatty acids and the treatment of depression[J].C R C Critical reviews in food technology,2017,57(1):212-223.
[2] 李恒,蒋慧,张澜,等.海洋小球藻粉膳食干预对糖尿病小鼠降血糖及抗氧化作用[J].发酵科技通讯,2016,45(3):152-156.
[3] KHOZINGOLDBERG I, LEU S, BOUSSIBA S. Microalgae as a source for VLC-PUFA production[J].Sub-cellular biochemistry,2016,86:471.
[4] HORNER R A. Robert A. Andersen algal culturing techniques 2005 elsevier academic press oxford 450 pp[J].Harmful algae,2006,5(5):620-621.
[5] CHEIRSILP B, TORPEE S. Enhanced growth and lipid production of microalgae under mixotrophic culture condition: effect of light intensity, glucose concentration and fed-batch cultivation[J].bioresource technology,2012,110(2):510-516.
[6] 张琴,王贤贤,张姗姗.用于生物制氢和生物燃料的工程藻类的研究进展[J].发酵科技通讯,2012,41(3):55-58.
[7] 张琴,张姗姗,王贤贤.微生物生产可再生生物能源的优势[J].发酵科技通讯,2011,40(3):27-30.
[8] POLISHCHUK A, VALEV D, TARVAINEN M, et al. Cultivation ofNannochloropsisfor eicosapentaenoic acid production in wastewaters of pulp and paper industry[J].Bioresource technology,2015,193(1):469-476.
[9] WU L F, CHEN P C, CHIMEI L, et al. The effects of nitrogen sources and temperature on cell growth and lipid accumulation of microalgae[J].International biodeterioration & biodegradation,2013,85(7):506-510.
[10] 汪芳俊,侯赛男,徐年军,等.藻类植物激素研究进展[J].植物生理学报,2015(12):2083-2090.
[11] 刘飞,王超,王振瑶,等.植物激素诱导对小球藻Chlorellavulgaris细胞生物量和油脂合成积累的影响[J].中国生物制品学杂志,2017,30(4):390-394.
[12] 杨青,宋益民,范鸣浩,等.植物激素对裂殖壶菌生长与DHA含量的影响[J].中国海洋大学学报(自然科学版),2011,41(12):53-57.
[13] 兰君,谭延振,宋晓金,等.裂殖壶菌SD116油脂的胞内核磁共振研究[J].生物物理学报,2014,30(3):193-206.
[14] 兰君,宋晓金,谭延振,等.利用伯克霍尔德氏菌脂肪酶富集裂壶藻油脂中的二十二碳六烯酸[J].食品科学,2015,36(1):128-134.
[15] XIAO Y, ZHANG J, CUI J, et al. Simultaneous accumulation of neutral lipids and biomass inNannochloropsisoceanica, IMET1 under high light intensity and nitrogen replete conditions[J].Algal research,2015,(11):55-62.
[16] 徐玉华,唐璐敏.微生物甾体C(11)羟化反应的研究现状[J].发酵科技通讯,2014,43(4):30-34.
[17] WOLTERS H, JüRGENS G. Survival of the flexible: hormonal growth control and adaptation in plant development[J].Nature reviews genetics,2009,10(5):305.
[18] SANTNER A, CALDERON-VILLALOBOS L, ESTELLE M. Plant hormones are versatile chemical regulators of plant growth[J].Nature chemical biology,2009,5(5):301-307.
