黄鳝醛酮还原酶的定点突变及对其酶活性的影响
2018-07-06阚延泽孙文秀
阚延泽, 孙文秀, 李 伟
(长江大学生命科学学院,湖北 荆州 434025)
醛酮还原酶(AKR)是一类依赖NADH/NADPH作为辅酶将醛酮类物质还原为相应醇类物质的氧化还原酶[1-2]。它们在生物界广泛分布,植物、动物和微生物中均有报道[3]。已知的醛酮还原酶数量众多,包括16个家族近200个成员[4]。序列比对分析发现醛酮还原酶之间具有一定的序列同源性,都具有一个典型的(α/β)8桶状结构[5]。其中,醛酮还原酶负责底物催化的关键氨基酸一般由相对保守的催化四联体(D-Y-K-H)组成[6-7]。醛酮还原酶底物广泛,包括醛酮类化合物、芳香类化合物、醛糖和类固醇等[3-4]。每个醛酮还原酶家族都有其特异性底物,同时在机体内行使独特的生物学功能,例如AKR7家族可以降解致癌羰基化合物,在生物体内参与机体的保护和防御[8];AKR1C亚家族具有代谢人体性激素的能力,参与人体激素代谢和调节[9-10];醛糖还原酶(AR)通过将葡萄糖催化还原成山梨醇,同时减轻果糖和山梨醇在周围组织细胞中的过多积累,从而达到抑制糖尿病的功能[11-12]。代海艳等[13]重组表达了黄鳝醛酮还原酶基因Eakr,发现含该重组基因的菌株比野生菌株抗羰基化合物胁迫的能力增强。除此之外,国内外对鱼类醛酮还原酶基因及功能的研究相对匮乏。仅有少数罗非鱼醛酮还原酶AKR1A1羰基解毒作用的报道[14]。黄鳝醛酮还原酶Eakr的氨基酸序列与已报道的所有醛酮还原酶家族成员同源性均小于25%,且其催化四联体氨基酸为D-Y-A-H,这与其他已知醛酮还原酶的催化四联体存在一个氨基酸的差别。本研究拟通过将黄鳝Eakr第81位丙氨酸(A)进行定点突变为赖氨酸(K),分析突变蛋白EakrA81K的底物谱,比较野生型(Eakr)和突变型蛋白(EakrA81K)对不同代谢底物的活性变化,为深入了解黄鳝醛酮还原酶Eakr的功能及其催化四联体在底物识别上的作用提供重要的参考资料。
1 材料与方法
1.1 试验材料与试剂
BL21(DE3)菌株购于北京全式金生物技术有限公司。含pET-28a-Eakr的BL21(DE3)菌株,含pET-28a (+)空白质粒的BL21(DE3)菌株,均由本实验室构建并保存于长江大学生物医药研究所。Ni离子亲和层析柱购于上海七海复泰生物技术有限公司。质粒提取试剂盒购自北京天根生化有限公司。DNA凝胶回收试剂盒、PfuDNA聚合酶购自北京全式金生物技术有限公司。酶反应底物丙酮醛、苯甲醛、反式丁烯醛购自上海阿拉丁生化技术股份有限公司。3-戊酮、2,3-戊二酮、2,4-戊二酮购自上海麦克林生化技术有限公司,其他试剂均为国产分析纯。
1.2 黄鳝Eakr基因A81K位点的定点突变
用快速质粒DNA中量提取试剂盒,从含pET-28a-Eakr质粒的BL21(DE3)菌中提取质粒DNA。用突变引物对F1:5′-GCCGAATTCATGCCTGTGGTTCCCAAAG-3′和Rm:5′-TCTGCACAGCTGGTGCCTTATCTCCAGAGGACT-3′扩增突变位点及上游片段;用突变引物对Fm:5′-AAGTCCTCTGGAGATAAGGCACCAGCTGTGCAGAG-3′和R1:5′-CCGAAGCTTTTAGCTCCTGTACTATCGC-3′扩增突变位点及下游片段。引物中突变位点碱基用斜体标出,酶切位点用下划线标出。将第1次PCR扩增产物回收、纯化后等量混匀,利用F1和R1引物进行重叠PCR扩增。每次PCR扩增均采用Tran Start Fast Pfu DNA Polymerase高保真DNA聚合酶以降低错义突变。扩增产物经回收、纯化后连接T载体后转入大肠杆菌DH5α中,送上海铂尚生物技术公司进行序列测定。
1.3 表达载体构建及重组蛋白表达及纯化
提取经测序验证过的质粒DNA,采用限制内切酶EcoRⅠ、Hind Ⅲ进行双酶切。酶切产物经电泳、回收后纯化,并连接到同样双酶切的pET-28a(+)中。将连接产物转化到E.coliBL21(DE3)感受态细胞中,经卡纳霉素抗性筛选、菌落PCR验证及SDS-PAGE电泳检测获得阳性表达菌株。
将野生型和突变型阳性重组菌按 1∶50分别接种到200 ml 新鲜LB培养基,200 r/min培养至OD600约为0.6时,加入终浓度为0.1 mmol/L的IPTG诱导,37 ℃诱导培养4 h,将诱导表达完成后的菌液在4 ℃ 10 000 r/min条件下离心15 min,弃上清液,收集菌体加入PBS(pH8.5)洗涤菌体,重悬后,用超声波破碎菌体细胞(工作5 s,间隔15 s,工作80次);将细胞破碎液在4 ℃、10 000 r/min离心15 min,弃上清液,收集沉淀,加入适量PBS 缓冲液(pH=8.5,50 mmol/L,含6 mol/L盐酸胍)重悬,于4 ℃中静置1 h以上去除包涵体,再次离心,收集上清液经0.45 μm滤膜过滤后加入镍离子亲和层析柱中结合12 h,用不同咪唑浓度(20 mmol/L,100 mmol/L,200 mmol/L,300 mmol/L)的PBS缓冲液进行梯度洗脱,洗脱液收集装入透析袋中,密封后于4 ℃透析过夜,收集透析后进行12%的SDS-PAGA电泳检测。
1.4 EakrA81K酶活性检测及底物特异性分析
利用普析通用公司TU-1900紫外分光光度计测定还原型辅酶NADPH在340 nm处吸光值的变化来评价Eakr和EakrA81K的活性。酶活性单位定义为:醛酮还原酶在最适条件下1 min消耗1 μmol的NADPH为1个酶活性单位(U)。取比色皿,依次加入1 000 μl 50.0 mmol/L PBS(pH=5.0),50 μl酶液,850 μl底物(约10.0 mmol/L),80 μl甲醇,37 ℃保温10 min后,加入20 μl 0.1 mmol/LNADPH,总体系为2 ml,将比色皿放入紫外分光光度计中,测定340 nm处吸光值的变化并记录,每个底物重复3次。酶活性计算按照Chen等[15]报道的方法进行,米氏常数(Km)和催化常数(kcat)参照文献[16]计算。
按照上述方法,分别测量Eakr和EakrA81K重组蛋白对苯甲醛、邻苯二甲醛、甲醛、戊二醛、反式丁烯醛、甘油醛、2,3-丁二酮、丙酮、醋酸甲羟孕酮、蒽酮、黄体酮、甲睾酮、甲酸、戊酸雌二醇、2-戊酮、3-戊酮、2,3-戊二酮、2,4-戊二酮、葡萄糖等底物的酶活性。
1.5 野生型与突变型蛋白的温度及pH耐受性分析
在标准反应体系中,取等量野生型与突变型蛋白分别与甲醛(10 mmol/L)混匀后在不同温度(10 ℃, 20 ℃,30 ℃,35 ℃,37 ℃,40 ℃,50 ℃)静置3 min或在不同pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5)的PBS缓冲溶液中静置3 min测定其相对酶活性,以其最适反应温度或最适pH下的相对酶活性为100%,每个处理重复3次。
1.6 数据处理及分析
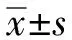
2 结果与分析
2.1 黄鳝醛酮还原酶基因的定点突变
通过引物对Fm和R1及引物对F1和Rm PCR扩增后分别得到了1条约750 bp的条带和1条约250 bp的条带,大小与预期相符(图1a);将上述PCR片段回收纯化后等量混合进行重叠PCR反应,得到了1条特异的分子量约1 000 bp的条带(图1b),证明重叠PCR已经成功实现了上下游基因片段的融合。将上述重叠PCR片段经过回收、纯化克隆测序后得知,黄鳝Eakr基因的第81号位氨基酸对应的碱基已经由原来的GCT突变成了AAG,其对应氨基酸也已由丙氨酸(A)突变成赖氨酸(K);除此以外,测序结果表明,该突变基因没有产生其他错义突变。
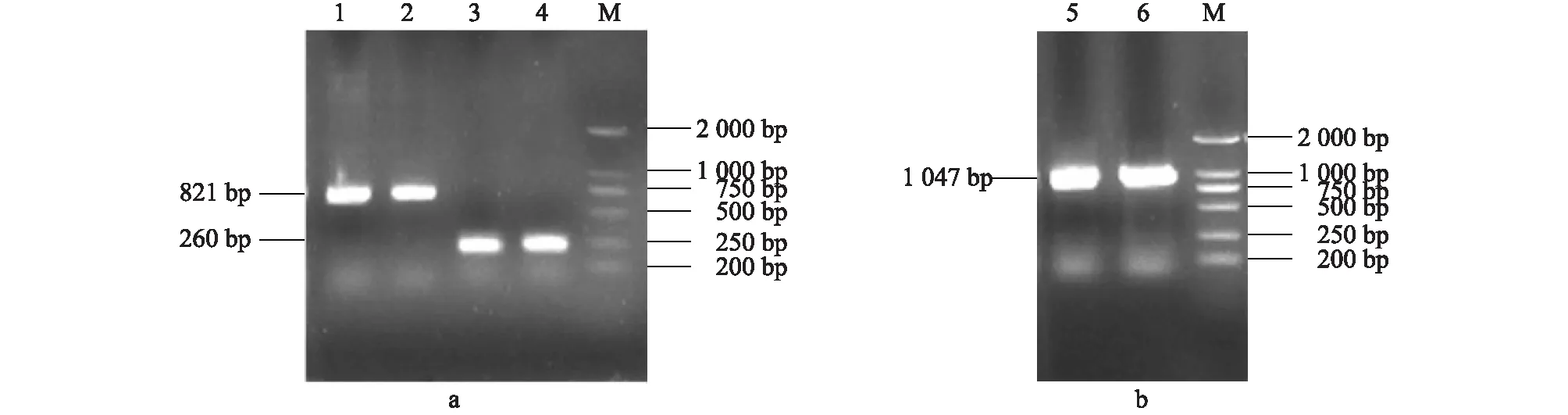
泳道1~2:扩增的下游片段;3~4:扩增的上游片段;5~6:扩增的重叠片段;M:DNA分子量标准。图1 重叠 PCR扩增突变基因电泳Fig.1 Electrophoresis of the gene mutation products from SOE-PCR amplification
2.2 重组蛋白EakrA81K的纯化
将含有pET-EakrA81K的重组菌株经过0.1 mmol/L IPTG诱导后,表达了1条分子量约38 000的蛋白,这表明阳性重组子成功实现了融合表达;EakrA81K蛋白约占大肠杆菌总蛋白的40%以上,通过Ni离子亲和层析,实现了突变体蛋白EakrA81K的纯化(图2)。

1:空白质粒菌株;2:诱导前的含pET-28-EakrA81K菌株;3:诱导后的含pET-28-EakrA81K菌株;4:20 mmol咪唑洗脱后蛋白;5:100 mmol咪唑洗脱蛋白;6:200 mmol咪唑洗脱蛋白;M:蛋白质分子量标准。图2 重组EakrA81K蛋白的SDS-PAGE电泳Fig.2 SDS-PAGE electrophoresis of EakrA81K protein
2.3 重组蛋白EakrA81K的底物特异性及酶动力学常数
以NADPH为辅酶,检测重组蛋白EakrA81K对醛、酮类物质的还原活性。结果表明:该重组蛋白对所测醛类物质及中长链酮类物质具有良好的还原活性,但对醇、糖、酸类物质酶活性极低或未检测到(表1)。其中,对3-戊酮活性最高,其酶比活力约0.882 U/mg。在所测底物中,重组蛋白EakrA81K与醛类物质的米氏常数(Km)均低于酮类物质,说明该酶和醛类物质的亲和力更高。甲醛的米氏常数最低(2.957 mmol/L),说明所测底物中甲醛和EakrA81K结合效率最高。同时,随着底物碳原子数目的增加,底物的米氏常数值也随之升高,结合效率降低(表1)。
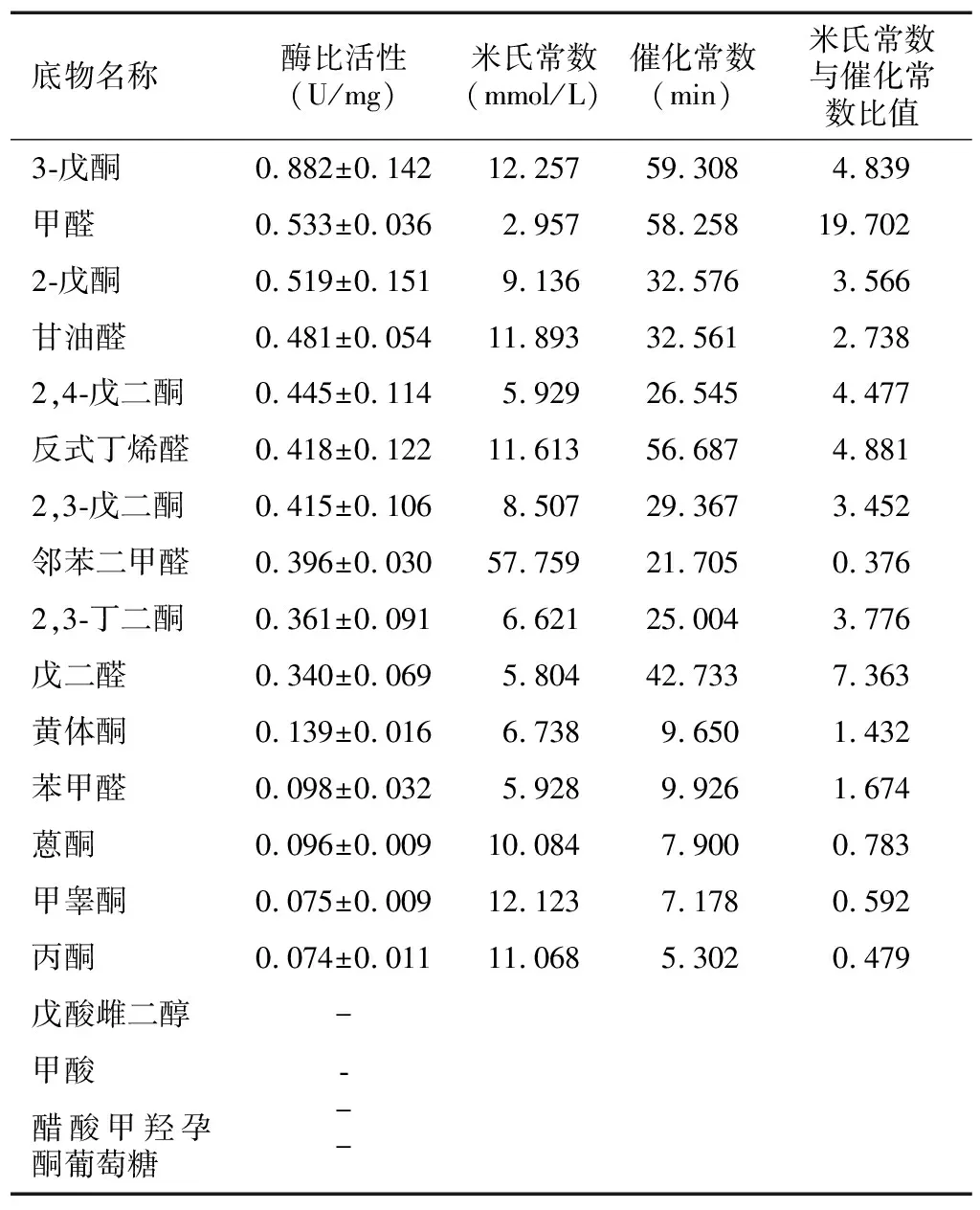
表1 EakrA81K底物谱及酶动力学常数
“-”表示未检测到活性。
2.4 A81K定点突变对酶活性的影响
表2表明,野生型黄鳝醛酮还原酶Eakr最适底物为2,3-丁二酮。Eakr对2-戊酮的还原活性仅为对2,3-丁二酮活性的4.6%,而对2,4-戊二酮的酶活性仅为对2,3-丁二酮酶活性的5.6%。但是,野生型蛋白对含有3-位酮基团的3-戊酮和2,3-戊二酮的酶活性较高,分别为对2,3-丁二酮酶活性的73.0%和84.5%。由此可知,Eakr在底物选择上更倾向于3-位酮基,当底物结构中存在与3-位酮基相邻的2-位酮基时还原活性更好。相比突变前,突变型重组蛋白EakrA81K对甲醛、2-戊酮、甘油醛、2,4-戊二酮和戊二醛等底物的活性显著升高(表2)。突变型蛋白EakrA81K最适底物为3-戊酮 (Km=12.257),对2-戊酮(Km=9.136)的还原活性为对3-戊酮活性的66.7%。分析其米氏常数,显然突变型蛋白对2-戊酮的亲和力更高(表1)。
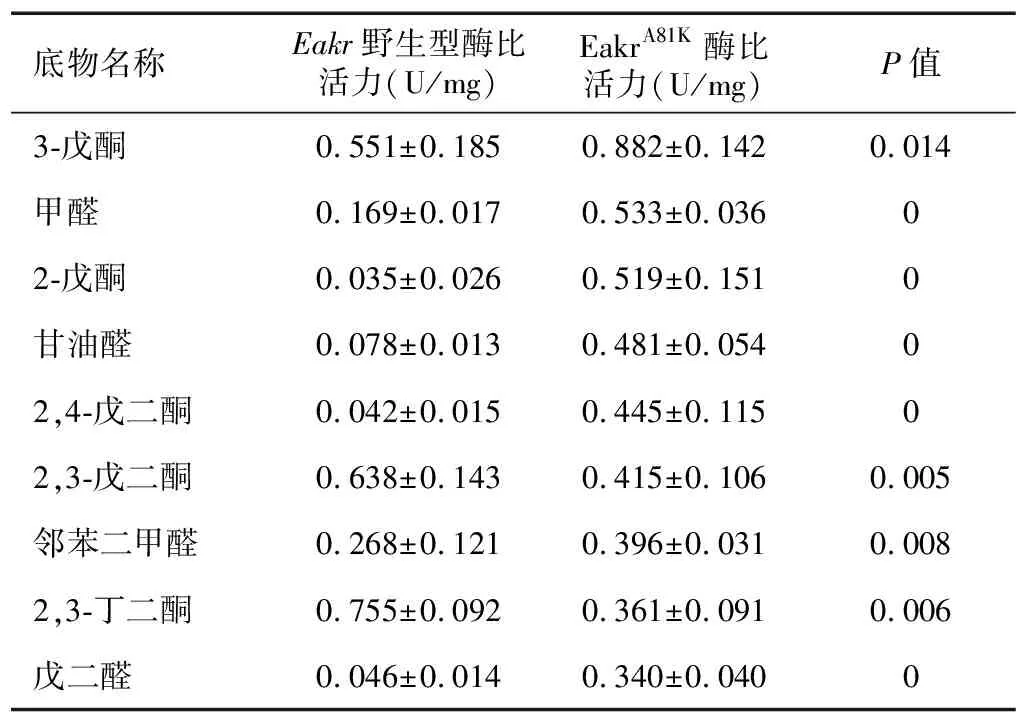
表2 野生型Eakr和突变型蛋白EakrA81K的酶比活力
P<0.01时表示差异极显著,P<0.05时表示差异显著。
2.5 温度和pH对Eakr以及EakrA81K蛋白的影响
使用甲醛作为底物,研究了pH和温度对Eakr以及EakrA81K蛋白酶活性的影响。结果表明,在pH为4时野生型蛋白Eakr活性最高,pH为4.5时其依然保持70%左右的酶活性,当pH继续升高后Eakr的活性急剧下降。相似地,突变型蛋白EakrA81K在pH 4.5~5.5时保持70%以上的酶活性,在此pH范围之外,对甲醛的还原活性急剧下降(图3)。由此看出,A81K位点突变稍降低了黄鳝醛酮还原酶的酸度耐受能力。
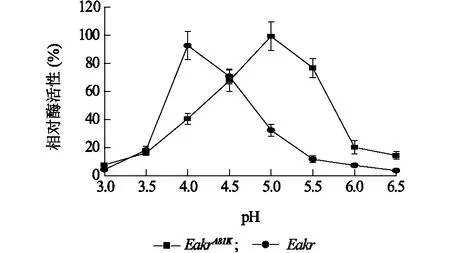
图3 不同pH条件下野生型Eakr及突变型蛋白EakrA81K的相对酶活性Fig.3 The relative activity of Eakr and EakrA81K in different pH condition
同样地,温度对野生型Eakr及突变型蛋白EakrA81K具有相似的影响。Eakr在35 ℃活性最高,在 30~40 ℃可保持50%以上的酶活性;EakrA81K最适反应温度为37 ℃,在温度 35~40 ℃时保持80%以上的酶活性(图4)。从相对酶活性上分析,突变型蛋白比野生型蛋白的温度耐受性略高。

图4 不同温度下野生型Eakr及突变型蛋白EakrA81K的相对酶活性Fig.4 The relative activity of Eakr and EakrA81K under different temperature
3 讨 论
本研究通过重叠PCR技术将黄鳝醛酮还原酶Eakr催化四联体中81位氨基酸丙氨酸(A)突变为赖氨酸(K)后,实现了突变蛋白EakrA81K的重组表达及纯化。根据已知的醛酮还原酶底物谱,分析了突变型蛋白底物特异性。结果表明,突变型蛋白EakrA81K对醛类物质以及中长链酮类物质具有较高的还原活性;野生型醛酮还原酶Eakr及突变型EakrA81K蛋白均没有检测到对醇、糖、酸类物质的还原活性,这表明黄鳝醛酮还原酶可能不属于醛糖还原酶或醛醇还原酶家族的成员。突变型蛋白EakrA81K与醛类物质亲和力较好,但随着底物碳原子数目的增加,酶与底物亲和力下降,这可能是碳原子数目增加导致底物与酶难以靠近造成的。Wang等[17]对人的醛酮还原酶LEK底物谱的研究也发现了类似的现象,随底物的碳原子数量增多,LEK与底物亲和力降低,还原活性下降。A81K位点突变导致酶对大部分底物的活性显著提升,这可能是因为赖氨酸(K)是一种具有较长侧链的碱性氨基酸,它可以通过与底物形成氢键等方式帮助底物与酶分子结合进入活性中心完成还原反应。野生型Eakr蛋白在还原中长链酮类时选择3-位酮基作为催化位点,而2-位酮基的存在对底物与酶的结合起到促进作用。类似试验结果也在氧化葡萄糖酸杆菌的醛酮还原酶AKR5C3的研究中报道过[18]。突变型蛋白EakrA81K对含3-位酮基的化合物表现良好的还原活性,且对含2-位酮基的底物还原活性大大增强。但当底物2,3-位同时存在酮基时,EakrA81K对其还原活性显著下降。推测,底物2-位酮基的存在对3-位酮基的还原产生了非竞争性抑制是导致该酶对此类二酮类底物酶活性降低的主要原因。以上结果表明黄鳝醛酮还原酶Eakr第81位氨基酸在底物识别上具有重要作用。该研究为深入了解鱼类醛酮还原酶的生物学功能提供了方向和基础资料,同时为研究Eakr底物结合位点,拓宽底物谱以及酶改造提供了重要参考资料。
参考文献:
[1] MINDNICH R D, PENNING T M. Aldo-keto reductase(AKR) superfamily: genomics and annotation [J]. Hum Genomics, 2009, 3 (4): 362-370.
[2] 代海艳,江 翱,李 伟.黄鳝醛酮还原酶的羰基解毒作用初探[J].江苏农业科学,2017,45(1):150-152.
[3] HYNDMAN D, BAUMAN D R, HEREDIA V V, et al. The aldo-keto reductase superfamily homepage [J]. Chem Biol Interact, 2003, 143/144 (2): 621-631.
[4] PENNING T M. The aldo-keto reductases (AKRs): Overview [J]. Chem Biol Interact, 2015, 234: 236-246.
[5] SCOBLE J, MCALISTER A D, FULTON Z, et al. Crystal structure and comparative functional analyses of aMycobacteriumaldo-keto reductase [J]. Mol Biol, 2010, 398: 26-39.
[6] SUN L, CHEN Y, RAJENDRAN C, et al. Crystal structure of perakine reductase, founding member of a novel aldo-keto reductase (AKR) subfamily that undergoes unique conformational changes duringNADPHbinding [J]. J Biol Chem, 2012, 287(14): 11213-11221.
[7] KAMITORI S, IGUCHI A, OHTAKI A, et al. X-ray structures of NADPH-dependent carbonyl reductase fromSporobolomycessalmonicolorprovide insights into stereoselective reductions of carbonyl compounds [J]. J Mol Biol, 2005, 352(3): 551-558.
[8] LI D, ELLIS E M, FERRARI M. Human aldo-keto reductaseAKR7A2 protects against the cytotoxicity and mutagenicity of reactive aldehydes and lowers intracellular reactive oxygen species in hamster V79-4 cells [J]. Chem Biol Interact, 2012, 195(1): 25-34.
[10] HEVIR N, VOUK K, SINKOVEC J, et al. Aldo-keto reductases AKR1C1, AKR1C2 and AKR1C3 may enhance progesterone metabolism in ovarian endometriosis [J]. Chem Biol Interact, 2011, 191(1): 217-226.
[11] SINGH R, KISHORE L, KAUR N. Diabetic peripheral neuropathy: current perspective and future directions [J]. Pharmacol Res,2014, 80: 21-35.
[12] 李宏哲,李才锐,孙曙光. 醛糖还原酶在糖尿病视网膜病变中作用的研究进展 [J]. 国际眼科杂志, 2015, 15(7): 1176-1178.
[13] 代海艳,江 翱,李 伟. 黄鳝醛酮还原酶的羰基解毒作用初探 [J]. 江苏农业科学, 2017, 45(1): 150-152.
[14] OSORIO-YEZ C, LUIS GARCA-TAVERA J, TERESA PÉREZ-NEZ M, et al. Benzo (α) pyrene induces hepatic AKR1A1 mRNA expression in tilapia fish (Oreochromisniloticus) [J]. Toxicology Mechanisms and Methods, 2012, 22(6): 438-444.
[15] CHEN M, LIN J P, MA Y S, et al. Characterization of a novel NADPH-dependent oxidoreductase fromGluconobacteroxydans[J]. Mol Biotechnol, 2010,46:176-181.
[16] HONG S, NAM H K, KIM K R,et al. Molecular characterization of an aldo-keto reductase fromMarivirgatractuosathat converts retinal to retinol [J]. J Biotechnol, 2014,169:23-33.
[17] WANG Q, YE T, MA Z, et al. Characterization and sitedirected mutation of a novel aldo-keto reductase fromLodderomyceselongisporusNRRL YB4239 with high production rate of ethyl (R)4chloro3hydroxybutanoate [J]. J Ind Microbiol Biotechnol, 2014, 41(11): 1609-1616.
[18] 刘 旭. 基于结构解析的醛酮还原酶AKR5C3的底物选择性研究 [D]. 上海:华东理工大学, 2011.
