地衣芽孢杆菌B-1降解西维因的环境条件
2018-07-06胡凯弟朱佳雯王兴洁刘书亮
苏 赵, 胡凯弟, 朱佳雯, 王兴洁, 刘书亮,2
(1.四川农业大学食品学院,四川 雅安 625014; 2.四川农业大学食品加工与安全研究所,四川 雅安 625014)
西维因(Carbaryl,分子式为C12H11NO2),又名甲萘威,为一种广谱型氨基甲酸酯类农药[1]。由于其低毒高效,一经推广便迅速替代高毒低效的有机磷类农药,大量用于农业生产和室内病虫害防治[2]。但近些年研究结果表明,西维因不仅对生态环境造成影响[3],对人体健康亦会造成多方面危害[1-2]。虽然欧盟已禁止使用,但西维因仍广泛流通于诸如美国、澳大利亚等发达国家乃至大部分发展中国家[4]。众所周知,农药并非只局限于残留在农作物上,可迁移至空气、土壤和水体[5],甚至经食物链传播形成生物富集[6]。西维因一度成为美国地表水中最常被检测到的杀虫剂[7],在某些食品中也有检出[8]。如何消除环境及食品中的西维因残留已成为亟需解决的问题。
目前,降解西维因及其他氨基甲酸酯类农药的方法主要有物理法[9]、化学法[10]和生物法[2],其中生物法由于低成本、绿色、高效等优点被广泛应用。已报道能降解西维因的微生物中,细菌有假单胞菌属(Pseudomonas)[11]、节杆菌属(Arthrobacter)[12]、鞘脂菌属(Sphingobium)[13]、微球菌属(Micrococcus)[14]、根瘤菌属(Rhizobium)[15]等,真菌有曲霉属(Aspergillus)[16]、毕赤酵母属(Pichia)[17]等。随着研究的不断深入,愈来愈多的菌株将被发掘。菌株对农药的降解往往与其生长状况存在必然联系[18],而环境因素对微生物生长和农药本身降解均有影响[19]。地衣芽孢杆菌B-1(BacilluslicheniformisB-1) 是一株可高效降解氯氰菊酯的功能性菌株[20],也能降解西维因,因此研究其降解西维因环境条件,对菌株的实际应用具有重要意义。
1 材料与方法
1.1 菌株及培养基
1.1.1 菌株 地衣芽孢杆菌B-1(BacilluslicheniformisB-1) ,由四川农业大学食品微生物实验室分离鉴定并保存,其培养72 h对20 mg/L氯氰菊酯的降解率为93.93%[20]。
1.1.2 培养基 Luria-Bertani培养基(LB):胰蛋白胨10.0 g/L,酵母膏5.0 g/L,NaCl 10.0 g/L,Tween 80 2.0 g/L,蒸馏水溶解并定容至1.0 L,pH调至7.0;固体培养基添加20.0 g/L琼脂粉。均 1×105Pa条件下灭菌15 min。
1.2 主要试剂和仪器
西维因标准品(99%)、丁硫克百威标准品(98%)、毒死蜱标准品(99%),德国Dr. Ehrenstorfer GmbH公司产品;叶蝉散标准品(99.8%),中国计量科学研究院提供;1-萘酚标准品(99.5%),美国Sigma公司产品;乙腈(色谱纯),瑞典Oceanpak公司产品;甲醇(AR),成都科龙试剂厂产品。
农药母液配制:准确称取适量农药,用无水乙醇溶解并定容,配制成质量浓度均为5 mg/ml的母液备用。
LC-2010C HT液相色谱仪,LC-Solution工作站,日本Shimazu公司产品;Sorvall ST 16R冷冻离心机,美国Thermo Fisher Scientific公司产品。
1.3 方法
1.3.1 菌种活化及种子液制备 挑取地衣芽孢杆菌B-1划线于LB斜面,30 ℃培养48 h,用5 ml无菌生理盐水洗下菌苔并调整细胞数量至 1×108CFU/ml,作为种子液。
1.3.2 西维因的提取与测定 取细菌均匀培养液1 ml至刻度试管中,加入等体积甲醇,超声波(40 kHz,300 W)辅助提取20 min,摇匀后用甲醇定容至10 ml,取1.5 ml离心(12 000 r/min,15 min),吸取上清过0.45 μm有机相滤膜,弃去初滤液,取续滤液供HPLC检测。HPLC检测条件[21]:色谱柱为Sepax GP-C18柱(150.0 mm×4.6 mm,5 μm),流动相为乙腈超纯水(56∶44,体积比),流速0.5 ml/min,柱温25 ℃,进样量10 μl,紫外检测器波长220 nm。计算农药降解率和残留率,降解率=[(C0-C)/C0]×100%,残留率=1-降解率,式中,C0为样品培养液0 h时目标农药总质量浓度(mg/L),C为样品培养液取样时目标农药残留质量浓度(mg/L)。
1.3.3 菌株B-1生长曲线和降解曲线的测定 将菌株B-1种子液按5% (体积分数)接种量分别接种于LB培养基和含100 mg/L西维因的LB培养基中,分装于250 ml锥形瓶,每瓶30 ml。30 ℃、140 r/min振荡培养72 h,同时设置添加等量无菌生理盐水的空白对照。取样时间为 0~24 h间隔2 h,24~36 h间隔4 h,36~72 h间隔12 h。生物量以细菌均匀培养液在波长600 nm处的吸光值(OD600)表示,计算西维因残留率。试验重复3次,取平均值。
1.3.4 菌株B-1降解西维因的环境条件试验
1.3.4.1 培养温度 将菌株B-1种子液按5%(体积分数)接种量接种于西维因质量浓度为100 mg/L的LB培养基中,锥形瓶分装,在不同温度下140 r/min振荡培养48 h。测定样品生物量及西维因残留率。
1.3.4.2 初始pH 将菌株B-1种子液按5%(体积分数)接种量接种于西维因质量浓度为100 mg/L、不同初始pH 的LB培养基中,锥形瓶分装,30 ℃、140 r/min振荡培养48 h。测定样品生物量及西维因残留率。
1.3.4.3 底物质量浓度 将菌株B-1种子液按5%(体积分数)接种量接种于含有不同质量浓度西维因的LB培养基中,锥形瓶分装,30 ℃、140 r/min振荡培养48 h。测定样品生物量及西维因残留率。
1.3.4.4 NaCl质量浓度 将菌株B-1种子液按5%(体积分数)接种量接种于含有100 mg/L西维因和不同质量浓度NaCl的LB培养基中,锥形瓶分装,30 ℃、140 r/min振荡培养48 h。测定样品生物量及西维因残留率。
1.3.4.5 金属离子 将菌株B-1种子液按5%(体积分数)接种量接种于含有100 mg/L西维因和0.05%(质量浓度)不同金属离子化合物(CaCl2、FeCl3、MnSO4、MgCl2、CuSO4)的LB培养基中,设置未添加上述金属离子化合物的对照,分装于锥形瓶中,30 ℃、140 r/min振荡培养48 h。测定样品生物量及西维因残留率。
1.3.5 菌株B-1降解谱试验 将菌株B-1种子液按5%(体积分数)接种量分别接种于含20 mg/L丁硫克百威、20 mg/L叶蝉散和20 mg/L毒死蜱的LB培养基中,分装于锥形瓶,30 ℃、140 r/min振荡培养一定时间后取样。采用HPLC检测各样品中农药残留量,考察菌株B-1降解不同种类农药的能力。HPLC检测条件参照文献[21]、[22]。
1.3.6 菌株B-1降解西维因中间产物的分析 将菌株B-1种子液按5%(体积分数)接种量接种于含100 mg/L西维因的LB培养基中,锥形瓶分装,30 ℃、140 r/min振荡培养。定时整瓶取样,加入等体积甲醇,超声波(40 kHz,300 W) 30 min后按照方法1.3.2处理样品。用HPLC直接检测样品中西维因变化情况,并结合添加疑似产物标准品进行分析。以添加等量无菌生理盐水为空白对照。
2 结果与分析
2.1 地衣芽孢杆菌B-1的生长曲线和降解曲线
比较菌株B-1在LB和LB-Carbaryl培养基中的生长情况(图1)。由图1可知,B-1在两种培养基中生物量略有不同,但总体趋势一致。0~8 h生长缓慢,8 h后生长迅速,28 h后进入稳定期,最终OD600分别为1.10和1.09。菌株在LB-Carbaryl培养基中的生物量较在LB培养基中的小,可能是因为西维因对菌株生长有一定的抑制作用[23],但并不影响其对数生长期的到来。图1还显示了菌株B-1在LB培养基中对西维因的降解情况。西维因残留量在 0~8 h内变化缓慢,此时菌株生长处于延滞期;8 h后随着菌株生物量的增加,西维因开始降解,并在 20~48 h内迅速减少,可见菌株B-1对西维因降解与生长是同步的。除去空白对照组损失部分,B-1在72 h内对100 mg/L西维因的降解率达到91.21%。

图1 菌株B-1的生长曲线及对西维因的降解曲线Fig.1 Curves of growth and carbaryl degradation by strain B-1
2.2 地衣芽孢杆菌B-1降解西维因的环境条件
培养温度对西维因降解率影响较大(图2)。40 ℃以下时,随着培养温度的升高,菌株生物量增加,西维因残留量逐渐降低;40 ℃时OD600最大,为2.28,且西维因降解率也较高,为99.79%。超过40 ℃时,菌株生长减缓,未检测到西维因残留,可能是由于西维因在较高温度下不稳定而分解了[24],但更主要的原因还是被菌株降解了。

图2 不同培养温度对菌株B-1生长及降解西维因的影响Fig.2 Effects of different culture temperatures on growth of strain B-1 and carbaryl degradation
由图3可知,初始pH为6时,菌株B-1 生物量(OD600)最大,西维因残留较少,分别为1.691和40.37%。碱性环境对菌株生长有较大抑制作用,表现为菌株生物量偏低,但西维因残留较少,原因可能是西维因在碱性环境中发生水解[1]。

图3 不同初始pH对菌株B-1生长及降解西维因的影响Fig.3 Effects of different initial pH on growth of strain B-1 and carbaryl degradation
菌株B-1在含不同质量浓度西维因的LB培养基中培养48 h后,菌体生长和西维因降解情况如图4所示。由图4可知,培养周期内菌株B-1对不同质量浓度的西维因有不同程度的降解,底物浓度越高,菌株生物量越低,降解率亦越低。可能是由于高质量浓度的农药对菌株有一定毒害作用,影响其生长[25]。
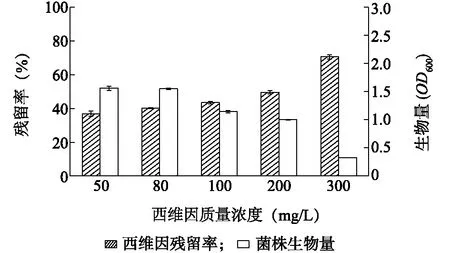
图4 不同底物质量浓度对菌株B-1生长及降解西维因的影响Fig.4 Effects of different substrate concentrations on growth of strain B-1 and carbaryl degradation
当培养基中NaCl添加量为0时,菌株B-1生长最好,西维因降解率亦最高,为84.74%(图5)。随着NaCl添加量的增加,菌株生物量和西维因降解率均呈下降趋势。当NaCl添加量为2%时,降解率仅为65.35%。

图5 不同NaCl质量浓度对菌株B-1生长及降解西维因的影响Fig.5 Effects of different concentration of sodium chloride on growth of strain B-1 and carbaryl degradation
不同金属离子对菌株B-1降解西维因的影响也不同(图6)。由图6可知,与对照相比,Ca2+、Fe3+、Mn2+和Mg2+对菌株降解西维因均有不同程度的刺激作用,其中添加Mn2+降解率最高,菌株生长最好。Cu2+对B-1生长有毒害作用[26],菌株几乎不能生长(OD600为0.235),西维因也未降解。
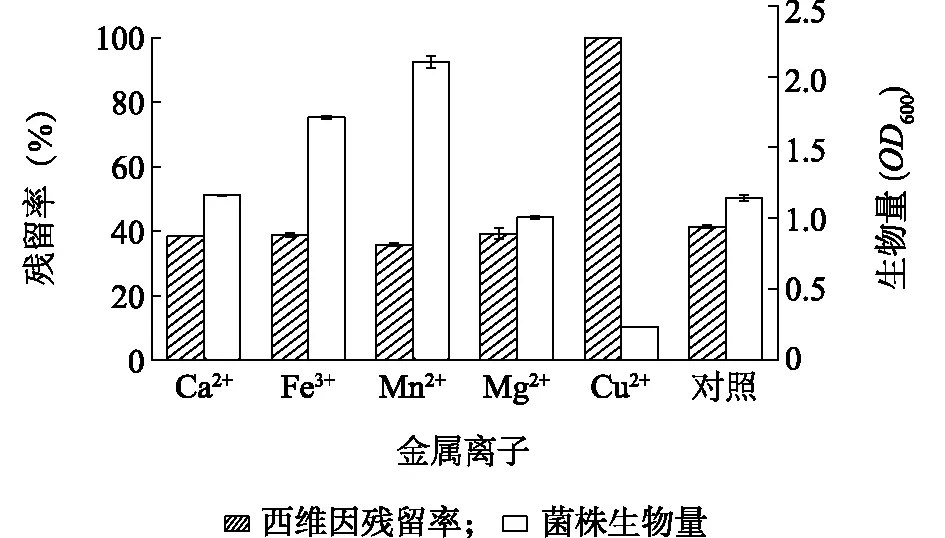
图6 不同金属离子对菌株B-1生长及降解西维因的影响Fig.6 Effects of different metal ions on growth of strain B-1 and carbaryl degradation
2.3 地衣芽孢杆菌B-1的降解谱
结果(表1)显示,B-1不仅能降解丁硫克百威和叶蝉散,也具备降解毒死蜱的能力,其在LB培养基中培养168 h对20 mg/L毒死蜱的降解率为50.77%。
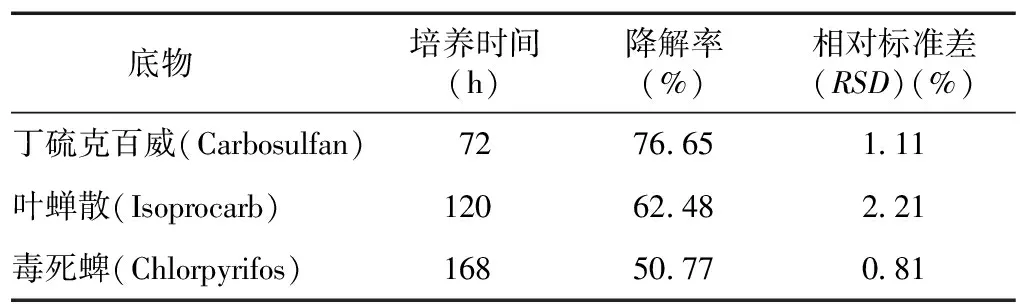
表1 菌株B-1的降解谱
2.4 地衣芽孢杆菌B-1降解西维因的中间产物
HPLC检测结果显示,相较于LB培养体系,LB-Carbaryl培养体系在0 h时多了1号色谱峰,随着培养时间的延长,1号色谱峰逐渐变小,随之产生的是2号色谱峰,并逐渐变大。同混合标准品HPLC色谱图比较,1号色谱峰与响应时间为7.431 min的西维因相对应,而2号色谱峰与1-萘酚(响应时间8.392 min) 对应。向LB-Carbaryl培养体系样品中添加50 μl 1-萘酚标准品溶液(200 mg/L,乙腈配制)后,2号峰面积增加。
用HPLC分析LB-Carbaryl培养体系西维因变化趋势,结果显示,0~48 h随着培养时间的延长,1号色谱峰与2号色谱峰呈此消彼长的趋势;72 h后2号色谱峰开始减小,推测菌株B-1可在LB培养基中降解1-萘酚。经进一步验证,菌株B-1在LB培养基中培养72 h对20 mg/L 1-萘酚的降解率为48.70%。
3 讨 论
环境条件的改变会影响微生物的生长及代谢状况[5],而微生物降解农药的能力又与其生长状况密切相关[27]。45 ℃时,BacilluslicheniformisB-1生物量较40 ℃时低,但无西维因残留,推测可能是由于在菌株B-1降解的基础上,西维因在较高温度下不稳定而分解,这与Uyanik等[28]的结论相吻合。Hawker[4]在研究不同pH值下西维因降解动力学时发现,在碱性环境下其半衰期更短。因此,当pH为9时西维因残留率最低可能是生物与化学因素共同作用的结果。另一方面,当农药底物质量浓度较大或渗透压较高时,菌株生长会因胁迫压力而受抑制,降解能力必然有所下降[25]。本试验中,与不添加金属离子的对照相比,添加Ca2+、Fe2+、Mn2+、Mg2+对菌株B-1降解西维因能力有不同程度的促进作用,其中Mn2+效果最为明显,而Cu2+则有抑制作用。
目前还未见关于地衣芽孢杆菌降解西维因的报道。本试验中地衣芽孢杆菌B-1可降解50~300 mg/L的西维因,于LB培养基中培养72 h对100 mg/L西维因的降解率为91.21%,降解能力强于PichiaanomalaHQ-C-01[17]和Arthrobactersp. RC100[12]。污染治理过程中,常常存在多类农药残留混合的问题,仅仅消除某一种农药是不可行的[29]。菌株B-1对20 mg/L溴氰菊酯、氟氯氰菊酯和氰戊菊酯的72 h降解率分别为95.62%、79.73%和55.67%[20],对毒死蜱和其他氨基甲酸酯类农药也均有降解作用,具有广谱性,是降解农药残留的理想菌源。对菌株B-1降解西维因产物的分析结果显示,西维因降解过程中酯键断裂生成1-萘酚,而且后者能被菌株B-1进一步代谢,这与已有的报道降解途径[11-12]一致。赖文等的研究结果还表明,菌株B-1对氯氰菊酯的降解作用源于其所产生的胞外固有酯酶[20]。上述几种农药的分子中都存在酯键,其生物降解的第一步也均是酯键水解而实现解毒[30-34],因此推测菌株B-1的降解酯酶具有广谱活性,有必要开展深入研究。
参考文献:
[1] KOSHLUKOVA S E, REED N R. Carbaryl[M]//WEXLER P. Encyclopedia of toxicology. 3rd ed. Amsterdam: Elsevier, 2014: 668-672.
[2] GUNASEKARA A S, RUBIN A L, GOH K S, et al. Environmental fate and toxicology of carbaryl[M]//WHITACRE D M. Reviews of environmental contamination and toxicology. New York: Springer, 2008: 95-121.
[3] TOUMI H, BURGA-PEREZ K F, FERARD J F. Acute and chronic ecotoxicity of carbaryl with a battery of aquatic bioassays[J]. Journal of Environmental Science and Health, Part B, 2016, 51(1): 57-62.
[4] HAWKER D. Kinetics of carbaryl hydrolysis: An undergraduate environmental chemistry laboratory[J]. Journal of Chemical Education, 2015, 92(9): 1531-1535.
[5] MOTTES C, LESUEUR-JANNOYER M, LE BAIL M, et al. Pesticide transfer models in crop and watershed systems: a review[J]. Agronomy for Sustainable Development, 2014, 34(1): 229-250.
[6] KATAGI T. Bioconcentration, bioaccumulation, and metabolism of pesticides in aquatic organisms[M]//WHITACRE D M. Reviews of environmental contamination and toxicology. New York: Springer, 2010: 1-132.
[7] GILLIOM R J, HAMILTON P A. Pesticides in the nation's streams and ground water, 1992-2001-a summary[R]. Sacramento: U.S. Geological Survey, 2006.
[8] SHAMSIPUR M, YAZDANFAR N, GHAMBARIAN M. Combination of solid-phase extraction with dispersive liquid-liquid microextraction followed by GC-MS for determination of pesticide residues from water, milk, honey and fruit juice[J]. Food Chemistry, 2016, 204: 289-297.
[9] KHOOBDEL M, SHAYEGHI M, GOLSORKHI S, et al. Effectiveness of ultrasound and ultraviolet irradiation on degradation of carbaryl from aqueous solutions[J]. Iranian Journal of Arthropod-Borne Diseases, 2010, 4(1): 47.
[10] KONG L J, LEMLEY A T. Effect of nonionic surfactants on the oxidation of carbaryl by anodic Fenton treatment[J]. Water Research, 2007, 41(12): 2794-2802.
[11] SWETHA V P, PHALE P S. Metabolism of carbaryl via 1, 2-dihydroxynaphthalene by soil isolatesPseudomonassp. strains C4, C5, and C6[J]. Applied and Environmental Microbiology, 2005, 71(10): 5951-5956.
[12] HAYATSU M, HIRANO M, NAGATA T. Involvement of two plasmids in the degradation of carbaryl byArthrobactersp. strain RC100[J]. Applied and Environmental Microbiology, 1999, 65(3): 1015-1019.
[13] YAN Q X, WANG Y X, LI S P, et al.Sphingobiumqiguoniisp. nov., a carbaryl-degrading bacterium isolated from a wastewater treatment system[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(12): 2724-2728.
[14] DODDAMANI H P, NINNEKAR H Z. Biodegradation of carbaryl by aMicrococcusspecies[J]. Current Microbiology, 2001, 43(1): 69-73.
[15] HASHIMOTO M, FUKUI M, HAYANO K, et al. Nucleotide sequence and genetic structure of a novel carbaryl hydrolase gene (cehA) fromRhizobiumsp. strain AC100[J]. Applied and Environmental Microbiology, 2002, 68(3): 1220-1227.
[16] ZHANG Q, LIU Y, LIU Y H. Purification and characterization of a novel carbaryl hydrolase fromAspergillusnigerPY168[J]. FEMS Microbiology Letters, 2003, 228(1): 39-44.
[17] YANG L, CHEN S H, HU M Y, et al. Biodegradation of carbofuran byPichiaanomalastrain HQ-C-01 and its application for bioremediation of contaminated soils[J]. Biology and Fertility of Soils, 2011, 47(8): 917-923.
[18] MEN J, CHENG F. Biodegradation and growth characteristics of a toluene-degrading strain[J]. African Journal of Biotechnology, 2011, 10(61): 13299-13306.
[19] FENNER K, CANONICA S, WACKETT LP, et al. Evaluating pesticide degradation in the environment: blind spots and emerging opportunities[J]. Science, 2013, 341(6147): 752-758.
[20] 赖 文,刘书亮,赵 楠, 等. 氯氰菊酯高效降解菌的筛选鉴定及其降解特性[J]. 食品科学, 2012, 33(21): 157-163.
[21] LIU K H, KIM J H.Invitrodermal penetration study of carbofuran, carbosulfan, and furathiocarb[J]. Archives of Toxicology, 2003, 77(5): 255-260.
[22] HASSANZADEH N, BAHRAMIFAR N, ESMAILI-SARI A. Residue content of carbaryl applied on greenhouse cucumbers and its reduction by duration of a pre-harvest interval and post-harvest household processing[J]. Journal of the Science of Food and Agriculture, 2010, 90(13): 2249-2253.
[23] DELORENZO M E, SCOTT G I, ROSS P E. Toxicity of pesticides to aquatic microorganisms: a review[J]. Environmental Toxicology and Chemistry, 2001, 20(1): 84-98.
[24] LIMA M P R, CARDOSO D N, SOARES A M V M, et al. Carbaryl toxicity prediction to soil organisms under high and low temperature regimes[J]. Ecotoxicology and Environmental Safety, 2015, 114: 263-272.
[25] 董 滨,王凤花,林爱军,等. 乙草胺降解菌A-3的筛选及其降解特性[J]. 环境科学, 2011, 32(2): 542-547.
[26] SILVER S, PHUNG L T. A bacterial view of the periodic table: genes and proteins for toxic inorganic ions[J]. Journal of Industrial Microbiology and Biotechnology, 2005, 32(11/12): 587-605.
[27] 邓维琴,刘书亮,姚 开,等. 3-苯氧基苯甲酸降解菌Sphingomonassp.SC-1降解苯酚环境条件及其降解中间产物的研究[J]. 微生物学通报, 2015, 42(3): 497-503.
[28] UYANIK A, ÖZDEMIR M. Effect of the environmental temperature on the degradation period of carbaryl[J]. Turkish Journal of Agriculture and Forestry, 1999, 23(6): 579-584.
[29] JIRIES A G, AL NASIR F M, BEESE F. Pesticide and heavy metals residue in wastewater, soil and plants in wastewater disposal site near Al-Lajoun Valley, Karak/Jordan[J]. Water, Air, & Soil Pollution, 2002, 133(1): 97-107.
[30] TALLUR P N, MEGADI V B, NINNEKAR H Z. Biodegradation of cypermethrin byMicrococcussp. strain CPN 1[J]. Biodegradation, 2008, 19(1): 77-82.
[31] CHEN S H, CHANG C Q, DENG Y Y, et al. Fenpropathrin biodegradation pathway inBacillussp. DG-02 and its potential for bioremediation of pyrethroid-contaminated soils[J]. Journal of Agricultural and Food Chemistry, 2014, 62(10): 2147-2157.
[32] SINGH B K, WALKER A. Microbial degradation of organophosphorus compounds[J]. FEMS Microbiology Reviews, 2006, 30(3): 428-471.
[33] SOGORB M A, VILANOVA E. Enzymes involved in the detoxification of organophosphorus, carbamate and pyrethroid insecticides through hydrolysis[J]. Toxicology Letters, 2002, 128(1): 215-228.
[34] ROSS M K, STREIT T M, HERRING K L, et al. Carboxylesterases: dual roles in lipid and pesticide metabolism[J]. Journal of Pesticide Science, 2010, 35(3): 257-264.
