康复训练联合神经生长因子对脑出血 大鼠肢体功能的影响*
2018-07-06穆峰郑修广刘圣恒陈光伟张作文李红梅张运宏牟晓洋
穆峰 郑修广 刘圣恒 陈光伟 张作文 李红梅 张运宏 牟晓洋
(重庆市江津区中心医院1.神经内科;2.检验科;3.神经外科,重庆 402260)
脑出血是危害人类健康的常见病﹑多发病,其致残率和死亡率居高不下。而且存活的患者中,会有较多患者遗留永久残疾,如偏瘫。本课题拟通过外源性NGF联合康复训练作用于脑出血大鼠,观察并了解NGF联合康复训练在脑出血致偏瘫大鼠促其功能恢复的作用及其机制,为NGF联合康复训练在脑出血患者中的应用提供实验证据和理论基础,开拓新的思路。
1 材料和方法
1.1 实验动物及其分组 健康清洁级成年雄性SD大白鼠96只,体重(280±50)g(由第三军医大学实验动物中心提供)。实验动物随机分为对照组、康复训练组、NGF治疗组(腹腔内注射神经生长因子30ug/kg)和康复训练联合NGF治疗共四组,每组各24只。每组下设3个观察时间点,分别为造模成功后第1﹑2﹑3周和每个观察时间点8只大鼠。
1.2 方法 康复训练组:造模成功后,进行平衡、 旋转、抓握训练。NGF组:每天腹腔内注射神经生长因子30ug/kg。NGF联合康复训练组:按照康复训练组和NGF组方法进行。对照组:不予任何处理。
1.2.1 脑出血大鼠模型的制备 采用胶原酶诱导法建立大鼠脑出血动物模型[1],具体步骤如下:大鼠术前12h禁食,4h禁水,用0.4%戊巴比妥钠50mg/kg腹腔麻醉。保证手术操作期间大鼠有自主呼吸,俯卧固定于江湾型动物头颅立体定位仪上。将大鼠头皮丁字形切开,取前囟为原点,向右3mm,向后1mm,深度5mm为进针点。骨钻钻开颅骨,进针后缓慢注入含0.5U胶原酶的生理盐水2uL,留针2min,缓慢退针,骨蜡封闭颅骨钻孔,缝合皮肤。术中大鼠肛温保持在36.5~37.50C ,手术后大鼠被送到通风和有空调的动物房饲养。
1.2.2 模型成功评价 根据Berderson等[2]的评定方法分为四级。0级:没有神经功能缺失症状;1级:将大鼠尾巴提起时,可见瘫痪侧前肢回收屈曲于腹下,正常侧前肢向地面伸展;2级:除1级体征外,向瘫痪侧推大鼠时阻力较对侧明显降低;3级:除1级、2级体征外,大鼠有向瘫痪侧旋转的行为。实验动物大部分2h内苏醒。注入胶原酶后2h以后对大鼠神经功能缺损症状进行评定,如果神经功能缺损症状达1、2、3级判断为造模成功,否则排除进一步实验。
1.2.3 康复训练方法 康复训练组及NGF联合康复训练组于造模后休息2d,从第3d起开始采用自制仪器进行康复训练:①平衡木训练采用170cm长、2cm宽的方木棒,平放在距地面7cm处,作为一个平衡木让大鼠在上面行走,用于评估及训练大鼠的平衡功能。②转棒训练采用长150cm、直径4.5cm的木棒1根,其中点固定在3r/min的转动器上,分别向左右交替转动,用于评估及训练大鼠的动态平衡功能。③网屏训练,网屏为50cm*40cm网带,1cm*1cm网眼,网板的左右和上方都用25cm高的木板框边,网屏距地面高度为80cm,下方铺以12cm厚的海绵。先将网屏水平放置,将老鼠放在上面,然后缓缓地将其一端抬高,在2s内将此网屏变成垂直位,保持5s,观察大鼠是否会从网屏上掉下来或用前爪抓握住网屏,用于评价大鼠前爪抓握能力及肌力情况。以上训练每天共计30min,每周康复训练5d。
1.2.4 行为评估
1.2.4.1 神经功能障碍评分 按Garcia[3]等方进行神经功能障碍评分,最高分18分,最低分3分,分数越低,神经功能障碍越严重。
1.2.4.2 平衡木行走评分 评分标准分为6个等级。0分为大鼠能跳上平衡木,在上面行走时不会跌倒;1分为大鼠 能跳上平衡木,在上面行走时,跌倒概率低于50%;2分为大鼠能跳上平衡木,在上面行走时,跌倒概率高于50%;3分为大鼠在健侧后肢辅助下能跳上平衡木,但受累的瘫侧后肢不能辅助向前移动;4分为大鼠在平衡木上不能行走,但可以坐在上面;5分为大鼠放在平衡木上会马上掉下来。
1.2.4.3 转棒行走评分 评分标准分为4个等级。0分为在转动过程中,大鼠可在转棒上行走;1分为在转动过程中,60s以上时间,大鼠不会从转棒上掉下来;2分为转动开始后,大鼠从转棒上掉下来;3分为转动开始前,大鼠从转棒上掉下来。
1.2.4.4 网屏实验评分 评分标准分为4个等级。0分为大鼠前爪握住网屏超过5s,不会掉下来;1分为大鼠可暂时握住网屏,滑落一段距离,但不会掉下来:2分为大鼠在5s内掉下来;3分为网屏转动时,大鼠立刻掉下来。

2 结果
2.1 各组大鼠术后2小时模型成功评价 在实验过程中共有12只大鼠死亡,另有17只大鼠手术后模型评价为0级,被剔除实验,用备用大鼠进行随机补充。最后模型成功评价,见表1。
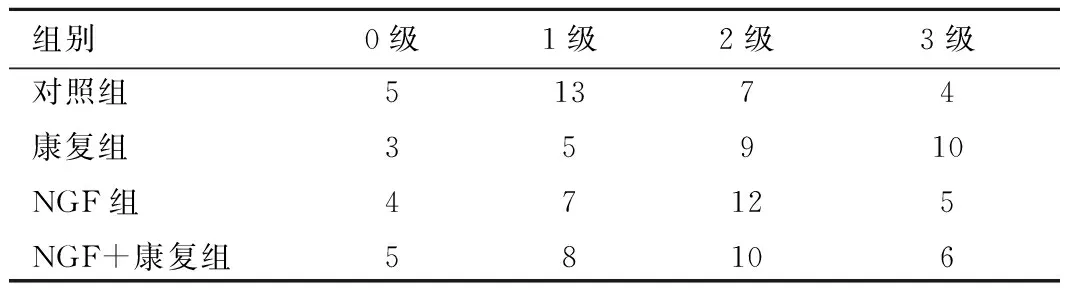
表1 各组大鼠术后2小时模型成功评价 Table 1 The evaluation of the model 2 hours after operation
注:0级为剔除的大鼠,未进入实验
2.2 各组不同观察时间点神经功能障碍评分 康复组及NGF组各观察时间点神经功能障碍评分均高于对照组 (P<0.05),且NGF+康复组各观察时间点神经功能障碍评分均高于康复组及NGF组(P<0.05)。提示不管是康复训练还是NGF治疗均能改善ICH大鼠神经功能障碍,并且康复训练联合NGF治疗对ICH大鼠神经功能障碍改善具有协同作用,见表2。

表2 各组不同观察时间点神经功能障碍评分 Table 2 Neurological dysfunction score
注:与对照组比较,①P<0.05;与康复组比较,②P<0.05;与NGF组比较,③P<0.05
2.3 各组大鼠平衡木行走评分 各组大鼠不同观察时间点平衡术行走评分,康复组及NGF组差异有统计学意义(P<0.05);NGF+康复组与康复组及NGF组比较差异有统计学意义(P<0.05),见表3。

表3 各组不同观察时间点平衡木行走评分 Table 3 Balance wood walking score
注:与对照组比较,①P<0.05;与康复组比较,②P<0.05;与NGF组相比,③P<0.05
2.4 各组大鼠转棒行走评分 各组大鼠不同观察时间点转棒行走评分,康复组及NGF组差异有统计学意义(P<0.05);NGF+康复组与康复组及NGF组比较差异有统计学意义(P<0.05),见表4。

表4 各组不同观察时间点转棒行走评分 Table 4 Stick walk score
注:与对照组比较,①P<0.05;与康复组比较,②P<0.05;与NGF组相比,③P<0.05
2.5 各组大鼠网屏实验评分 各组大鼠不同观察时间点网屏实验评分,康复组及NGF组差异有统计学意义(P<0.05);NGF+康复组与康复组及NGF组比较差异有统计学意义(P<0.05),见表5。

表5 各组不同观察时间点网屏实验评分 Table 5 Screen test score
注:与对照组比较,①P<0.05;与康复组比较,②P<0.05;与NGF组相比,③P<0.05
3 讨论
3.1 康复训练与出血性脑损伤 康复训练是对中枢神经系统最有效的刺激方式之一,所有运动都可向中枢神经系统提供各种反射性传入,运动对大脑的功能重建和代偿起着至关重要的作用。康复训练对脑可塑性的影响与训练的方式密切相关;并且与脑损伤后开始康复训练的时间,以及运动量的大小密切相关[4]。出血性脑损伤后早期进行康复训练能够加快脑组织侧支循环的建立,改善病灶区的血液供应,重塑脑功能。同时康复训练有利于建立侧支循环式神经轴突突触间的联系,和对侧大脑半球功能代偿及重组。通过反复的任务式特定训练,促使潜在的神经通路和突触启动,形成大脑反应突触,在此基础上神经周围组织在突触的作用下形成侧支,使病灶处神经功能获得重建[5-7]。康复训练的主要作用有[8]: ①它能加强中枢神经系统的紧张度,防止因长期卧床引起的全身生理机能退化。②它能改善偏瘫肢体的血液循环,加强神经营养功能,从而预防或减轻肌肉、骨骼的废用性萎缩。③它可使大脑处于休眠状态的突触活化,促进突触发芽、再生,使得大脑的功能重组。因此,早期系统的康复训练对脑出血后偏瘫患者肢体运动功能的恢复有显著促进作用,使患者的日常生活能力得到改善,从而提高患者的生存质量,降低致残率,减轻家庭和社会负担[9]。
3.2 NGF治疗脑出血的作用机制 NGF是一种影响神经细胞存活及发育的多功能神经营养因子, 它在神经系统发育、正常功能的维持及损伤修复中起着十分重要的作用[10]。一方面,NGF能够在机体内调节中枢神经系统基底前的脑胆碱能神经元发育、分化;另一方面,在出血性脑损伤的自我保护与修复中NGF也起着重要作用。 在出血性脑损伤中它主要通过以下几个方面促进神经功能的恢复。①为神经功能的修复提供营养因子。NGF可以为损伤的神经元提供神经营养支持,加强正常神经活动所需要分子的表达,从而加快神经功能的修复[11]。Liu等[12]通过观察幼龄、老龄大鼠脑内NGF水平,胆碱乙酰转移酶( ChAT) 活性及相应的空间学习能力之间的相关性,发现3者同步发生年龄依赖性的变化。如在老龄大鼠侧脑室内注入NGF,能显著提高基底前脑胆碱能神经元内ChAT的活性,并促使其神经元体积增大。在Morris水迷宫实验中,空间定位能力也明显提升。②作用于神经干细胞。NGF可诱导神经干细胞向神经细胞分化并能够促进其发育成熟,并为诱导分化后的神经细胞提供营养支持作用。出血性脑损伤后NGF可促进内源性NSCs增殖,保护受损神经元,促进神经纤维再生,诱导轴突发育,从而使受损的神经功能得到修复[13]。乌优图[14]等在观察NSCs向神经元分化过程中神经生长因子对轴突生长的作用,结果显示诱导组单个神经元的平均轴突数量和最长轴突平均长度均大于对照组。该实验研究证明NGF可以促进NSCs向神经元分化,且对神经突起形成和生长均有明显的促进作用。③对抗自由基。脑出血后,患者存在严重的炎性反应,NGF可以增加超氧化物歧化酶、过氧化氢酶等自由基清除剂的活性,从而减轻神经元损伤[15]。 NGF可以通过增加过氧化氢酶、超氧化物歧化酶等自由基清除剂的活性,减轻神经元损伤[16]。④抑制出血性脑损伤后的神经元凋亡。刘怀军[17]等研究报道用犬脑内注入非肝素化的自体动脉血建立ICH动物模型,结果证实ICH早期血肿周边组织中凋亡的神经细胞占37%。在出血性脑损伤中NGF通过抑制神经元凋亡的过程来实现神经保护的作用,尤其是在出血性脑损伤后引起的迟发性神经元凋亡中发挥重要的作用[18]。⑤促进新生血管的形成。脑出血的损伤部位存在血管破坏、出血及局部缺血,NGF对血管再生有一定的促进作用。研究发现NGF不仅可以通过调节血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的表达间接地促进新生血管形成,NGF还具有直接促进新生血管形成的作用[19-21]。
本实验研究结果表明,康复训练有利于建立侧支循环式神经轴突突触间的联系,促使潜在神经通路和突触启动,形成大脑反应突触。而神经生长因子则可以对抗自由基,减少神经元凋亡,以及促进血管新生等在出血性脑损伤的自我保护与修复中发挥重要作用。所以康复训练联合神经生长因子治疗脑出血大鼠时具有协同作用。在实际的临床工作中脑出血患者的神经功能重建是一项复杂而艰巨的工作,然而当前我国部分医院还是按药物治疗为主体的治疗模式,不重视康复训练治疗,导致脑出血患者致残率高,生活质量降低。
4 结论
本实验研究认为,神经康复训练是降低脑出血患者致残率的有效方法之一,临床医师应加强与神经康复医师合作,建立起包括药物治疗、肢体功能康复、心理辅导等在内的卒中病房。使患者在接受临床药物治疗的同时,能尽早接受康复指导和训练,减少后遗症,提高生活质量。
【参考文献】
[1]Rosenberg GA,Mun-Bryee BS,Wesley M,etal.Collagenase-induced intracerebral hemorrhage in rats[J]. Stroke, 1990, 21(5):801-807.
[2]Bederson JB, Pitts LH, Tsuji M,etal. Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke, 1986, 17(3): 472-476.
[3]Garcia JH, Wagner S, Liu KF,etal. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats statistical validation [J].Stroke, 1995, 26(4): 627-635.
[4]杨敏、姜伟.运动训练对大鼠脑可塑性影响的研究进展[J].中国康复医学杂志,2006,21(10):953-956.
[5]Hayden MS, Ghosh S. NF-κB in immunobiology[J]. Cell Res, 2011, 21(2):223-244.
[6]Mincheva S, Garcera A, Gou-Fabregas M,etal. The canonical nuclear factor-kappaB pathway regulates cell survival in a developmental model of spinal cord motoneurons[J]. J Neurosci, 2011, 31(17):6493-6503.
[7]Chen YL, Law PY, Loh HH. Sustained activation of phosphatidylinositol 3-kinase/Akt/nuclear factor kappaB signaling mediates G protein-coupled delta-opioid receptor gene expression[J]. J Biol Chem, 2006, 10, 281(6):3067-3074.
[8]Yeo SS,Jang SH.Recovery of an injured corticospinal tract and an injured corticoreticular pathway in a patient with intracerebralhemorrhage[J].Neurol Rehabil,2013,32(2):305-309.
[9]林敏,邹少娜.小量脑出血患者早期康复治疗的临床研究[J].重庆医学,2014,4,43(12):1442-1444.
[10] 孙勇,侍坚,陆佩华,等.神经营养因子与神经干细胞[J].生理科学进展,2002,33(4):313-316.
[11] 贺丹,刘怀军,汪国石,等.外源性神经生长因子在脑血肿灶周围组织中的表达及对神经功能恢复的影响[J].中国临床康复,2004,8(31):6894-6895.
[12] Liu W,Unick J,Galik E,etal.Barthel index of activities of daily living:item response theory analysis of ratings for longterm care residengts[J].Nurs Res,2015,64:88-99.
[13] FY Hsieh,HH Lin,SH Hsu. 3D bioprinting of neural stem cell-laden thermoresponsive biodegradable polyurethane hydrogel and potential in central nervous system repair[J].J Biomateriais,2015,71:48-57.
[14] 乌优图,王运杰.神经生长因子对神经干细胞分化及神经元轴突形成的影响[J].中国组织工程与临床康复,2008,12(29):5631-5635.
[15] R Levi-Montalcini,PU Angeletti. Essential role of the nerve growth factor in the survival and maintenance of dissociated sensory and sympathetic embryonic nerve cells in vitro[J].J Developmental Biology, 2014, 7(63):65.
[16] 项婕,潘小娟.鼠神经生长因子对急性脑出血患者肿瘤坏死因子-α、血清基质金属蛋白酶-9和超氧化物歧化酶水平的影响[J].实用药物与临床,2014,17:412-415.
[17] 刘怀军,贺丹.神经生长因子对脑出血血肿灶周神经元和神经胶质细胞的影响[J].中国急救医学,2005,25(9):651-653.
[18] 常焕显,何晓英,庄建光,等.神经生长因子对大鼠脑血肿周围细胞凋亡的影响[J].药学与临床研究,2008,16(6):440-443.
[19] 李强,伍亚民.神经生长因子与血管形成的研究进展[J].国外医学外科学分册,2005,32(3):220-223.
[20] Tanaka A,Wakita U,Kambe N,etal.An antocrine function of nerve growth Factor for cell cycle regulation of vascular endothelial cells[J].J Biochem Biophys Res Commum,2004,3(13):1009-1014.
[21] 花放,方秀斌.短暂性全脑缺血后再灌注大鼠纹皮质血管c-Fos蛋白表达及CGRP和NGF的影响[J].解剖科学进展,2006,12(1):15-17.
