VGCC抗体在带状疱疹中的临床意义研究
2018-07-06欧册华
傅 佳,许 飏,欧册华
(西南医科大学附属医院:1疼痛科;2皮肤科,四川泸州 646000)
带状疱疹(herpes zoster,HZ)是在初次水痘带状疱疹病毒感染后发生的急性皮肤病。病毒在背根神经节内保持静止状态,在机体免疫力低下时,潜伏的病毒可以再激活,并沿着感觉神经的走行,向感觉神经节支配的相应皮区扩散,在相应的神经节支配区域发生带状疱疹,其特点为成簇的水泡和严重的疼痛,称为带状疱疹性神经痛[1-2]。带状疱疹后神经痛(post herpetic neuralgia,PHN)是带状疱疹最常见的并发症,是指带状疱疹皮损痊愈后,在皮损部位出现的持续性疼痛,包括持续性烧灼痛、针刺样疼痛和异常性疼痛等[3-4]。年龄大于60岁的老人当中大约1%会发生带状疱疹,且发病率随着年龄增加而增加,随着人口老龄化的加剧和社会心理压力的加大,带状疱疹的发病率不断攀升。带状疱疹患者当中大约近20%的患者在皮疹消退后依然发生PHN,其属于一种特殊的神经病理性痛,发病机理复杂,病人长期遭受疼痛的折磨,且对患者及家庭成员的生活质量也产生严重影响。在临床上,尽管治疗PHN的方法很多,治疗效果均不如意,目前还没一种行之有效的方法对其进行预防和治疗[5-7]。因此,对其危险因素研究日益受到重视。
电压门控钙通道(voltage-gated calcium channel,VGCC)在调节神经递质释放、神经网络活动、细胞内信号通路和基因表达等生理功能中发挥重要作用。一些病理状况,包括神经损伤,可能导致VGCC及其亚单位的功能失调,从而导致疼痛等疾病的发展[8]。近年来,离子通道在疼痛中的作用已被广泛报道,其中钙离子通道参与伤害性信息的传递在临床上已得到普遍认可[9]。阻断钙通道可减少神经递质释放从而达到镇痛作用已在多个实验中得到证实[10-12]。已有研究发现在周围神经疾病患者的血清中可以检测出钙离子通道抗体,并与疾病程度有一定相关性[13]。但目前外周血中VGCC抗体在HZ和PHN发生发展过程中的确切作用目前还不清楚。本研究通过对HZ患者治疗前、后进行疼痛评分、分级,检测外周血中VGCC抗体含量,为临床更好的治疗HZ以及预防PHN的发生提供理论依据。
1 材料和方法
1.1 研究对象
选取2016年4月至2017年5月西南医科大学附属医院皮肤科及疼痛科住院的带状疱疹患者50例,男女不限。正常对照组选取我院体检中心健康的自愿者20例,男女不限。纳入标准:①具有典型的临床症状及体征,符合带状疱疹诊断标准[14]。②无高血压、糖尿病及其他引起疼痛的疾病。③认知功能完整,无精神病史及精神病家族史。④同意接受采血及各种问卷调查。⑤所有患者入院前未经任何治疗。⑥带状疱疹发生部位以胸腹背部为主,皮损程度为中度。排除标准:合并有疼痛性疾病、恶性肿瘤、免疫性疾病(HIV(+)等),既往有精神病史和精神病家族史,以及住院时间未满10 d、住院期间内发生其他重大事件(如过敏性休克、心跳骤停、严重感染等)、未完成随访、妊娠、哺乳等患者。
1.2 疼痛评估
采用视觉模拟评分法(visual analogue scale,VAS)对患者入院当日的疼痛程度进行评估。由医师向患者说明VAS评分细则,由患者根据疼痛程度自行评分,0表示无痛,10表示剧痛,中间部分表示不同程度的疼痛。疼痛程度判断标准::0~3为轻度疼痛,4~6为中度疼痛,7~10为重度疼痛。
1.3 标本采集与处理
用含EDTA的一次性采血管无菌采集带状疱疹患者和健康献血者入院第一天、治疗10~14 d后的外周肘静脉血5 mL,分离血清,置于-80℃低温冰箱待检。采用人钙离子通道抗体酶联免疫分析试剂盒(北京诚林生物科技有限公司)检测钙离子通道抗体,具体操作按说明书进行。
1.4 统计学方法
采用SPSS 17.0统计软件分析,定量资料以x±s表示,组间比较采用t检验、单因素方差分析,P<0.05认为差异具有统计学意义。
2 结 果
50例急性期带状疱疹痛患者,男27例,女23例,平均年龄(49.21±5.93)岁,健康自愿者20例,男11例,女 9例,平均年龄(47.58±4.92)岁,两组年龄、性别差异无显著性。50例患者均完成了随访,VAS评分:轻度疼痛患者9例,中度疼痛患者21例,重度疼痛患者20例。其中有9例发生了PHN,发生率为18%。
2.1 HZ患者治疗前、治疗后及正常组血清中VGCC抗体含量比较
治疗前血清中VGCC抗体含量低于治疗后及正常组,差异有统计学意义(P<0.05);治疗后血清中VGCC抗体含量仍低于正常组,差异有统计学意义(P < 0.05)(见表1)。

表1 治疗前后及正常组VGCC抗体含量(x±s)
2.2 HZ患者发生PHN与未发生PHN患者治疗前及治疗后VAS评分、VGCC抗体含量比较
分析结果显示治疗前发生PHN者VAS较未发生PHN者高,VGCC抗体较未发生PHN者低,差异有统计学意义(P<0.05)。治疗后发生PHN者VGCC抗体较未发生PHN者低,差异有统计学意义(P<0.05)(见表2)。

表2 发生PHN与未发生PHN患者治疗前后VAS评分与VGCC抗体含量
2.3 HZ患者不同疼痛程度时血清中VGCC抗体含量比较
分析结果显示:轻度疼痛与中度疼痛患者之间血清中VGCC抗体含量比较差异有统计学意义(P<0.05);中度疼痛与重度疼痛患者之间血清中VGCC抗体含量比较差异有统计学意义(P<0.05);轻度疼痛与重度疼痛患者之间血清中VGCC抗体含量比较差异有统计学意义(P<0.05)(见表3)。
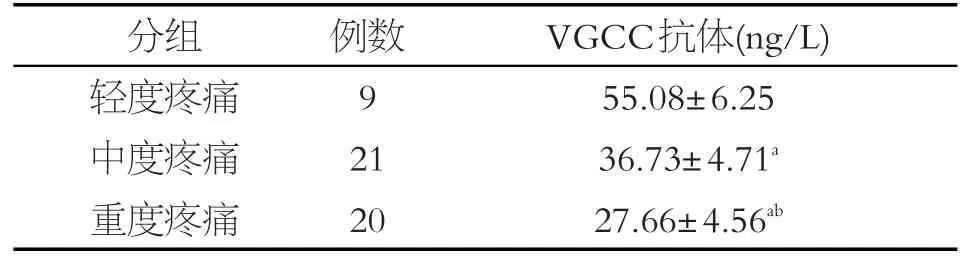
表3 不同疼痛程度VGCC抗体含量(x±s)
3 讨 论
HZ是由潜伏在脊神经后根或三叉神经节的VZV重新复制、激活引起的常见皮肤病,可发生在任何曾感染VZV的患者,老年、使用激素、化疗以及艾滋病毒感染等更易引发HZ[15]。HZ最常见的并发症是PHN,使患者长期遭受疼痛的折磨,甚至部分病例还可引起严重的神经系统并发症,如脑炎、脊髓炎等,甚至死亡[16,-17]。
VGCC抗体即P/Q型电压门控钙离子通道抗体,属于IgG抗体,主要作用于P/Q型钙离子通道,在大脑和周围神经系统中广泛表达,对调节神经性疼痛很重要,受累组织主要是外周神经[17]。在坐骨神经结扎模型中,神经损伤引起DRG神经元内CaV2.2表达上调,导致机械性痛觉过敏[11]。治疗神经病理性疼痛的药物如加巴喷丁胶囊一直被认为是治疗HZ的一线药物,其主要作用机制是通过阻断钙离子通道从而阻断信息传递,抑制谷氨酸释放,最终阻断神经病理性疼痛的传递[14,19],这也从侧面证实了钙离子通道在HZ中的作用。
近几年P/Q型钙离子通道在疼痛中的研究中取得了较大进展[20-21],但由于直接检测离子通道的方法操作复杂、有创、技术设备要求高等缺点,临床上直接检测离子通道表达情况存在困难。因此,本实验通过检测血清VGCC抗体含量来推测钙离子通道在HZ中的表达情况。
最近有文献报道在大鼠部分坐骨神经结扎模型中,神经受损后DRG神经元内,N型钙离子通道电流表达增加,同时P/Q型钙离子通道电流表达下调,P/Q型钙离子通道电流在DRG神经元内整体减少[22]。本实验对HZ患者血清VGCC抗体检测结果显示治疗前血清中VGCC抗体含量较低,经过治疗后VGCC抗体含量升高,提示可能在HZ患者DRG神经元内也存在相同的现象,P/Q型钙离子通道表达下降,体内产生抑制P/Q型钙离子通道的VGCC抗体减少,HZ患者的疼痛可能主要是由N型钙离子通道电流增加所致,这也解释了为什么加巴喷丁胶囊治疗HZ疼痛可以取得较好的效果。
Marinelli等在大鼠坐骨神经慢性压榨损伤模型(CCI)中研究发现 CaV2.1α1(P/Q型钙离子通道亚基)缺失早期虽可降低CCI诱发的疼痛,但后期观察发现实验大鼠受损神经的恢复延迟,并且导致肌肉力量降低,推测P/Q型钙离子通道对受损神经的恢复具有重要作用[23]。本研究发现HZ患者(50例)中发生PHN者(9例)治疗前及治疗后血清中的VGCC抗体含量较未发生PHN者(41例)低,因此,推测P/Q型钙离子通道表达下调可能在PHN的形成过程中发挥重要作用。
4 结论
HZ患者发生PHN与未发生PHN患者治疗前VAS评分分析结果显示发生PHN者治疗前VAS较未发生PHN者高,所以推测治疗前VAS评分越高越容易发生PHN。对HZ患者进行疼痛分级显示,中重度疼痛患者血清中VGCC抗体的浓度明显低于轻度疼痛,且血清VGCC抗体浓度的变化随疼痛程度的变化而变化,表明血清VGCC抗体浓度与患者的疼痛程度成负相关,推测VGCC抗体的降低可能是引起带状疱疹患者疼痛的重要介质。所以急性期VGCC抗体含量的检测以及疼痛程度的评定对预测PHN的发生可能具有一定价值。
1. Choi WS.Herpes zoster vaccine in Korea[J].Clinical and experimental vaccine research,2013,2(2):92-96.
2. Song H,Lee J,Lee M,et al.Burden of illness,quality of life,and healthcare utilization among patients with herpes zoster in South Korea:a prospective clinical-epidemiological study[J].International Journal of Infectious Diseases:IJID:Official Publication of the International Society for Infectious Diseases,2014,20:23-30.
3. Bayat A,Burbelo PD,Browne SK,et al.Anti-cytokine autoantibodies in postherpetic neuralgia[J].Journal of translational medicine,2015,13:333.
4. John AR,Canaday DH.Herpes Zoster in the Older Adult[J].Infectious Disease Clinics of North America,2017,31(4):811-826.
5. Tyring SK.Management of herpes zoster and postherpetic neuralgia[J].Journal of the American Academy of Dermatology,2007,57(6 Suppl):S136-S142.
6. 李锦.TDP联合辣椒碱软膏治疗带状疱疹后遗神经痛疗效观察[J].泸州医学院学报,2006,29(03):232-233.
7. Weinke T,Glogger A,Bertrand I,et al.The societal impact of herpes zoster and postherpetic neuralgia on patients,life partners,and children of patients in Germany[J].The Scientific World Journal,2014,2014:749 698.
8. Gong N,Pak J,Luo ZD.Injury-induced maladaptation and dysregulation of calcium channel alpha2 delta subunit proteins and its contribution to neuropathic pain development[J].British Journal of Pharmacology,2017,23:13930.
9. BourinetE,Altier C,Hildebrand ME,et al.Calcium-permeable ion channels in pain signaling[J].Physio-Logical Reviews,2014,94(1):81-84.
10. Palhares MR,Silva JF,Rezende MJS,et al.Synergistic antinociceptive effect of a calcium channel blocker and a TRPV1 blocker in an acute pain model in mice[J].Life Sciences,2017,182:122-128.
11. Patel R,Bauer CS,Nieto-rostro M,et al.alpha2delta-1 gene deletion affects somatosensory neuron function and delays mechanical hypersensitivity in response to peripheral nerve damage[J].The Journal of Neuroscience:the Official Journal of the Society for Neuroscience,2013,33(42):16 412-16 426.
12. Francois A,Kerckhove N,Meleine M,et al.State-dependent properties of a new T-type calcium channel blocker enhance Ca(V)3.2 selectivity and support analgesic effects[J].Pain,2013,154(2):283-293.
13. Waterman SA.Autonomic dysfunction in Lambert-Eaton myasthenic syndrome[J].Clinical Autonomic Research:Official Journal of the Clinical Autonomic Research Society,2001,11(3):145-154.
14. Beal B,Moeller-bertram T,Schilling JM,et al.Gabapentin for once-daily treatment of post-herpetic neuralgia:a review[J].Clinical Interventions in Aging,2012,7:249-255.
15. Sinayobye J,Hoover DR,Shi Q,et al.Prevalence of shingles and its association with PTSD among HIV-infected women in Rwanda[J].BMJ Open,2015,5(3):e005 506.
16. Amlie-Lefond C,Jubelt B.Neurologic manifestations of varicella zoster virus infections[J].Current Neurology and Neuroscience Reports,2009,9(6):430-434.
17. WollinaU,Machetanz J.[Herpes zoster and postherpetic neuralgia][J].Der Hautarzt;Zeitschrift fur Dermatologie,Venerologie,Und Verwandte Gebiete,2016,67(8):653-665.
18.Zhou X,Wang W,Zhang S,et al.CACNA1B(Cav2.2)Overexpression and Its Association with Clinicopathologic Characteristics and Unfavorable Prognosis in Non-Small Cell Lung Cancer[J].Disease Markers,2017,2017:6 136 401.
19. Yang Y,Yang F,Yang F,et al.Gabapentinoid insensitivity after repeated administration isassociated with Down-Regulation of the alpha(2)delta-1 subunit in rats with central post-stroke pain hypersensitivity[J].Neuroscience Bulletin,2016,32(1):41-50.
20. Xue M,Rosenmund C.The headache of a hyperactive calcium channel[J].Neuron,2009,61(5):653-654.
21. Luvisetto S,Marinelli S,Panasiti MS,et al.Pain sensitivity in mice lacking the Ca(v)2.1 alpha1 subunit of P/Q-type Ca2+channels[J].Neuroscience,2006,142(3):823-832.
22.MuraliSS,Napier IA,Mohammadi SA,et al.High-voltage-activated calcium current subtypes in mouse DRG neurons adapt in a subpopulation-specific manner after nerve injury[J].Journal of neurophysiology,2015,113(5):1 511-1 519.
23. Marinelli S,Eleuteri C,Vacca V,et al.Effects of age-related loss of P/Q-type calcium channels in a mice model of peripheral nerve injury[J].Neurobiology of Aging,2015,36(1):352-364.
