基于超临界二氧化碳萃取的复合技术在同种异体骨体外处理的应用
2018-07-06刘舒云黄靖香郝春香鲁晓波郭全义
鲜 海,刘舒云,眭 翔,黄靖香,郝春香,鲁晓波,郭全义
(1西南医科大学附属医院骨与关节外科,四川泸州 646000;2中国人民解放军总医院骨科研究所)
骨缺损,尤其是大段骨缺损的治疗,一直是临床难题之一。临床常用的方法包括:带血管蒂骨移植手术、牵引成骨技术、诱导膜技术、钛网cage技术、组织工程方法等技术[1],常用的材料包括:自体骨[2]、同种异体骨、异种骨、骨水泥、生物陶瓷、组织工程骨等[3-5]。这些技术及材料有各自的适应症和局限性,在临床应用过程中,需要结合骨缺损的位置和大小以及周围条件选择。
同种异体骨具有大小和形状不受限制、生物力学特性和结构与自体骨相似、制备和保存方便等特点,是目前可用于替代自体骨的良好的骨缺损修复材料[5]。新鲜的同种异体骨由于其较强的免疫原性,导致临床排异等问题,经过深低温冷冻、物理或者化学处理可大大降低其免疫原性。但在同种异体骨脱脂、脱蛋白、灭菌、保存过程中可能导致骨组织原有的骨诱导活性及其生物力学性能下降。
超临界二氧化碳是指二氧化碳在临界条件下(温度=31.26℃,压力=72.9 atm)表现为既不是气体也不是液体的特殊状态,其扩散能力及溶解能力增加,具有萃取低分子物质的能力。由于其反应条件温和、反应过程无毒无残留且易于操作,它作为溶剂已被广泛应用于化工[6]、食品工业[7]、生物学[8]、药学[9]、组织工程[10]等领域。本研究通过评估基于超临界二氧化碳萃取的复合技术对猪股骨松质骨空间结构、生物特性、力学特性等的影响,旨在为同种异体骨修复材料开发更合理的制备技术。
1 材料和方法
1.1 原材料的获取及预处理
将新鲜市售猪股骨(猪骨获取时间小于12 h)剔除骨表面肌肉、肌腱、筋膜、骨膜等软组织,放入足量的纯净水中清洗浸泡1 h,再放入-80°C冰箱内冻存24 h。取出猪骨并在4°C冰箱内解冻后,用高精度微型台锯将股骨远端松质骨锯成10 mm×10 mm×10 mm左右的正方形骨块,所有制备的猪松质骨分装后放入-40°C冰柜保存备用。
1.2 主要实验仪器
本实验所用仪器为Nova2200型超临界二氧化碳清洗设备(见图1),它由增压泵(外接二氧化碳罐,内接反应容器)、泄压阀门以及控制这些设备的电脑组成。它可通过主屏幕设置参数并控制反应容器内部压力和温度,同时也可控制运行时间及泄压速度等,当压力不足时可自行停止运行。目前该机型已被用于心脏瓣膜[11]、肺基质[12]、羊膜[13]、牛皮质骨[14]等组织灭菌的研究。

图1 Nova2200型超临界二氧化碳清洗设备
1.3 实验分组及处理方法
根据动物骨的处理方法,将研究分成三组:①非超临界组(对照组),即猪股骨松质骨经过高压水枪彻底冲洗,再经3%双氧水脱脂灭菌,制备出猪股骨松质骨修复材料,经冷冻干燥后获得1号材料;②超临界复合超声波组(实验组1),即猪股骨松质骨依次由超声波清洗离心、超临界二氧化碳萃取脱脂以及化学清洗(过氧化氢、氢氧化钠)等组成的复合清洗技术处理,制备出的猪股骨松质骨修复材料,经冷冻干燥后获得2号材料;③超临界复合高压水枪组(实验组2),即猪股骨松质骨依次由高压水枪冲洗、超临界二氧化碳萃取脱脂以及化学清洗(过氧化氢、氢氧化钠)等组成的复合清洗技术处理,制备出的猪股骨松质骨修复材料,经冷冻干燥后获得3号材料。其中,超临界组(实验组1和实验组2)主要清洗步骤依次为:第一步:超声波清洗离心或高压水枪清洗;第二步:超临界萃取脱脂;第三步:化学清洗(过氧化氢、氢氧化钠)等,制备所得的所有骨组织经冷冻干燥后分装备用。在第一步和第二步前后以及冷冻干燥后对猪股骨松质骨进行拍照称重。
1.4 主要的评价指标
1.4.1 超临界组(实验组1和实验组2)对猪股骨松质骨清洗效率的评价
评估猪股骨松质骨在处理前、处理中及处理后外观变化和质量变化,分析实验组1和实验组2步骤中超声波清洗离心的方法与高压水枪的方法的差别。
1.4.2 Micro-CT检测猪松质骨骨小梁变化及骨组织孔隙率初步评估
1、2、3号材料中,每组选取三个骨块予以Micro-CT扫描仪(美国GE Healthcare公司,RS-9系统)扫描。主要参数设置为:分辨率45μm,扫描电压80 kv,扫描电流450 mA,曝光时间200 ms。所得的图像先进性分类,然后再在各组中选择兴趣区(region of interest,ROI):ROI Size X=6.0176,Y=6.017 6,Z=6.017 6。根据数据重建骨组织三维结构图像观察最小梁完整性,自动图像分析取得最佳阈值,将所得的图像结果予以分析得到骨组织体积分数(BVF),反向(1-BVF)求得骨组织孔隙率大小。此值近似于骨组织孔隙率,可作为评估骨组织孔隙大小的参考。
1.4.3 压缩力学检测
1、2、3号材料及未经处理的猪松质骨,各取三个样品进行压缩力学测试。骨组织压缩检测在5969力学试验机(美国INSTRON英斯特郎)上完成,实验测试期间载荷通过载荷传感器进行传递。将样品放在工作台上,猪骨以2 mm/min的压缩速度在近似正方体的骨组织上方施压,直至骨组织发生变形破裂停止测试,得出数据。根据记录的应力-应变曲线求出弹性模量。对各组骨组织的极限强度、最大载荷以及弹性模量进行比较分析。
1.4.4 细胞毒性评价
1、2、3号材料参照浸提液制备的方法制备浸提液,设置阴性组作对照,再按照MTT比色法检测各组第1、2、3、4 d的OD值,绘制各组细胞时间生长曲线,比较分析三组处理方法所得骨组织对细胞毒性的差异。
1.5 统计学分析
力学原始数据予以Origin9软件处理,GraphPad Prism 6作图,统计分析使用SPSS 22.0统计软件进行,计量资料用x±s表示,多个样本均数比较采用单因素方差分析(one-way ANOVA),分类资料用χ2检验,P<0.05认为有统计学意义。
2 结 果
2.1 超临界组(实验组1和实验组2)对异种骨处理效率的评价。
从各步骤猪股骨松质骨外观变化来看,实验组1及实验组2两组方法处理获得的2号材料和3号材料呈白色,未见骨髓及脂肪附着,且骨组织结构较为完整。高压水枪清洗后的猪骨松质骨较超声波清洗后的骨组织干净,较少骨髓及脂肪残留。
从各步骤猪股骨松质骨质量变化来看,猪股骨松质骨经实验组1及实验组2两组方法处理后重量分别下降60.93%和61.96%。其中,超声波清洗离心、高压水枪冲洗可猪股骨松质骨重量分别下降5.96%和46.63%,高压水枪冲洗的方法清洗效率高于超声波清洗离心法(见图2)。

图2 实验组1和实验组2处理过程对猪股骨的外观及重量影响
2.2 三组方法对骨小梁的影响及骨组织孔隙率初步评估
三组方法处理后的猪松质骨结构完整,未见明显破坏。三种方法处理的猪松质骨孔隙率进行整体比较无明显变化,差异无统计学意义(P>0.05)(见表1,图3)。
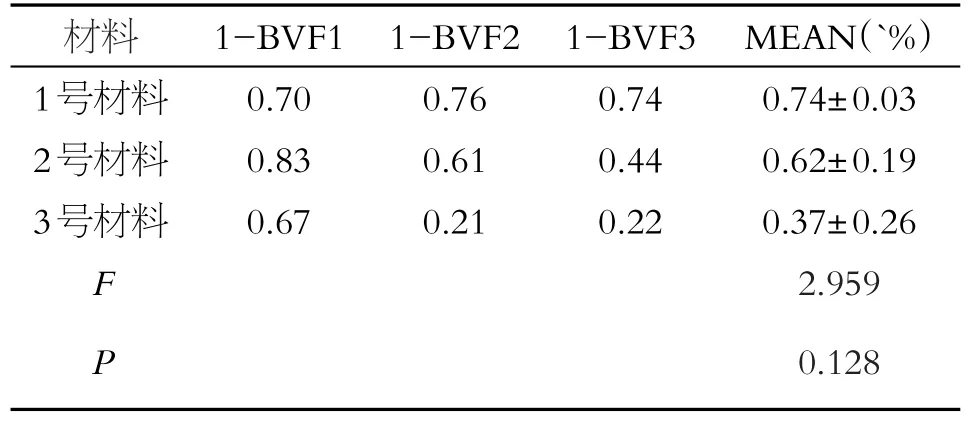
表1 猪股骨松质骨孔隙率(x±s)
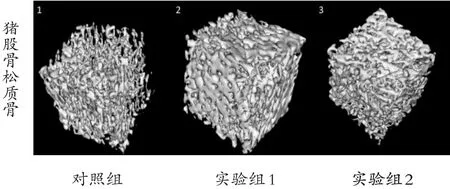
图3 1、2、3号材料经Micro-CT扫描获得骨小梁三维图像
2.3 三组处理方法对猪股骨松质骨压缩力学的影响
未经处理的猪股骨松质骨(原材料)、1号、2号、3号材料的压缩力学数据进行Origin 9软件处理;1号、2号、3号材料的极限强度、最大载荷和弹性模量分别与原材料比较,差异无统计学意义(P>0.05),可认为对照组、实验1、2组的方法不会导致猪股骨压缩力学发生改变。四类材料的骨组织极限强度、最大载荷及弹性模量差异均无统计学意义(P>0.05)(见表2)。
2.4 细胞毒性评价
本实验对1、2、3号材料的细胞毒性(MTT试验)进行了评价(见图4),发现三组第1、2、3、4 d的OD值与阴性组比较未见组间差异(P>0.05),无统计学意义。
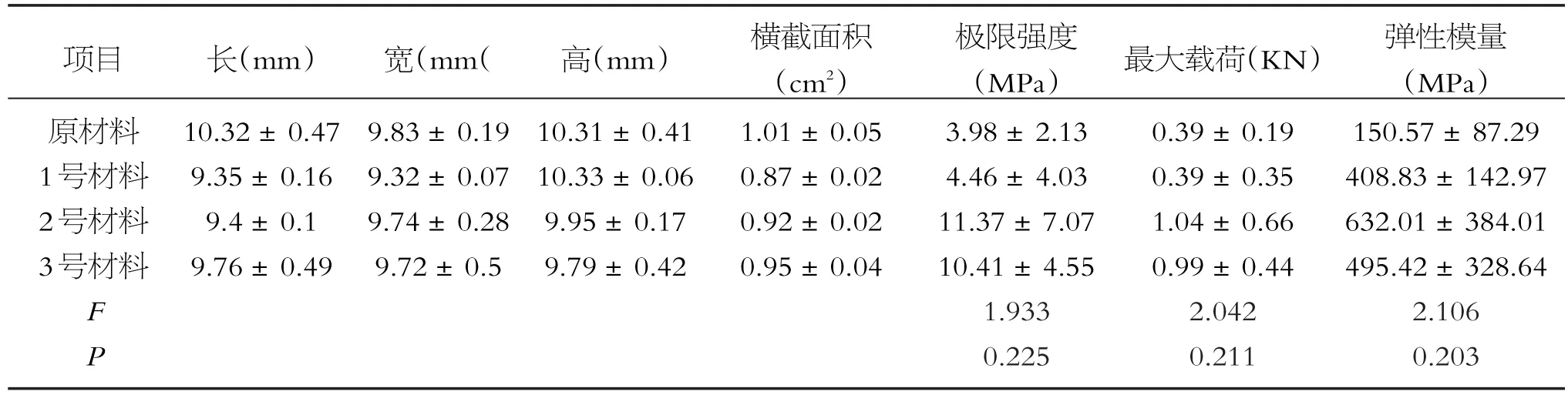
表2 原材料及1、2、3号材料压缩力学结果比较(x±s)

图4 各组细胞毒性(MTT试验)结果
3 讨 论
同种异体骨临床应用十分广泛。在大段骨缺损结构性植骨的患者中发生骨折的风险仍然较高。在同种异体骨脱脂、脱蛋白、灭菌以及保存的过程中,物理或者化学的方法可导致生物力学的改变或有毒有害试剂残留。基于超临界二氧化碳萃取的复合清洗技术自身有以下优点:超声波清洗离心或者高压水枪清洗可有效去除骨组织内部大部分骨髓及脂肪。有文献报道利用高压脉冲的方式可使同种异体骨的脂肪含量下降95%[15]。该步骤可降低骨组织脂肪负荷,减少超临界二氧化碳萃取时间,节约成本。同时,超临界二氧化碳更容易经孔隙进入骨组织内部,有利于微孔内油脂的萃取分离。化学清洗中,过氧化氢溶液可以进一步氧化脱脂及灭菌,氢氧化钠可皂化脂肪及脱蛋白。在经过冷冻干燥后的骨组织便于常温保存。本实验中超声波清洗离心或者高压水枪清洗的步骤显示出很好的清洗作用同时不损害猪股骨松质骨小梁结构。基于超临界二氧化碳萃取的复合清洗技术与对照组方法相比,均不会导致猪股骨松质骨小梁结构破坏,保留了猪股骨松质骨原有的孔隙及孔隙率。周腾[16]利用仿真建模和有限元分析研究发现多孔支架宏孔和贯通孔的尺寸与成骨性能有显著关系,故良好的孔隙结构有利于血管长入,促进骨再生。经基于超临界二氧化碳萃取的复合清洗技术处理的骨组织与未处理的骨组织压缩力学比较发现强度极限、最大载荷以及弹性模量未发生改变。这一点与Mitton等[17]的研究一致。Mitton将人股骨头分为两半,一半进行超临界处理,一半冻存,最后进行力学对比测试发现,超临界二氧化碳萃取技术不会导致骨组织力学改变。基于超临界二氧化碳萃取的复合清洗技术处理的骨组织经细胞毒性检测(MTT法)提示无细胞毒性,可认为该技术不会导致有毒试剂残留,处理过程安全。
基于超临界二氧化碳萃取的复合清洗技术是一种安全、可靠的技术,它在异种松质骨脱脂脱蛋白等处理方面显示了较好的效果,同时保留了松质骨原有的生物力学结构,且无毒性试剂残留。故该方法亦可用于同种异体骨修复材料的制备。本实验在超临界二氧化碳萃取过程中添加过氧化氢提示了较好的脱脂能力。因此,当添加合适的夹带剂可开发超临界二氧化碳新的功能。目前已有报道在超临界二氧化碳中添加乙醇可达到脱细胞的目的,已被开发用于猪角膜[18]、老鼠心脏[19]、绵羊主动脉[20]等组织的脱细胞的研究。超临界二氧化碳技是一种绿色安全的技术可被进一步开发。
4 结 论
超临界二氧化碳萃取技术已被广泛应用于各个领域。基于超临界二氧化碳萃取的复合清洗技术脱脂处理后的松质骨展示出良好的生物力学性能及安全性。该技术中超声波及高压枪冲洗步骤可为超临界萃取减少负担,而且额外的化学清洗步骤不仅能脱脂还具有灭菌功效,用于同种异体骨脱脂等加工可能降低疾病传播风险,因此基于超临界二氧化碳萃取的复合清洗技术是一种绿色安全可靠的技术。
1. 戚晓阳,邱旭升,施鸿飞,等.大段骨缺损的治疗进展[J].实用骨科杂志,2017,08:715-719.
2. 葛建华,邓勇,鲁晓波,等.PRP对游离自体髂骨移植重建肢体骨缺损的实验研究[J].泸州医学院学报,2015,38(5):469-475.
3. 袁冰,韦卓.骨缺损修复的研究进展[J].生物骨科材料与临床研究,2014,03:38-41.
4. 韩倩倩,薛彬,王涵,等.骨组织工程材料的研究进展[J].组织工程与重建外科杂志,2017,06:343-345.
5. 毕志伟,黄东,欧阳海洋.同种异体骨移植治疗骨缺损的应用研究进展[J].中国临床解剖学杂志,2014,05:623-625.
6. 张娟,郑环达,郑来久.超临界二氧化碳染色工艺技术研究进展[J].染料与染色,2015,04:22-29.
7. Uddin M S,Sarker M Z,Ferdosh S,et al.Phytosterols and their extraction from various plant matrices using supercritical carbon dioxide:a review[J].J Sci Food Agric,2015,95(7):1 385-1 394.
8. Efaq A N,Rahman N N N A,Nagao H,et al.Supercritical Carbon Dioxide as Non-Thermal Alternative Technology for Safe Handling of Clinical Wastes[J].Environmental Processes,2015,2(4):797-822.
9. Zhu H,Zhang L,Wang G,et al.Sedative and hypnotic effects of supercritical carbon dioxide fluid extraction from Schisandra chinensis in mice[J].J Food Drug Anal,2016,24(4):831-838.
10.Kim S H,Kim S H,Jung Y.TGF-beta3 encapsulated PLCL scaffold by supercritical CO2-HFIP co-solvent system for cartilage tissue engineering[J].J Control Release,2015,213:e100-e101.
11. Hennessy R S,Jana S,Tefft B J,et al.Supercritical carbon dioxide-based sterilization of decellularized heart valves[J].JACC Basic Transl Sci,2017,2(1):71-84.
12. Balestrini J L,Liu A,Gard A L,et al.Sterilization of Lung Matrices by Supercritical Carbon Dioxide[J].Tissue Eng Part C Methods,2016,22(3):260-269.
13. Wehmeyer J L,Natesan S,Christy R J.Development of a Sterile Amniotic Membrane Tissue Graft Using Supercritical Carbon Dioxide[J].Tissue Eng Part C Methods,2015,21(7):649-659.
14. Russell N,Rives A,Pelletier M H,et al.The effect of supercritical carbon dioxide sterilization on the anisotropy of bovine cortical bone[J].Cell Tissue Bank,2015,16(1):109-121.
15.Haimi S,Wahlman M,Mannila M,et al.Pulse-lavage washing is an effective method for defatting of morselized allograft bone in the operating theater[J].Acta Orthop,2008,79(1):94-97.
16. 周腾.利用仿真建模和有限元分析研究宏观孔隙结构与骨诱导行为的相关性[D].西南交通大学,2017.
17. Mitton D,Rappeneau J,Bardonnet R.Effect of a supercritical CO2 based treatment on mechanical properties of human cancellous bone[J].Eur J Orthop Surg Traumatol,2005,15(4):264-269.
18.Huang Y H,Tseng F W,Chang W H,et al.Preparation of acellular scaffold for corneal tissue engineering by supercritical carbon dioxide extraction technology[J].Acta Biomater,2017,58:238-243.
19. Seo Y,Jung Y,Kim S H.Decellularized heart ECM hydrogel using supercritical carbon dioxide for improved angiogenesis[J].Acta Biomater,2018,67:270-281.
20. Guler S,Aslan B,Hosseinian P,et al.Supercritical Carbon Dioxide-Assisted Decellularization of Aorta and Cornea[J].TissueEng PartC Methods, 2017, 23(9):540-547.
