TLR识别在肿瘤化疗后免疫应答作用研究①
2018-07-06张延梅林泽杭周琛斐
张延梅 林泽杭 周琛斐 吴 砂
(南方医科大学基础医学院免疫教研室,广东省蛋白质组学重点实验室,广州 510515)
Toll样受体是一类可识别病原体相关分子模式的蛋白家族,并可通过激活相关的转录因子产生细胞因子及趋化因子以抵抗病原体的入侵[1,2]。目前研究发现,肿瘤细胞经过放疗或化疗之后,产生一些报警蛋白,即损伤相关分子模式(Damage associated molecular patterns,DAMPs),可被机体通过TLRs识别。本综述重点讲述近年来在肿瘤放化疗研究中,肿瘤细胞产生的抗原种类,机体TLRs(Toll-like receptors)与之结合的机制,及其在临床应用方面的研究进展。
1 肿瘤化疗或放疗后,肿瘤细胞表达的抗原类型
肿瘤细胞经过放疗或化疗之后的损伤相关分子模式(DAMPs),到目前为止共发现四种:①热休克蛋白(Heat shock proteins,HSP);②Ⅰ型干扰素;③高迁移率族蛋白1;④三磷酸腺苷(Adenosine triphosphate,ATP)。
1.1热休克蛋白(HSP) HSP是一类高度保守的蛋白家族,正常情况下在蛋白折叠方面起着重要的作用,参与折叠蛋白的形成。当生活环境发生改变时,HSP产生增加,保护细胞,抵御外界因素改变。乳腺癌阿霉素化疗后,转录因子brn-3b表达增加,靶蛋白热休克蛋白(HSP)分泌,磷酸化HSP-27通过死亡域相关蛋白(DAXX)抑制凋亡,HSP-27通过结合细胞色素C抑制凋亡,促使肿瘤细胞产生耐药性,并促进肌动蛋白的聚合,使乳腺癌细胞具有转移的能力[3]。在胃癌患者中,过高表达的HSP110导致化疗敏感性下降,总生存率降低[4]。热化疗引起肿瘤细胞表面表达大量HSP90,作为一种“找我”信号,树突状细胞接触并摄取HSP90抗原复合物,摄取并提呈给T细胞,引发强力的抗肿瘤免疫[5]。对结肠直肠癌患者,用奥沙利铂(OXA)和/或5-氟尿嘧啶(5-Fu)治疗后,发现细胞释放高水平的HSP70,促进DC的成熟[6]。
1.2Ⅰ型干扰素(IFN) 干扰素是一组具有多种功能的活性蛋白质,主要由单核细胞和淋巴细胞分泌产生,最近的研究发现用蒽环类药物处理肿瘤,激活细胞TLR3受体,通过旁分泌和自分泌途径分泌Ⅰ型干扰素[7]。基因表达分析发现化疗后残余瘤细胞干扰素诱导基因表达增高,引起SATA1的磷酸化和IFN-γ的释放,大量的DNA受损和肿瘤细胞的凋亡,激活SATA1通路,但效应在3周之后消失[8]。
1.3高迁移率族蛋白1(HMGB1) HMGB1是在真核细胞中发现的非组蛋白染色体蛋白,具备DNA结合的特性,能够调控DNA复制、翻译、再结合和染色体稳定等过程。HMGB1还和细胞的运动性和侵袭性有关,是一种与肿瘤进程相关的蛋白。41名乳腺癌患者接受表柔比星和多柔比星化疗的辅助化疗(NCT),发现早期血浆中HMGB1的浓度变化明显,且HMGB1浓度越高,肿瘤退化越明显,可作为一种NCT最终反应的生物标记[9]。进一步研究发现,HMGB1化疗前后差值大于1.1 ng/ml的患者拥有更高的五年生存率[10]。肿瘤细胞在化疗药物的刺激下,通过丝氨酸苏氨酸激酶3(RIP3)和混合谱系激酶(MLKL)通路,诱发细胞程序性死亡,释放HMGB1刺激抗瘤反应[11]。淋巴瘤细胞通过HMGB1引发自噬反应,抑制细胞凋亡,产生耐药性[12]。然而在小鼠肺癌和人结肠癌细胞,化疗存活下来的细胞通过糖基化终末产物受体(RAGE),抑制肿瘤坏死因子α的释放,激活处在静止期的剩余肿瘤细胞,引起肿瘤的再生和转移[13]。
1.4三磷酸腺苷(ATP) ATP是一种不稳定的高能化合物,是人体细胞的直接能源物质,在细胞的生长、增殖等过程中起着重要作用,近来发现ATP还是一种报警蛋白。肿瘤细胞进行化疗后,引起免疫原性细胞死亡(ICD),释放大量ATP到血浆中,刺激垂死肿瘤细胞周围免疫受体的增加[14]。
2 DAMP与Toll样受体结合的多样性
TLR是肿瘤化疗或放疗后产生的DAMP增强抗肿瘤免疫应答的主要结合受体,到目前为止,在人类基因组中已发现10个Toll受体家族成员,为TLR1~TLR10。根据受体位置的不同,可分成膜受体和膜内受体两类,其中TLR1、2、4、5、6、10定位于细胞膜,结合细胞表面或游离的配体;而 TLR3、7、8、9定位于细胞内,为核酸成分的受体。不同的TLR特异性结合不同的配体,DAMP可识别多种TLR并激活其下游通路,DAMP和TLRs进行结合,主要通过以下两个通路对细胞的生理过程进行调节,使其产生相应的生物效应[15,16]。见图1。
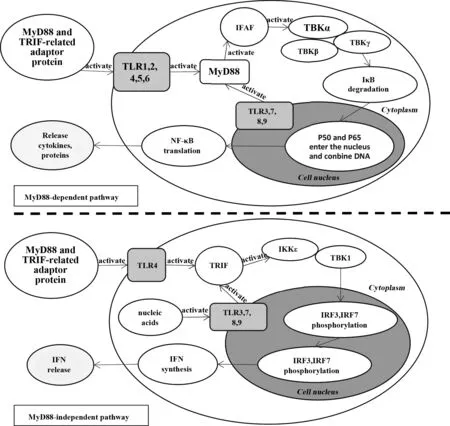
图1 TLRs/MyD88依赖性与非依赖性信号通路Fig.1 TLRs/MyD88 dependent and independent pathway
2.1MyD88依赖性通路 即TLR通过与MyD88直接结合(TLR5/7/8/9)或与TIRAP/MyD88复合物结合(TLR1/2/4/6)激活下游的IRAKs-TRAF6继而激活IKK复合物通路,从而激活转录因子NF-κB使促炎性因子的产生增加[16]。除了TLR3之外,其他所有TLRs都可通过这个通路诱发相应的生物效应。
2.1.1HMGB1 HMGB1可与TLR2和TLR4结合,但二者的结合在结构及机制上均有所不同,在核小体中的HMGB1与TLR2结合,游离的HMGB1则与TLR4结合[17]。Apetoh等[18]发现,全身化疗或局部化疗放疗后的肿瘤细胞所释放的HMGB1可激活TLR4-MyD88通路,临床数据显示,TLR4 Asp299Gly突变后,会影响HMGB1与其受体的结合,从而对乳腺癌患者的预后产生不良影响。
2.1.2HSP HSP主要与TLR4结合,但HSP60可以和TLR2结合[4]。Chen等[19]的研究表明,放疗后的肿瘤细胞所释放的HSP70主要激活DC表面的TLR4-MyD88及TLR4-TRIF通路,从而促进细胞因子的产生及DC细胞的浸润。同时,Vulpis等[20]报道,化疗后的多发性骨髓瘤可通过释放含HSP70的微囊泡激活NK细胞表面的TLR2,从而增强抗肿瘤的天然免疫应答。
2.2MyD88非依赖性通路 即TLR与TRIF直接结合或与TRAM/TRIF复合物结合,不通过MyD88激活TRAF3-IKK/TBK1-IRF3/7或TRAF6-IKKs-NF-κB通路,进而产生Ⅰ型干扰素[16]。TLRs家族中,TLR3、7、8、9均能通过MyD88非依赖性通路发挥相应的作用。
2.2.1IFN TLR3识别双链RNA/聚肌苷酸-聚胞苷酸[poly(I:C)][21],IFNα和IFNβ基因的dsRNA的转录作用依赖于TLR3[22]。双链RNA类似物Poly I:C作用于前列腺肿瘤细胞,结合TLR3,激活细胞内IRF3依赖性凋亡途径,然后自分泌IFN作用于细胞,引起细胞凋亡,来抑制肿瘤生长[23]。纤维肉瘤蒽环霉素化疗激活TLR3-IRF通路,产生IFN,与肿瘤细胞上的IFN受体结合,产生趋化因子10(CXCL10),激发抗肿瘤免疫[24]。
2.2.2HMGB1 Yanai等[25]的结果显示,HMGB1能介导依赖于核酸的TLR3和TLR7的激活,同时,HMGB1可作为DNA的结合蛋白,激活巨噬细胞及DC表面的TLR9,从而介导机体对CpG-DNA的免疫应答[26]。
3 TLRs识别DAMP在临床抗肿瘤的应用
目前,临床上对于TLRs识别DAMP的研究应用主要集中在促进DAMP的释放,同时增强TLR的表达,以加强化疗药物的免疫效应。化疗通过促进肿瘤细胞的死亡来恢复机体的免疫监视功能,但Yang等[11]发现,缺乏RIP3和MLKL的肿瘤细胞释放的HMGB1和ATP会减少,从而产生化疗抵抗性,HMGB1可与TLR4结合以激活DC的下游通路,所以在加入TLR4激动剂和ATPase抑制剂后,这种化疗抵抗性就会减弱甚至消失。而对乳腺癌患者的回顾性临床分析显示,TLR4基因(Asp299Gly)单个核苷酸的突变会阻断HMGB1与TLR4的结合,从而使患者更容易对蒽环类化疗药物产生抗性[18]。顺铂可使肿瘤细胞死亡,释放出内容物,包括HMGB1、HSP等,激活DC表面的TLR4-MyD88通路,Belani等[27]做随机试验发现对于晚期的非小细胞肺癌,化疗药物顺铂-紫杉醇与TLR2激动剂结合的治疗方案与单用顺铂-紫杉醇疗法相比,患者127天的平均存活率更高。按化疗加免疫方案治疗四个循环后,患者总的生存率提高了66天。临床上理想的诱导免疫原性的细胞死亡的化疗药物应该在肿瘤细胞凋亡之前或早期凋亡阶段就可以促进多种类型的DAMP、TLR激动剂及免疫原性分子的释放,从而确保免疫系统对垂死肿瘤细胞的敏感性增强,促进肿瘤免疫应答[28]。
4 结语
TLR是肿瘤放化疗产生DAMP的主要结合受体,在激发机体免疫应答、增强治疗效果方面有着重要作用。肿瘤细胞在放疗后所释放的HMGB1、HSP、IFN等物质通过与免疫细胞的TLR结合,激活下游的MyD88依赖性和非依赖性通路,从而发挥天然免疫和适应性免疫作用杀伤肿瘤细胞。ATP也是一种报警蛋白,但目前尚未发现ATP可与TLR结合。对DAMP和TLR的研究有助于阐明机体对肿瘤的免疫应答机制,为诊断、治疗肿瘤或研发疫苗提供新思路。目前以DAMP为佐剂的疫苗已经得到广泛研究,但还未进入临床应用阶段,但TLR激动剂作为化疗药的辅助药物已经得到广泛应用。DAMP的释放有肿瘤异质性及个体差异性,如何设计出有效的个体化疫苗仍是目前亟待解决的问题。
参考文献:
[1] Gay NJ,Symmons MF,Gangloff M,etal.Assembly and localization of Toll-like receptor signalling complexes[J].Nat Rev Immunol,2014,14(8):546-558.
[2] Kawasaki T,Kawai T.Toll-like receptor signaling pathways[J].Front Immunol,2014,5:461.
[3] Fujita R,Ounzain S,Wang AC,etal.Hsp-27 induction requires POU4F2/Brn-3b TF in doxorubicin-treated breast cancer cells,whereas phosphorylation alters its cellular localisation following drug treatment[J].Cell Stress Chaperones,2011,16(4):427-439.
[4] Kimura A,Ogata K,Altan B,etal.Nuclear heat shock protein 110 expression is associated with poor prognosis and chemotherapy resistance in gastric cancer[J].Oncotarget,2016,7(14):18415-18423.
[5] Zunino B,Rubio-Patino C,Villa E,etal.Hyperthermic intraperitoneal chemotherapy leads to an anticancer immune response via exposure of cell surface heat shock protein 90[J].Oncogene,2016,35(2):261-268.
[6] Fang H,Ang B,Xu X,etal.TLR4 is essential for dendritic cell activation and anti-tumor T-cell response enhancement by DAMPs released from chemically stressed cancer cells[J].Cell Mol Immunol,2014,11(2):150-159.
[7] Sistigu A,Yamazaki T,Vacchelli E,etal.Cancer cell-autonomous contribution of type I interferon signaling to the efficacy of chemotherapy[J].Nat Med,2014,20(11):1301-1309.
[8] Legrier ME,Bieche I,Gaston J,etal.Activation of IFN/STAT1 signalling predicts response to chemotherapy in oestrogen receptor-negative breast cancer[J].Br J Cancer,2016,114(2):177-187.
[9] Arnold T,Michlmayr A,Baumann S,etal.Plasma HMGB-1 after the initial dose of epirubicin/docetaxel in cancer[J].Eur J Clin Invest,2013,43(3):286-291.
[10] Exner R,Sachet M,Arnold T,etal.Prognostic value of HMGB1 in early breast cancer patients under neoadjuvant chemotherapy[J].Cancer Med,2016,5(9):2350-2358.
[11] Yang H,Ma Y,Chen G,etal.Contribution of RIP3 and MLKL to immunogenic cell death signaling in cancer chemotherapy[J].Oncoimmunology,2016,5(6):e1149673.
[12] Liu L,Yang M,Kang R,etal.HMGB1-induced autophagy promotes chemotherapy resistance in leukemia cells[J].Leukemia,2011,25(1):23-31.
[13] Luo Y,Chihara Y,Fujimoto K,etal.High mobility group box 1 released from necrotic cells enhances regrowth and metastasis of cancer cells that have survived chemotherapy[J].Eur J Cancer,2013,49(3):741-751.
[14] Martins I,Michaud M,Sukkurwala AQ,etal.Premortem autophagy determines the immunogenicity of chemotherapy-induced cancer cell death[J].Autophagy,2012,8(3):413-415.
[15] Bhatelia K,Singh K,Singh R.TLRs:linking inflammation and breast cancer[J].Cell Signal,2014,26(11):2350-2357.
[16] Wang JQ,Jeelall Y S,Ferguson LL,etal.Toll-Like Receptors and Cancer:MyD88 Mutation and Inflammation[J].Front Immunol,2014,5:367.
[17] Urbonaviciute V,Furnrohr BG,Meister S,etal.Induction of inflammatory and immune responses by HMGB1-nucleosome complexes:implications for the pathogenesis of SLE[J].J Exp Med,2008,205(13):3007-3018.
[18] Apetoh L,Ghiringhelli F,Tesniere A,etal.Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy[J].Nat Med,2007,13(9):1050-1059.
[19] Chen T,Guo J,Han C,etal.Heat shock protein 70,released from heat-stressed tumor cells,initiates antitumor immunity by inducing tumor cell chemokine production and activating dendritic cells via TLR4 pathway[J].J Immunol,2009,182(3):1449-1459.
[20] Vulpis E,Cecere F,Molfetta R,etal.Genotoxic stress modulates the release of exosomes from multiple myeloma cells capable of activating NK cell cytokine production:Role of HSP70/TLR2/NF-kB axis[J].Oncoimmunology,2017,6(3):e1279372.
[21] Gay NJ,Gangloff M.Structure and function of Toll receptors and their ligands[J].Annu Rev Biochem,2007,76:141-165.
[22] Alexopoulou L,Holt AC,Medzhitov R,etal.Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3[J].Nature,2001,413(6857):732-738.
[23] Gambara G,Desideri M,Stoppacciaro A,etal.TLR3 engagement induces IRF-3-dependent apoptosis in androgen-sensitive prostate cancer cells and inhibits tumour growth in vivo[J].J Cell Mol Med,2015,19(2):327-339.
[24] Sistigu A,Yamazaki T,Vacchelli E,etal.Cancer cell-autonomous contribution of type I interferon signaling to the efficacy of chemotherapy[J].Nat Med,2014,20(11):1301-1309.
[25] Yanai H,Ban T,Wang Z,etal.HMGB proteins function as universal sentinels for nucleic-acid-mediated innate immune responses[J].Nature,2009,462(7269):99-103.
[26] Ivanov S,Dragoi A M,Wang X,etal.A novel role for HMGB1 in TLR9-mediated inflammatory responses to CpG-DNA[J].Blood,2007,110(6):1970-1981.
[27] Belani C P,Chakraborty B C,Modi R I,etal.A randomized trial of TLR-2 agonist CADI-05 targeting desmocollin-3 for advanced non-small-cell lung cancer[J].Ann Oncol,2017,28(2):298-304.
[28] Garg A D,Krysko D V,Vandenabeele P,etal.The emergence of phox-ER stress induced immunogenic apoptosis[J].Oncoimmunology,2012,1(5):786-788.