人源化抗Siglec-9抗体Fab片段的制备及鉴定①
2018-07-06褚萨萨杨志国汪茂荣
褚萨萨 尤 娜 张 馨 杨志国 朱 进 汪茂荣
(南京中医药大学附属八一医院,南京 210002)
Siglec-9是CD33相关的Siglecs,胞内区近膜端为免疫酪氨酸抑制基序(Immunoreceptor tyrosineb-ased inhibitory motifs,ITIM),通过募集酪氨酸磷酸酯酶1(SHP-1)和SHP-2,向下游传递抑制性信号,在细胞活化、增殖和凋亡方面发挥关键作用[1,2]。近年研究表明给予LPS刺激后激活细胞表面的Toll样受体4(TLR4)[3],促进炎性细胞因子的表达量明显增加,Siglec-9抗体通过ITIM可明显降低促炎性细胞因子TNF-α的产生,同时抑炎性细胞因子IL-10的表达量明显提高[4]。与Siglec-9同源的鼠Siglec-E,募集SHP-2和抑制TBK1的活性通过TRIF通路对细胞因子IFN-β具有抑制效应[5]。此外,Siglec-E在大肠杆菌感染中诱导TLR4的内吞作用中发挥重要作用,可引起炎性细胞因子TNF-α、IL-6和IFN-β表达量的变化[6]。越来越多的研究表明Siglec-9在炎性损伤过程中发挥着重要作用。为探讨Siglec-9在炎症反应中的作用,我们制备抗Siglec-9抗体Fab段,并初步探讨抗Siglec-9抗体Fab段对炎性细胞因子表达量的影响。
1 材料与方法
1.1材料 大肠杆菌克隆菌DH5-α、表达菌Escherichia coli BL21(Invitrogen,美国);异丙基-β-D-硫代半乳糖苷(IPTG)(MDBIO,中国);羊抗人Fab特异性抗体(Santa Cruz Biotechnology,美国);HRP标记的羊抗人Fab特异性抗体(Sigma,美国);商品化抗Siglec-9抗体(Abcam,美国);限制性核酸内切酶NcoⅠ、HindⅢ、EcoR V和XhoⅠ(Thermo,美国);DNA连接酶(TAKARA,日本);原核表达载体pETDUET-1为本实验室保存;His-trap Lambda Fab 柱(GE,美国);蛋白纯化仪AKTA(GE,美国);10 kD超滤离心管(Millipore,美国);RPMI-1640培养基、胎牛血清(FBS)、佛波醇12-豆蔻酸酯13-乙酸酯(phorbol12-myristate 13-acetate,PMA)、1%青霉素/链霉素(Gibco,美国);THP-1细胞购自中国科学院上海生命科学研究院细胞库;RNA提取试剂盒(飞捷,中国);逆转录试剂盒(TaKaRa,日本)。
1.2方法
1.2.1细胞培养 THP-1细胞培养在37℃、5% CO2的条件下,用含有10%FBS、1%青/链霉素的RPMI1640培养基培养,约2~3 d换液。将最佳生长状态的THP-1细胞以每孔3×105个铺入24孔板中,PMA(10 ng/ml)刺激48 h后使其分化为巨噬细胞,加入LPS和不同浓度(5、1、0.5 mg/ml)的抗Siglec-9抗体Fab段。
1.2.2设计与合成引物 设计通用引物(未列出)PCR扩增抗体轻重链可变区和恒定区,阳性克隆送检测序后与数据库VBASE2比对,得到可变区和恒定区的核酸和氨基酸序列。根据可变区和恒定区的序列和重叠延伸PCR的原理设计抗体轻链和重链的可变区和恒定区引物,轻链引物和重链引物分别如下:L-F:CATGCCATGGGCCAGTCTGCCCTGACTCAGCCCC; L-R;CCCAAGCTTTTATGAACATTCTGTAGGGGCCAC;H-F:CCGGATATCGCAGGTGCAG-CTGGTGCAGTCTGG;H-R:CCGCTCGAGTTAAGAA-GCGTAGTCCGGAACGTCG。
1.2.3原核表达系统抗Siglec-9抗体Fab段的构建及鉴定 以前期实验得到的阳性噬菌体和pComb 3Xλ为模板,通过PCR分别扩增抗体轻链和重链的可变区和恒定区。PCR产物经琼脂糖凝胶电泳割胶回收纯化,根据设计的引物,以抗体轻链和重链可变区和恒定区为模板,通过重叠延伸PCR技术[7]合成轻链L和重组重链Fd。限制性核酸内切酶NcoⅠ/HindⅢ和EcoR V/XhoⅠ分别37℃、2 h酶切抗体轻链L和重组重链Fd。通过DNA连接酶将抗体的轻链和重链依次连接到原核表达载体pETDUET-1,得到重组表达质粒。重组表达质粒转入大肠杆菌DH5-α得到阳性克隆,经酶切鉴定并送检测序,检测是否存在碱基突变及氨基酸序列的变化。
1.2.4抗Siglec-9抗体Fab段的表达和纯化 将重组表达质粒转入表达菌Escherichia coli BL21过夜培养,筛选阳性克隆接种于含抗生素的LB培养液中,摇菌至对数生长期,加入终浓度为1 mmol/L的IPTG分别于16℃和37℃摇床过夜诱导表达,12 000 r/min离心5 min后收菌,PBS重悬,超破菌液后分别取上清和沉淀,经SDS-PAGE验证,观察蛋白表达是否表达以及表达蛋白存在于胞浆或包涵体中。胞浆表达蛋白的菌液超破后得到的上清经0.22 μm滤膜过滤。按照仪器说明书,通过蛋白纯化系统和His-trap Lambda Fab 柱进行纯化[8]。收集洗脱液置于分子量10 kD的超滤离心管中,低温4 000 r/min离心30 min,获浓缩蛋白并用分光光度计测其浓度,-80℃保存。
1.2.5抗Siglec-9抗体Fab段的特性分析 ELISA:Siglec-9蛋白包被96孔板,4℃过夜,1%的BSA 37℃封闭2 h,PBST洗3次后加入不同浓度的抗Siglec-9抗体Fab段,37℃孵育1 h,PBST洗3次后加入HRP标记的羊抗人Fab特异性抗体,37℃孵育1 h,PBST洗3次后加入TMB显色液,检测在450 nm处的吸光度。商品化抗Siglec-9抗体作为阳性对照[9]。
Western blot:将纯化得到的抗Siglec-9抗体Fab段经SDS-PAGE恒压70~140 V电泳至溴酚蓝跑出终止,将胶冰浴恒流300 mA电泳1 h转至硝酸纤维素膜,5%的BSA封闭硝酸纤维素膜2 h,羊抗人Fab特异性抗体稀释于封闭液中孵育硝酸纤维素膜1 h,TBST洗3次后化学发光显影。
1.2.6抗Siglec-9抗体Fab段对炎性细胞因子mRNA表达量的影响 参照RNA快速提取试剂盒说明书,将收集的细胞快速提取总RNA,采用逆转录试剂盒反转录为cDNA。以cDNA为模板,经变性、退火、延伸40个循环,经定量PCR仪扩增,引物序列见表1。以GAPDH作为内参,用2-ΔΔCt的方法测定TNF-α、IL-1、IL-6和IL-8 的mRNA相对表达量。
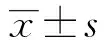
2 结果
2.1原核表达抗Siglec-9抗体Fab段质粒的成功构建和鉴定 通过PCR扩增得到轻链和重链的可变区大小分别为350 bp和400 bp,恒定区大小分别为300 bp和400 bp,经重叠延伸PCR连接可变区和恒定区后得到的轻链L和重组重链Fd大小分别为750 bp和800 bp(图1A、B)。PCR产物经回收纯化,限制性核酸内切酶NcoⅠ/HindⅢ和EcoR V/XhoⅠ分别酶切后得到的轻链和重链与原核表达载体pETDUET-1连接,至此原核表达抗Siglec-9抗体Fab段质粒构建成功。将其转入大肠杆菌DH5-α后得到的阳性克隆,经测序验证与原序列相同,并且不存在基因突变。酶切后进行琼脂糖凝胶电泳得到的条带与轻链和重链大小相同(图2)。
2.2表达和纯化抗Siglec-9抗体Fab段 将抗Siglec-9抗体Fab段质粒转入原核表达菌Escherichia coli BL21,得到的阳性克隆接种于含抗生素的LB培养基中,摇菌至对数生长期,加入1 mmol/L IPTG分别于16℃和37℃摇床过夜诱导表达,SDS-PAGE证明约27 kD处表达菌条带明显比未表达菌亮(图3),表达蛋白菌液超声破碎后证实蛋白主要表达于胞浆中(数据未显示)。轻链序列经数据库比对后为λ型,故选用His-trap Lambda Fab 柱根据操作步骤进行纯化,洗脱后浓缩测得蛋白终浓度为1 mg/ml。纯化产物通过SDS-PAGE和Western blot验证,在27 kD处可看到明显条带,与表达菌大小符合(图4A、B)。
表1实时荧光定量PCR引物
Tab.1Primersusedforquantitativereal-timePCR

Primer nameDNA sequenceIL-1Forward primerATGATGGCTTATTACAGTGGCAAReverse primerGTCGGAGATTCGTAGCTGGAIL-6Forward primerACTCACCTCTTCAGAACGAATTGReverse primerCCATCTTTGGAAGGTTCAGGTTGIL-8Forward primerACTGAGAGTGATTGAGAGTGGACReverse primerAACCCTCTGCACCCAGTTTTCTNF-αForward primerCCTCTCTCTAATCAGCCCTCTGReverse primerGAGGACCTGGGAGTAGATGAGGADPHForward primerGGAGCGAGATCCCTCCAAAATReverse primerGGCTGTTGTCATACTTCTCATGG
2.3ELISA验证抗Siglec-9抗体Fab段 Siglec-9蛋白包被96孔板,4℃过夜,加入不同浓度的抗Siglec-9抗体Fab段,采用ELISA法检测抗Siglec-9抗体Fab段和Siglec-9之间的结合效应。结果显示抗Siglec-9抗体Fab段特异性结合Siglec-9,并存在量效关系(图5)。
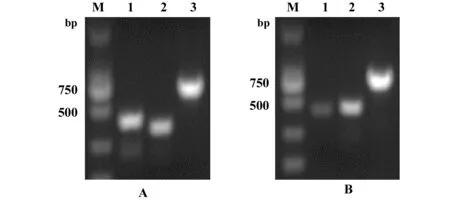
图1 PCR扩增抗Siglec-9抗体Fab段轻链和重链Fig.1 PCR amplification of anti-Siglec-9 Fab antibody light and heavy chainsNote:A.PCR amplification of light chain:1.Variable region of light chain,2.Conserved region of light chain,3.Light chain;B.PCR amplification of heavy chain:1.Variable region of heavy chain,2.Conserved region of heavy chain,3.Heavy chain.

图2 原核表达抗Siglec-9抗体Fab段质粒的酶切鉴定Fig.2 Identification of anti-Siglec-9 Fab antibody plasmids by prokaryotic expressionNote:A.The plasmid with restriction endonuclease digestion:1.the plasmid was double digested with EcoRⅤ and XhoⅠ,2.NcoⅠ and HindⅢ were used for double digesting the plasmid,M.DL 10000 Maker;B.HindⅢ and XhoⅠ were used for double digesting the plasmid.
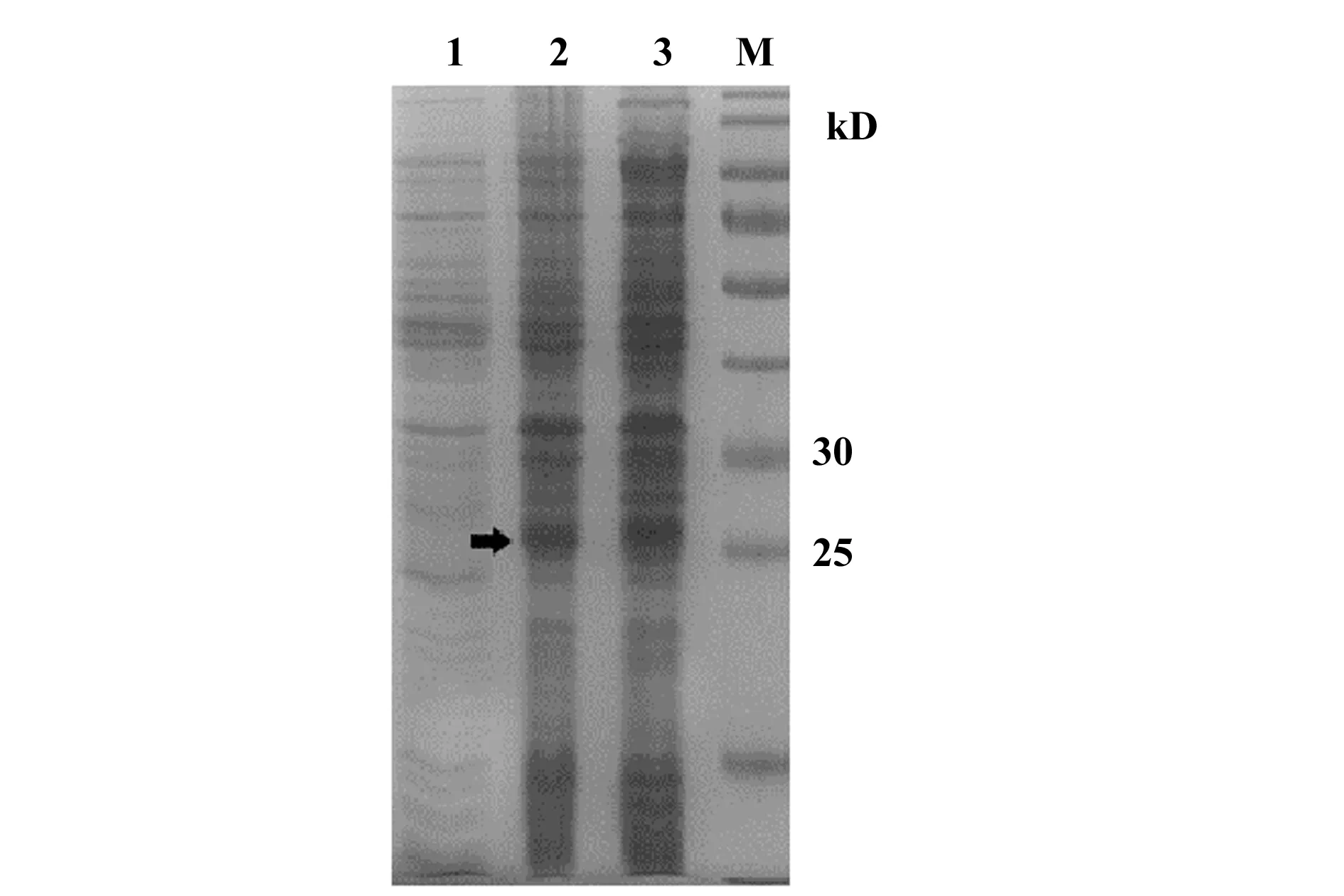
图3 表达抗Siglec-9抗体Fab段Fig.3 Expression of anti-Siglec-9 Fab antibodyNote:1.Without IPTG;2.Induced with IPTG overnight at 16;3.Induced with IPTG overnight at 37℃.

图4 抗Siglec-9抗体Fab段的纯化产物Fig.4 Purified product of anti-Siglec-9 Fab antibody
图5 ELISA检测抗Siglec-9抗体Fab段与Siglec-9的结合活性Fig.5 Human Siglec-9 Fab fragment antibody could specific bind Siglec-9 was evaluated by ELISANote:**.P<0.01,***.P<0.001.
2.4抗Siglec-9抗体Fab段抑制炎性细胞因子的mRNA表达量 在THP-1细胞实验中,与LPS组相比,LPS+Fab组TNF-α、IL-1、IL-6和IL-8的mRNA表达量随着抗Siglec-9抗体Fab段浓度的增加而降低,浓度为5 mg/ml时抑制效应最强,差异具有统计学意义(图6)。

图6 抗Siglec-9抗体Fab段抑制炎性细胞因子的mRNA表达量Fig.6 Human Siglec-9 Fab fragment antibody inhibited mRNA expression levels of inflammatory cytokinesNote:*.P<0.05,**.P<0.01.
3 讨论
利用前期实验筛选出的阳性克隆经PCR扩增得到抗体的轻链和重链可变区,在嵌合抗体技术的基础上,采用重叠延伸PCR技术得到轻链L和重组重链Fd,通过基因工程技术构建重组抗Siglec-9抗体Fab段原核表达质粒,在Escherichia coli BL21中获得高效表达。表达的抗体经SDS-PAGE验证主要以可溶性蛋白形式存在胞浆中,避免蛋白经过变性和复性过程,从而保证抗体的生物活性。采用亲和层析柱纯化后,SDS-PAGE和Western blot结果显示纯度明显提高, ELISA结果表明通过基因工程获得的抗Siglec-9抗体Fab段具有抗原特异性。由于单克隆抗体大部分为鼠源性抗体,相对于人类而言具有强烈的免疫原性,临床治疗中容易诱发人抗鼠抗体反应(HAMA)[10],从而限制了单克隆抗体在临床治疗中的应用。基因工程抗体是继多克隆抗体和单克隆抗体后出现的第三代抗体,通过基因工程技术制备的嵌合抗体是人源抗体恒定区替换鼠源抗体恒定区,将抗体进行人源化,在保留与抗原高亲和力和高特异性的基础上,大大减少了鼠源性成分在机体引起的免疫排斥反应。另外,从杂交细胞中扩增抗体的可变区是制备基因工程抗体的关键步骤[11],由于抗体可变区具有高度变异性,故PCR引物的设计在顺利扩增抗体可变区过程中有关键性作用。虽然存在高度变异性,但是骨架区和恒定区相对保守,故设计的引物多为保守的信号序列,因此可以保证抗体可变区的整体性和完整性[12]。
Siglec-9是免疫球蛋白超家族的重要成员,主要表达于中性粒细胞和单核细胞[13],通过识别含有唾液酸的配体结构介导细胞和细胞及病原体间的相互作用[14,15],同时参与调控固有免疫和适应性免疫以及免疫耐受。本研究成功构建了抗Siglec-9抗体Fab段原核系统表达质粒,并且稳定表达,经纯化后得到抗Siglec-9抗体Fab段,鉴定结果表明该抗体与Siglec-9结合具有高度特异性和高亲和力, Siglec-9抗体Fab段可抑制炎性细胞因子的表达量,为进一步研究该抗体参与炎症反应奠定了基础。
参考文献:
[1] Mahajan VS,Pillai S.Sialic acids and autoimmune disease[J].Immunol Rev,2016,269(1):145-161.
[2] Shlapatska LM,Mikhalap SV,Berdova AG,etal.CD150 association with either the SH2-containing inositol phosphatase or the SH2-containing protein tyrosine phosphatase is regulated by the adaptor protein SH2D1A[J].J Immunol,2001,166(9):5480-5487.
[3] Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[4] Ando M,Tu W,Nishijima K,etal.Siglec-9 enhances IL-10 production in macrophages via tyrosine-based motifs[J].Biochem Biophys Res Commun,2008,369(3):878-883.
[5] Boyd CR,Orr SJ,Spence S,etal.Siglec-E is up-regulated and phosphorylated following lipopolysaccharide stimulation in order to limit TLR-driven cytokine production[J].J Immunol,2009,183(12):7703-7709.
[6] Wu Y,Ren D,Chen GY.Siglec-E negatively regulates the activation of TLR4 by controlling its endocytosis[J].J Immunol,2016,197(8):3336-3347.
[7] Bryksin A,Matsumura I.Overlap extension PCR cloning[J].Methods Mol Biol,2013,1073:31-42.
[8] Wang M,Zheng W,Zhu X,etal.A human anti-Toll like receptor 4 Fab fragment inhibits lipopolysaccharide-induced pro-inflammatory cytokines production in macrophages[J].PLoS One,2016,11(1):25502-25515.
[9] 胡青青,赵肃清,贺 攀,等.抗须癣毛癣菌细胞壁蛋白的卵黄抗体制备和鉴定[J].中国免疫学杂志,2017,33(9):1350-1354.
Hu QQ,Zhao SQ,He P,etal.Preparation and identification of specific chicken egg yolk immunoglobulins against cell wall protein of Trichophyton mentagrophytes [J].Chin J Immunol,2017,33(9):1350-1354.
[10] Yamashita J,Kobayashi I,Tatematsu K,etal.Sandwich ELISA using a mouse/human chimeric CSLEX-1 antibody[J].Clin Chem,2016,62(11):1516-1523.
[11] Gu J,Ghayur T.Generation of dual-variable-domain immunogl-obulin molecules for dual-specific targeting[J].Methods Enzymol,2012,502:25-41.
[12] 姜 晶,孙 颖,刘红艳,等.人免疫球蛋白重链可变区基因引物设计方法的改良[J].微生物学杂志,2012,32(2):60-63.
Jiang Jin,Sun Yin,Liu Hongyan,etal.Design method amelioration of human immunoglobulin gene primer in heavy chain variable region[J].J Microbiology,2012,32(2):60-63.
[13] Jandus C,Boligan KF,Chijioke O,etal.Interactions between Siglec-7/9 receptors and ligands influence NK cell-dependent tumor immunosurveillance[J].J Clin Invest,2014,124(4):1810-1820.
[14] Schnaar RL.Glycobiology simplified:diverse roles of glycan recognition in inflammation[J].J Leukoc Biol,2016,99(6):825-838.
[15] Büll C,Heise T,Adema GJ,etal.Sialic Acid Mimetics to Target the Sialic Acid-Siglec Axis[J].Trends Biochem Sci,2016,41(6):519-531.
