成人麻疹并急性肝损害患者血清IL-33 高表达的临床意义①
2018-07-06刘春华王伟红刘晶晶李庆彦王思奎
刘春华 王伟红 崔 霞 刘晶晶 李庆彦 王思奎 刘 菲
(聊城市人民医院感染科,聊城 252000)
麻疹是由麻疹病毒感染引起全身迟发超敏性细胞免疫而导致的急性呼吸道传染病,主要在0.5~5.0岁小儿间流行。近年来因婴幼儿时未接种麻疹疫苗或未再复种,成人麻疹比例增加。成人麻疹60%~80%可并发肝损害[1],肝损害的发生相关机制尚不明确。肝损害的病理基础即为多种炎症因子参与的肝脏炎症。血清IL-33是IL-1家族的第11位新成员,亦为“警报素”家族一员,其能够有效地促进T淋巴细胞和自然杀伤细胞的增殖及相关细胞因子的释放,参与抗感染免疫及炎症反应[2]。在肝脏病学领域,IL-33 被确定为在乙型肝炎、丙型肝炎和酒精性肝病中导致肝损伤的一重要因子。本研究通过检测血清IL-33在麻疹并发肝损害患者中表达水平的变化,分析其在肝损害发生中的作用及意义。
1 资料与方法
1.1研究对象 随机抽取2015年12月至2017年2月在山东省聊城市人民医院感染科住院的成人麻疹并肝损害患者60例为研究对象,其中男26例,女34例,平均年龄(30.93±10.04)岁,所有病例诊断标准均符合第8版《传染病学》中麻疹及合并肝损害的诊断标准[3]。入组条件:麻疹诊断明确,肝损害参照《2015版慢乙肝诊疗指南》[4]ALT>2ULN即为肝损害。同时排除了常见嗜肝病毒感染相关的病毒性肝炎(甲、乙、丙、丁、戊型肝炎、EB及巨细胞相关肝损害)、药物性肝损害、酒精性肝损害,脂肪肝等其他肝病,无麻疹其他并发症,无自身免疫系统疾病,无糖尿病及高血压等慢性疾病史。将肝损害患者按照随机数字法分为保肝组和无保肝组,保肝组30例,男13例,女17例,平均年龄(29.78±9.07)岁,无保肝组30例,男15例,女15例,平均年龄(31.08±8.96)岁。同期住院麻疹无肝损害28例为对照,其中男13例,女15例,平均年龄(29.87±6.07)岁,健康对照组为同期本院查体中心健康者20例,其中男8例,女12例,平均年龄(30.87±5.97)岁。入组标准血常规、生化全项正常,既往无自身免疫性疾病、肿瘤及慢性疾病等病史。所有患者入院当天为观察起点即为0 d,入组后给予利巴韦林抗病毒、补液、维持水电解质平衡治疗,肝损害保肝组加用异甘草酸镁(150 mg,静脉注射,1次/d)及还原性谷胱甘肽(2 400 mg,静脉注射,1次/d),所用病例半年内未使用过激素、免疫抑制剂等。组间年龄、性别比例之间差异无统计学意义,具有可比性。本研究经过我院伦理委员会批准,所有受试者均签署知情同意书。
1.2研究方法 麻疹并肝损害组患者分别于第0天、7天、14天清晨采集空腹外周静脉血5 ml,无肝损害组及健康对照组于入院当天一次抽取,室温下静置20 min,4 000 r/min(离心半径7.5 cm)离心20 min,取血清于-80℃保存备用。用ELISA法检测患者血清IL-33的表达水平。血清IL-33的ELISA 试剂盒均购自瑞士AdipoGen 公司,按照说明进行操作。同时留取血液,进行血常规及血生化检测。
1.3统计学处理 采用SPSS17.0统计软件和Excel表处理实验数据,两组间的比较采用t检验,多个均数比较采用方差分析,组间两两比较采用LSD-t检验,由Excel 表计算t值。组间相关性分析采用Person法。P<0.05表示差异有统计学意义。
2 结果
2.1麻疹并肝损害及无肝损害患者一般资料 麻疹并肝损害组及无肝损害组相比,ALT、GGT、IL-6显著升高,白蛋白(A)、TbiL、Chol及CRP组间差异无显著性,详见表1。
2.2各组血清IL-33表达水平的比较 麻疹并肝损害组、无肝损害组及健康对照组,血清IL-33在三组间差异具有统计学意义(F=15.71,P<0.05) ;组间两两比较发现,肝损害组及无肝损害组IL-33较健康对照组显著升高,其中以肝损害组显著。详见表2。
表1麻疹并肝损害及无肝损害患者一般资料
Tab.1Comparisonofgeneraldataonmeaslesbetweenhepaticinjuryandnon-hepaticinjury

GroupsWith hepaticinjuryNon-hepaticinjurytPn6028Age30.93±6.0429.87±6.071.48P>0.05Visit time4.09±1.914.02±0.981.53P>0.05ALT(U/L)239.4±150.138.5±19.360.3P<0.00GGT(U/L)261.9±207.551.3±54.862.9P<0.00vA(g/L)39.07±3.8138.97±4.151.56P>0.05TbiL(μmol/L)19.33±6.0115.73±4.091.69P>0.05Chol(mmol/L)4.89±1.804.69±1.861.58P>0.05IL-6(pg/ml)42.47±25.9515.13±6.863.94P<0.01CRP(mg/L)56.59±22.7137.51±14.551.96P>0.05
表2各组血清IL-33表达水平的比较
Tab.2ComparisonoflevelsofIL-33ineachgroup

GroupsnIL-33(pg/ml)With hepatic injury 60205.20±25.741)2)Non-hepatic injury 28168.70±18.141)Control 20132.17±12.41F13.17P<0.01
Note:1)P<0.05,vs control group;2)P<0.05,vs non-hepatic injury group.
表3保肝与无保肝患者ALT、GGT水平的动态变化
Tab.3DynamicchangesofALTandGGTinpatientsbetweentreatmentgroupandnon-treatmentgroup
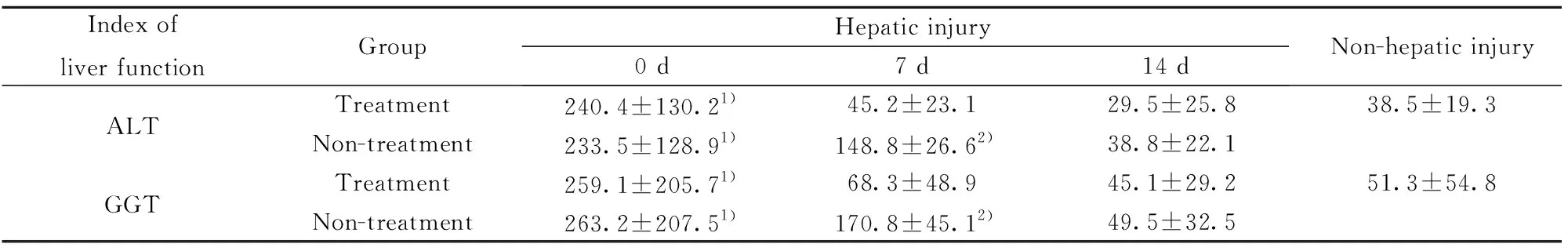
Index ofliver functionGroupHepatic injury0 d7 d14 dNon-hepatic injuryALTTreatment240.4±130.21)45.2±23.129.5±25.838.5±19.3Non-treatment233.5±128.91)148.8±26.62)38.8±22.1GGTTreatment259.1±205.71)68.3±48.945.1±29.251.3±54.8Non-treatment263.2±207.51)170.8±45.12)49.5±32.5
Note:1)P<0.05,vs non-hepatic injury group;2)P<0.05,vs treatment group.

图1 肝损害保肝和无保肝组在第0、7、14 天血清IL-33表达水平Fig.1 Dynamic changes of IL-33 in patients between treatment group and non-treatment group
2.3保肝与无保肝患者ALT、GGT和血清IL-33水平的动态变化 肝损害保肝及无保肝组ALT、GGT表达水平第0、14天两组间比较差异均无统计学意义(P均>0.05),第0天ALT、GGT水平显著高于无肝损害组(t=60.9、58.7、60.9、63.4,P<0.01),第7天无保肝组ALT和GGT显著高于保肝组(t=25.6、24.7,P<0.01)。随着时间延长保肝及无保肝组患者ALT、GGT呈下降趋势,保肝组第7天和第14天与无肝损害组相比,组间差异均无统计学意义,无保肝组第14天与无肝损害组相比,组间差异均无统计学意义(P均>0.05),详见表3。
肝损害保肝和无保肝组在第0、7、14 天血清IL-33表达水平呈下降趋势,其中,第1天两组与对照组相比差异有统计学意义(t=15.93、14.45,P<0.05),第7天无保肝组高于健康对照组(t=6.78,P<0.05 ),第14天两组与对照组间差异均无统计学意义(P>0.05)。与保肝组比较,无保肝患者第7天IL-33水平显著升高(t=6.28,P<0.05 ),在第0、14 天组间差异均无统计学意义(P>0.05),详见图1。
2.4麻疹并肝损害患者血清IL-33水平的相关因素分析 以血清IL-33水平为因变量,ALT、GGT、A、TbiL、Chol、IL-6及CRP为自变量,血清IL-33同时会受到混杂因素的影响,为了更好地确定上述指标与IL-33之间的关系,将年龄、合并肺部感染、既往有自身免疫系统疾病及心血管系统疾病作为控制变量,进行偏相关分析。结果显示,控制上述混杂因素后,60例麻疹并肝损害患者第0天血清IL-33的表达水平与ALT、GGT、IL-6呈正相关(r=0.392 1、0.503 9、0.724 9,P<0.001),详见图2。

图2 血清IL-33表达水平与ALT、GGT、IL-6相关性Fig.2 Relationship between expression level of IL-33 and ALT,GGT,IL-6
3 讨论
IL-33是2005年新发现的一个细胞因子,广泛分布于全身多个组织器官。目前已知IL-33具有多种免疫学效应,在炎症过程中发挥着重要作用。血清IL-33主要表达于多种非造血细胞如内皮细胞、上皮细胞、成纤维细胞等[5]。炎症刺激、病原微生物感染等因素引起细胞坏死或损伤后均可产生IL-33。血清IL-33作为分泌型蛋白分子,在病毒感染中可促进固有免疫应答和适应性免疫应答,参与炎症的发生[6,7]。IL-33在病毒和寄生虫感染中的作用研究结果已明确,但其在感染性疾病中的作用是目前研究的热点。本研究通过检测麻疹并发急性肝损害患者血清IL-33水平,探讨血清IL-33在麻疹并发肝损害中的变化规律及临床意义。
Arshad等[8]提出IL-33是类似“警报”的一种内源性组织损伤信号,能从受病毒感染后的坏死细胞中释放。在皮肤病毒感染如水痘、手足口病等这些引起角质细胞的损坏或退化的疾病中有重要作用。本研究发现麻疹患者血清IL-33显著高于健康对照组,与既往研究一致,我们推测麻疹患者血清IL-33升高可能与麻疹引起角质细胞的损坏所致。外周血中血清IL-33以肝损害组显著升高且 IL-33的表达水平与 ALT及GGT呈正相关,说明IL-33的血清水平与肝损伤有着直接的关系。因此从该研究可推测在麻疹并发肝损害中 IL-33可能参与了免疫反应过程,对肝脏炎症的发生有一定的促进作用,与Du等[9]研究一致。IL-33的高表达是如何参与肝脏炎症反应的,分析可能通过以下途径实现:IL-33具有前炎性因子的潜力,在炎症或创伤的早期纤维母细胞、胶质细胞等结构型细胞释放IL-33可激活邻近的肥大细胞释放IL-6等炎性因子[10]。本研究发现麻疹并发肝损害组IL-6显著高于无肝损害组,且血清IL-33与IL-6呈正相关,既往已有大量研究表明 IL-6的表达与肝功能损伤及其程度有关。
本研究同时动态观察了14 d 60例肝损害患者血清IL-33的变化,肝损害患者不管治疗与否,IL-33均呈下降趋势,于第14天与健康对照组间差异无统计学意义,其中保肝治疗组下降迅速,第7天与健康对照组间差异消失。说明保肝组改善免疫功能、减轻炎症反应的效果更显著。甘草酸制剂可控制肝脏糖皮质激素代谢,直接与激素受体结合,并抑制间质细胞活性,从而抑制炎症因子IL-33的分泌发挥抗炎效果[11]。该研究与Chen等[12]报道一致,阻断IL-33可显著改善刀豆蛋白A诱导的肝炎,这种保护作用与激活受损T淋巴细胞和自然杀伤T淋巴细胞、降低促炎症细胞因子IFN-γ的产生有关。此外,IL-33 可通过结合IL-33 受体(ST2) 激活MYD88 和TRAF-6 依赖的信号途径,启动NF-кB 和AP-1,导致细胞因子和趋化因子的产生,增加 IL-4、IL-5、IL-13分泌,引起 Th2 型免疫应答,并且抑制了促凋亡活性的caspase-3和BAX的表达[13-15]。Volarevie等[16]发现IL-33/ST2信号途径在抑制ConA诱导的肝损伤方面有重要的临床价值。Popovic等[17]报道IL-33高表达可以抑制巨细胞病毒感染引起的肝损害。本研究可从免疫学角度解释麻疹并发肝损害无治疗组的良好预后。
总之,血清IL-33在麻疹感染及其诱发肝损害初始可作为“预警因子”,在疾病过程中的变化趋势能提示疾病预后。
参考文献:
[1] 陈灏珠(主编).实用内科学[M].第13版.北京:人民卫生出版社,2013:354-370.
Chen HZ.Practice of internal medicine[M].13th Edition.Beijing:People's Medical Publishing House,2013:354-370.
[2] Haraldsen G,Balogh J,Pollheimer J,etal.Interleukin-33-cyto-kine of dual funotion or novel alarmin?[J].Trends Immunol,2009,30(5):227-233.
[3] 李兰娟,任 红.传染病学[M].第8版.北京:人民卫生出版社.2013:73-76.
Li LJ,Ren H. Infectious Diseases[M].8th Edition.Beijing:People's Medical Publishing House,2013:73-76.
[4] 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31(12): 1941-1960.
Chinese Society of Hepatology and Chinese Society of Infectious Diseases,Chinese Medical Association.The guide line of prevention and treatment for chronic hepatitis B(a 2015 update)[J].J Clin Hepatol, 2015, 31(12): 1941-1960.
[5] Kakkar R,Hei H,Dobner S,etal.Interleukin 33 as a mechanically responsive cytokine secreted by living cells[J].J Biol Chem,2012,287(9):6941-6948.
[6] Hodzic Z,Schill EM,Bolock AM,etal.IL-33 and the intestine:The good,the bad,and the inflammatory[J].Cytokine,2017,100:1-10.
[7] 叶迎春,年四季,刘佳佳,等.IL-33与自身免疫疾病[J].中国免疫学杂志,2015,31(8):1132-1137.
Ye YC, Nian SJ,Liu JJ,etal.Leukin-33 and autoimmune diseases[J].Chin J Immunol,2015,31(8):1132-1135.
[8] Arshad MI,Piquet-Pellorce C,Samson M.IL-33 and HMGB 1alarmins:sensors of cellular death and their involvement in 1iver pathology[J].Liver Int,2012,32:1200-1210.
[9] Du XX,Shi Y,Yang Y,etal.DAMP molecular IL-33 augments monocytic inflammatory storm in hepatitis B-precipitated acute-on-chronic liver failure[J].Liver Int,2018,38(2):229-238.
[10] Sjöberg LC,Gregory JA,Dahlén SE,etal.Interleukin-33 exacerbates allergic bronchoconstriction in the mice via activation of mast cells[J].Allergy,2015,70 (5):514-521.
[11] 李亚萍,张俊林.复方甘草酸苷治疗慢性重型乙型肝炎的疗效和安全性[J].新乡医学院学报,2016,33(1):45-47.
Li YP,Zhang JL. Effect and safety of compound glycyrrhizin on chronic severe hepatitis B[J].J Xinxiang Med Univ,2016,33(1):45-47.
[12] Chen J,Duan L,Xiong A,etal.Blockade of IL-33 ameliorates Con A-induced hepatic injury by reducing NKT cell activation and IFN-7 production in mice[J].J Mol Med(Ber1),2012,90:1505-1515.
[13] Ali S,Mohs A,Thomas M.etal.The dual function cytokine IL-33 interacts with the transcription factor NF-κB to dampen NF-κB-stimulated gene transcription[J].J Immunol,2011,187(4):1609-1616.
[14] Rostan O,Arshad MI,Piquet-Pellorce C,etal.Crucial and diverse role of the interleukin-33/ST2 axis in infectious diseases[J].Infect Immun,2015,83(5):1738-1748.
[15] De la Fuente M,MacDonald TT,Hermoso MA.The IL-33/ST2 axis:Role in health and disease[J].Cytokine Growth Factor Rev,2015,26 (6):615-623.
[16] Volarevic V,Mitrovic M,Milovanovic M,etal.Protective role of IL-33/ST2 axis in Con A-induced hepatitis[J].J Hepatol,2012,56(1):26-33.
[17] Popovic B,Golemac M,Podlech J,etal.IL-33/ST2 pathway drives regulatory T cell dependent suppression of liver damage upon cytomegalovirus infection[J].PLoS Pathog,2017,13(4):e1006345.
