MEOX2基因与先天性小耳畸形相关性研究
2018-07-06冯涛钱瑾王冰清王悦章庆国
冯涛钱瑾王冰清王悦章庆国
1张家口市妇幼保健院儿科(张家口075000)
2中国医学科学院整形外科医院(北京100144)
先天性小耳畸形(microtia)是一种由不明原因引起的胚胎第一、二鳃弓和第一鳃沟的发育异常,从而导致耳郭先天性发育不良,常常伴有外耳道闭锁、中耳及颌面部畸形[1]。研究资料显示,先天性小耳畸形在我国的发病率为2.25/万左右,是仅次于唇腭裂的第二大颅面部先天畸形疾病[2-5]。先天性小耳畸形发病率男性明显高于女性,但遗传学研究并未发现性染色体异常。先天性小耳畸形临床表现为外耳形态改变,外耳郭基本结构消失或部分消失,仅有残余耳软骨及部分耳垂,甚至完全没有上述结构,而且伴有外耳道闭锁或狭窄、中耳畸形等症状。扩张皮瓣法中段耳廓再造[6]及苏氏定位法[7]等应用于先天性小耳畸形患者耳廓再造手术。报道显示60.4%的病例为多发畸形,3.1%的病例为综合征[8],主要有Branchio-oto-renal、Treacher Collins、CHARGE综合征等。非综合征型小耳畸形遗传机制的揭示远不如综合征型小耳畸形[9-10]。小耳畸形的发病机制目前仍不十分明确,存在“神经嵴细胞扰乱”和“局部缺血”假说,最新研究表明神经嵴细胞发育异常在小耳畸形的发病中起关键作用[3]。我们主要针对导致小耳畸形发生的遗传因素进行研究,认为血管发育异常可能导致局部缺血。
小耳畸形是一种环境及基因因素共同导致的发育异常,一些基因对胚胎时期的颌面部及听觉系统的发育起至关重要的作用[1,3]。目前已鉴定的小耳畸形风险基因多为调控胚胎期发育的基因,如HOXA2,FGF3,SIX2,HMX1等[11-14]。这些基因大都属于同源盒基因(homeobox gene)家族,它们是控制胚胎发育的主要基因,对器官发生和细胞分化调控起关键作用。同源盒基因家族具有进化上高度保守序列,长约180bp,分散于基因的3’端。该保守序列编码的60个氨基酸可形成HLH(he⁃lix-loop-helix)结构来激活或抑制靶基因表达[15]。同源盒基因在胚胎发育和疾病发生发展过程中对细胞的生长和分化具有调控作用[16]。MEOX2基因是近些年来发现的一同源盒基因,其编码的蛋白是核转录因子,能够激活或抑制其下游基因的表达[17]。MEOX2基因主要在血管平滑肌细胞和血管内皮细胞中表达,其过表达可以抑制血管平滑肌细胞的增殖[18]。研究表明MEOX2与低氧性肺动脉高压、门静脉高压、阿尔茨海默病、早年衰老综合征、唇腭裂等的发病机制有关[19-21]。研究显示MEOX2基因对组织细胞有负性调控作用,MEOX2基因对增殖细胞的抑制作用首先发现于平滑肌,其作用机理可能是通过p53非依赖性方式激活细胞周期来抑制性蛋白p21。在促血管形成生长因子刺激下,MEOX2能抑制内皮细胞向血管生成表型的转化,对血管形成有负调控作用,其主要是通过抑制核因子kappaB依赖基因的表达[22],但与先天性小耳畸形的关系未见报道。
同源盒基因家族的多个成员已被证实为小耳畸形的风险致病因素。为了证实MEOX2这一同源盒基因是否参与了小耳畸形这一颅面部先天畸形的发生,我们采用候选基因关联研究策略对收集的328例小耳畸形患者和500例对照进行了分析。深入研究与先天性小耳畸形发病密切相关的候选基因,对于阐明其发病机制及防治具有重要意义。
1 材料与方法
1.1样本采集
小耳畸形样本收集于张家口市妇幼保健院以及中国医学科学院整形外科医院,包括小耳畸形患者样本(328例)和健康对照样本(500例),所有样本在3代内无亲缘关系。疾病表型鉴定采用Naga⁃ta分型标准,包括耳甲腔型82例,腊肠型201例,耳垂型45例。其中男性246例(75%),右侧发生的患者197例(60%)。
1.2 标签SNP(单核苷酸多态性)位点挑选
下载千人基因组计划数据库(https://www.ncbi.nlm.nih.gov/variation/tools/1000genomes/)汉 族 人 群(CHB)的MEOX2基因以及上下游各10kb内所有变异位点。挑选标签SNP时,我们保留了最小等位基因频率>0.01的常见变异位点。使用Haploview软件挑选标签SNP,具体参数为:r2阈值为0.6,多位点检验LOD阈值为3.0。最后挑选了8个变异位点作为标签SNP,分别为 rs17420659、rs632846、rs10226819、rs62439069、rs10226196、rs10224052、rs79493573、rs76405124。
1.3基因分型
我们使用全血DNA提取试剂盒(天根生化科技有限公司)完成DNA提取,使用Nanodrop对DNA质量进行检测,使用飞行质谱(sequenom)法完成变异位点的基因分型,该工作由北京康普森生物技术有限公司完成,分型工作严格按照标准实验流程进行。
1.4数据分析
对于获得基因分析结果,在病理和对照组均未发现丢失率存在差异的位点,同时对所有位点的对照样本进行了Hardy-Weinberg平衡检验后未发现P<0.05的位点,提示样本为随机采样所得。我们使用plink软件对所有位点进行logistic检验,并对性别和年龄以及地理来源(按照南北人群分)进行了校正[23]。多重检验校正采用Bonferroni检验。我们使用SHAPEIT进行单体型构建,并采用Impute2进行基因组填充(使用千人基因组计划中的汉族人群作为背景),仅保留填充后Info值>0.6的变异位点,然后使用Snptest进行关联分析,关联分析时同样使用了性别和年龄以及地理来源(按照南北人群分)对结果进行校正。使用 SeattleSeq(http://snp.gs.wash⁃ington.edu/SeattleSeqAnnotation138/)对所有变异位点进行功能注释,使用GTEx(Genotype-Tissue Ex⁃pression)和 MGI(Mouse Genome Informatics)数据库对MEOX2基因在各个组织中表达情况进行展示。
2 结果
2.1关联分析
我们使用飞行质谱法对MEOX2基因的8个位点进行基因分型,位点分型成功率>99.62%,且这8个位点的对照数据均不背离Hardy-Weinberg平衡检验,因此将8个位点全部纳入后续的关联研究。为了降低人群分层对关联研究结果的影响,我们使用地理来源(按照南北人群分类23)作为协变量对人群分层进行校正,同时还校正了年龄和性别。关联分析后发现8个位点的P值均小于0.05(3个独立检验,依据见连锁不平衡区块结果),且rs76405124(P=0.006556,OR=0.82)和 rs10224052(P=0.01619,OR=0.83)的P值经Bonferroni校正后仍然显著(Bonferroni P<0.05)(表1)。
2.2连锁不平衡区块构建及基于单体型的关联分析
为了进一步揭示MEOX2基因的单体型和小耳畸形之间的关联性,我们首先使用Haploview构建了连锁不平衡区块(图1),rs17420659、rs632846、rs10226819落入Block1(83kb)连锁不平衡区块内,rs62439069、rs10226196、rs10224052落 入 Block2(2kb)连锁不平衡区块内,rs79493573、rs76405124落入Block3(20kb)连锁不平衡区块内。3个连锁不平衡区块提示有3个有效的多重检验。构建这8个位点的单体型并进行关联分析,发现Block 3的AA单体型和小耳畸形显著关联(P=0.0023,Perm-P=0.0260,P< 0.05)(表2)。
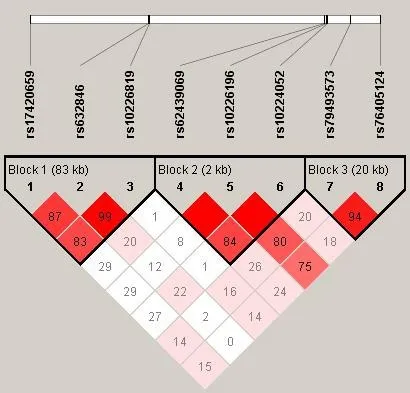
图1 MEOX2基因8个SNP位点构建的连锁不平衡图。该图上方展示SNP位点间的距离关系,中间显示的是SNP位点的rs编号,下方倒三角展示位点间的连锁不平衡关系。使用D’反映两两位点间的连锁不平衡关系:红色,D’=1且LOD ≥ 2;粉色,D’<1且LOD ≥ 2;白色,D’<1且LOD < 2;样本数:Case vs Control=328 vs 500.Fig.1 LD constructed by 8 SNPs of MEOX2.Above of this picture shows the distance relationship between SNP sites,middle of it is the rs number and inverted triangle displays LD of SNPs.D’reflects the LD between the two sites:Red,D’=1 and LOD≥2;Pink,D’<1 and LOD ≥2;White,D’<1 and LOD<2;n(Case vs Control)=328 vs 500.
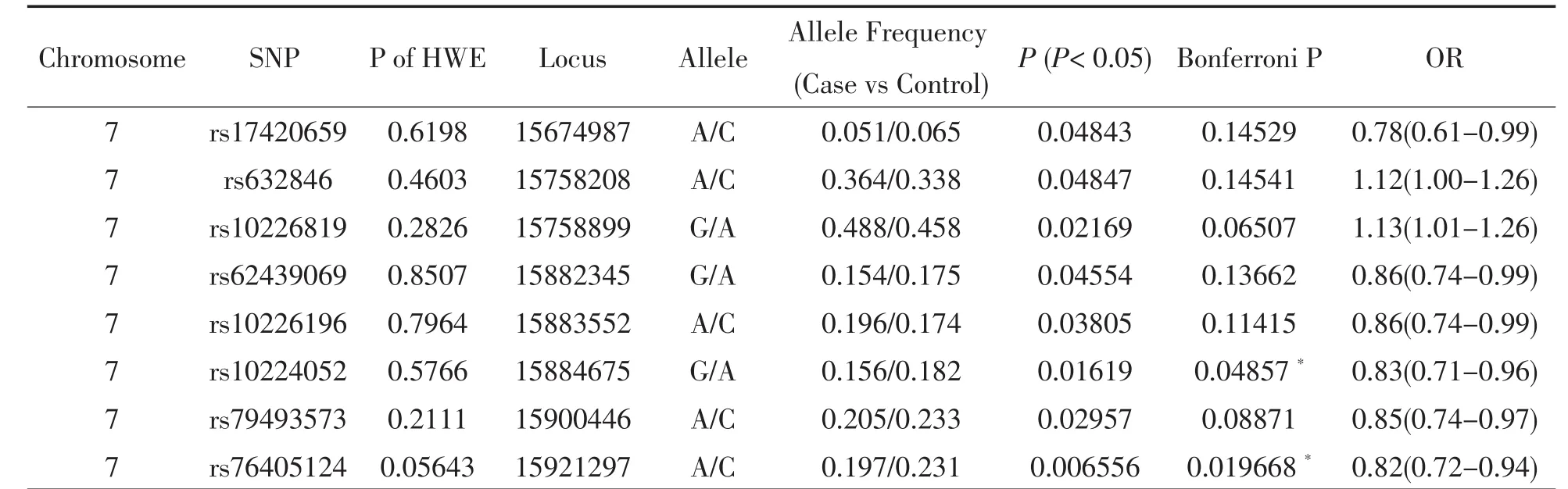
表1 MEOX2基因内8个标签SNP和小耳畸形的关联分析结果Table 1 Correlation analysis results between 8 SNPs and congenital microtia of MEOX2
2.3基因组填充及关联分析
以千人基因组计划的中国人群数据作为背景信息,我们使用基因组填充的方法推测出MEOX2基因内另外18个SNP位点的基因型信息。然后使用Snptest软件对这所有26个(8个检测加上18个推测)变异位点进行关联分析发现,rs71549953(P=0.0005,OR=1.96)的P值经Bonferroni校正后仍然显著(Bonferroni P<0.05)(表3)。该结果证实了ME⁃OX2基因和小耳畸形显著相关(Bonferroni P<0.05)。我们使用SeattleSeq对rs71549953进行基因注释后发现这位点落于MEOX2基因的内含子内。
2.4 GTEx和MGI数据库中MEOX2表达情况SNPMEO

图2 MEOX2在小鼠胚胎期以及各胚层和分化器官内的表达情况。该图左侧显示的是小鼠胚胎分化的各个结构组织,上方显示的是小鼠不同胚胎发育阶段,如如TS11 E7.25-8代表胚胎发育的第11个Theiler期即第7.25-8天。方框内显示的是各阶段MEOX2基因的表达量,白色表示该阶段无该组织结构,方框内带圆圈表示对应组织器官该阶段无数据,蓝色代表基因表达,红色表示基因不表达,颜色的深浅反映表达量的高低(http://www.informatics.jax.org/)。Fig.2 The expression of MEOX2 in embryonic period,endoderm and differentiated organs of mice(http://www.informatics.jax.org/).The left side of the figure shows the embryonic differentiation of mouse embryos and the above shows the

表2 MEOX2基因内8个SNP位点构建的单体型以及和小耳畸形的关联分析结果Table 2 Correlation analysis results between haplotype which constructed by 8 SNPs and congenital microtia of MEOX2
为了进一步了解上述位点如何影响X2基因功能进而和小耳畸形相关联,我们将他们提交至表型和组织特异性表达数据库(Genotype-Tissue Expression,GTEx)。该数据库并未记录位点在特异性器官内是否为eQTL位点,但MEOX2高表达于胫神经和皮下脂肪(附件图1)。考虑到MEOX2可能在胚胎早期影响器官发育,我们考察了该基因的小鼠胚胎原位杂交结果,发现其在胚胎期,特别是在胚胎中晚期各器官分化过程中高度表达(图2),这和颌面部器官分化发生在胚胎发育中后期相吻合。embryonic development stage of the mouse.For example,TS11 E7.25-8 represents the first theiler stage of embryonic development(7.25-8 days).The box shows the expression of the MEOX2 gene in each stage.White means there is no structure in this stage.The circle in the box indicates that there is no data in tissue organ.Blue means gene expression and red means no gene expression.The shade of color reflects the level of expression.
3 讨论
先天性小耳畸形的遗传特点不符合孟德尔遗传规律,故对其遗传分析和致病基因的定位存在一定难度[24]。小耳畸形可以作为一个独立的出生缺陷或作为综合征的一部分[25]。小耳畸形在我国高发,但对其遗传发病机制的研究仍处于早期阶段,相关研究已鉴定的小耳畸形相关综合征的致病基因大约有20余个(HOXA1、TFAP2A、EYA1、SIX1、SIX5、CHD7等),全基因组关联研究鉴定了多个小耳畸形风险基因如ROBO1,GBX2,EPAS1,NRP2,GATA3以及SEMA7A等。本文通过对同源盒家族成员MEOX2和小耳畸形进行关联研究,发现多个变异位点和我国小耳畸形显著相关(如rs10224052 和 rs76405124)。
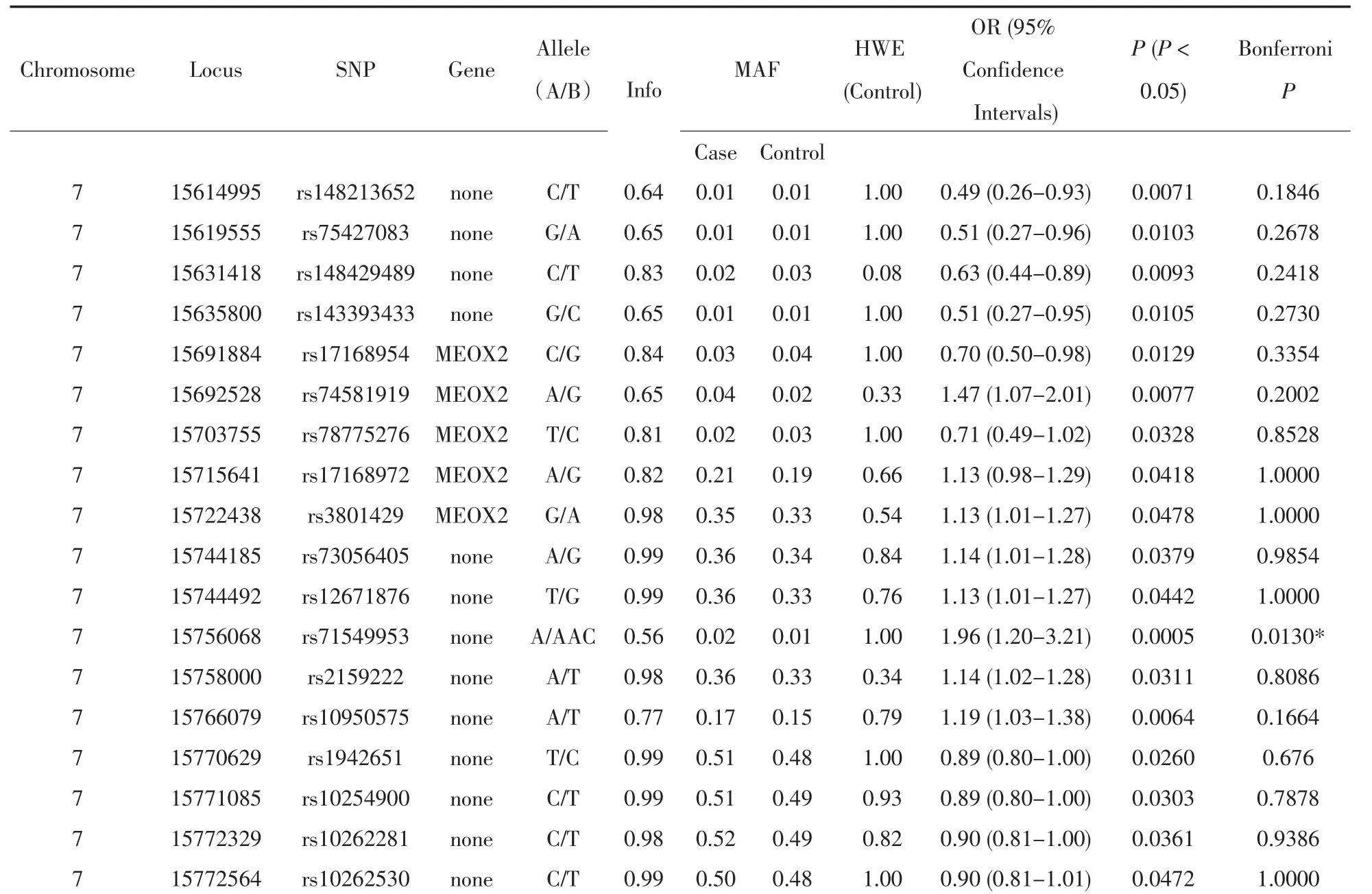
表3 基因组填充后的MEOX2基因内的SNP位点和小耳畸形关联分析结果Table 3 Correlation analysis results between 8 SNPs which genotypes filled and congenital microtia of MEOX2
目前对先天性小耳畸形的病因和表型变异性还知之甚少,然而,发育生物学和遗传学研究表明,神经嵴细胞功能缺陷与小耳畸形等多种颅面综合征相关。Luquetti等[3]认为“神经嵴细胞紊乱”和“血管发育不良”可能为小耳畸形的病因。颅神经嵴细胞是起源于背侧神经管的一个暂时性、可迁移、多潜能的细胞群,可以进一步分化为前脑(Fore⁃brain)、中脑(Midbrain)、后脑(Hindbrain),其中,后脑的颅神经嵴细胞进一步分区形成数个菱脑原节(Rhombomere’r),这一结构在颅颌面部的发育中起重要作用26。目前公认和颅面部发育畸形相关的基因主要来自同源盒基因家族,动物模型显示该家族成员如Hoxa1,Hoxb1,Six1,Six4等突变可导致颅面畸形,甚至出现小耳畸形[3]。在耳郭的发育阶段,胚胎受到遗传或外界因素影响,容易出现耳郭的多种发育畸形。小耳畸形就是源于胚胎期第一、二鳃弓、第一咽囊、第一鳃裂和颞骨原基的颅骨结构发育不良的一组先天性畸形。研究发现,在小鼠耳郭发育期,镫骨动脉破裂会引起小耳畸形,使颅神经嵴细胞不具有迁移性[27],而颅神经嵴细胞能否正确迁移到指定位置,是颅颌面结构正常发育的前提,也是各种颌面部畸形发生的重要原因[28]。“局部缺血”是导致小耳畸形的发病的假说之一。有研究报道畸形小鼠的咽部动脉和舌骨动脉交界处有同侧血肿,使头颈部血管发育受阻造成了局部缺血和坏死[29]。研究发现多个可导致血管发育异常的基因如NRP2,EPAS1,ROBO1,GBX2,PLCD3和小耳畸形显著相关。MEOX2基因属于同源盒基因,又称作GAX基因。MEOX2基因能调节平滑肌细胞、内皮细胞和血管外膜的成纤维细胞增殖[30],与心血管疾病有关。因此我们认为MEOX2可能影响血管发育导致局部缺血,进而造成小耳畸形。
我们的研究结果显示rs76405124和rs10224052位点和小耳畸形显著相关(Bonferroni P<0.05),基因注释显示rs71549953落于MEOX2基因的内含子内,另外,MEOX2高表达于胫神经和皮下脂肪,因此我们推测MEOX2基因还可能影响颅颌面部皮下脂肪表达,从而导致耳发育畸形,但这需要功能研究的证实。

附件图1 表型和组织特异性表达数据库记录的MEOX2表达情况Attachment Fig.1 Phenotype and expression of the MEOX2 which was recorded by tissue specificity of database
1 陈坤,石润杰.综合征型先天性小耳畸形的基因学研究[J].中华耳科学杂志.2014,12(4):569-571.Chen K,Shi RJ.Genetic Study of Congenital Microtia[J].Chinese Journal of Otology,2014,12(4):569-571.
2 Deng K,Dai L,Yi L,et al.Epidemiologic Characteristics and Time Trend in the Prevalence of Anotia and Microtia in China[J].Birth Defects Research Part A Clinical&Molecular Teratology,2016,106(2):88-94.
3 Luquetti,DV,Heike CL,Hing AV,et al.Microtia:Epidemiology and Genetics[J].American Journal of Medical Genetics Part A,2011,158A(1):124-39.
4 Li D,Chin WS,Wu J,et al.Psychosocial Outcomes Among Micro⁃tia Patients of Different Ages and Genders Before Ear Reconstruc⁃tion[J].Aesthetic Plastic Surgery,2010,34(5):570-576.
5 Zhang QG,Zhang J,Yu P,et al.Environmental and Genetic Fac⁃tors Associated with Congenital Microtia:A Case-Control Study in Jiangsu,China,2004 to 2007[J].Plastic&Reconstructive Sur⁃gery,2009,124(4):1157-1164.
6 韩景健,赵延勇,林琳等.中段耳廓再造矫正轻度小耳畸形[J].中华耳科学杂志.2013,11(4):521-523.Han JJ,Zhao YY,Lin L,et al.Mid-Section Auricular Reconstruc⁃tion for Mild Microtia[J].Chinese Journal of Otology,2013,11(4):521-523.
7 苏法仁,丁静华,刘玉红.苏氏定位法在小耳畸形患者耳廓再造中的应用[J].中华耳科学杂志.2016,14(4):551-553.Su FR,Ding JH,Liu YH.Application of Su's Localization Method for Auricular Reconstruction in Patients with Microtia[J].Chinese Journal of Otology,2016,14(4):551-553.
8 朱军,王艳萍,梁娟等.1988-1992年全国先天性无耳和小耳畸形发病率的抽样调查[J].中华耳鼻喉科杂志.2000,35(1):62-65.Zhu J,Wang YP,Liang J,et al.An Epidemiological Investigation of Anotia and Microtia in China During 1988-1922[J].Chinese Journal of Otorhinolaryngology,2000,35(1):62-65.
9 Harris,J,Kallen B,Robert E.The Epidemiology of Anotia and Mi⁃crotia[J].Journal of Medical Genetics,1996,33(10):809-813.
10 Mastroiacovo P,Corchia C,Botto LD,et al.Epidemiology and Ge⁃netics of Microtia-Anotia:A Registry Based Study on Over One Million Births[J].JournalofMedicalGenetics,1995,32(6):453-457.
11 Fogelgren B,Kuroyama MC,Mcbratneyowen B,et al.Misexpres⁃sion of Six2 is Associated with Heritable Frontonasal Dysplasia and Renal Hypoplasia in 3H1 Br Mice[J].Developmental Dynam⁃ics,2008,237(7):1767-1779.
12 Tekin M,Oztürkmen AH,Fitoz S,et al.Homozygous FGF3 Muta⁃tions Result in Congenital Deafness with Inner Ear Agenesis,Mi⁃crotia,and Microdontia[J].Clinical Genetics,2008,73(6):554-565.
13 Alasti F,Sadeghi A,Sanati MH,et al.A Mutation in HOXA2 is Responsible for Autosomal-Recessive Microtia in an Iranian Fam⁃ily[J].American Journal of Human Genetics,2008,82(4):982-991.
14 Li X,Hu J,Zhang J,et al.Genome-Wide Linkage Study Suggests a Susceptibility Locus forIsolated BilateralMicrotia on 4p15.32-4p16.2[J].Plos One,2014,9(7):e101152.
15 Gehring,WJ.The Homeobox in Perspective[J].Trends in Bio⁃chemical Sciences,1992,17(8):277-280.
16 Dufort D,Nepveu A.The Human Cut Homeodomain Protein Re⁃presses Transcription From the C-Myc Promoter[J].Molecular and Cellular Biology,1994,14(6):4251-4257.
17 Lai EC,Lau WY.The Continuing Challenge of Hepatic Cancer in Asia[J].Surgeon,2005,3(3):210-215.
18 Muljo SA,Kanellopoulou C,Aravind L.MicroRNA Targeting in Mammalian Genomes:Genes and Mechanisms[J].Wiley Interdis⁃ciplinary Reviews Systems Biology&Medicine,2010,2(2):148-161.
19 Reinhar BJ,Slack FJ,Basson M,et al.The 21-Nucleotide Let-7 RNA Regulates Developmental Timing in Caenorhabditis Elegans[J].Nature,2000,403(6772):901-906.
20 Pasquinelli AE,Reinhart BJ,Slack F,et al.Conservation of the Sequence and Temporal Expression of Let-7 Heterochronic Regu⁃latory RNA[J].Nature,2000,408(6808):86-89.
21 Lagos-Quintana M,Rauhut R,Lendeckel W,et al.Identification of Novel Genes Coding for Small Expressed RNAs[J].Science,2001,294(5543):853-858.
22 Brown KK,Viana LM,Helwig CC,et al.HOXA2 Haploinsuffi⁃ciency in Dominant Bilateral Microtia and Hearing Loss[J].Hu⁃man Mutation,2013,34(10):1347-1351.
23 Xu SH,Yin XY,Li SL,et al.Genomic Dissection of Population Substructure of Han Chinese and Its Implication in Association Studies[J].American Journal of Human Genetics,2009,85(6):762-774.
24 郝少娟,金蕾,李辰龙等.先天性小耳畸形候选致病基因的筛选[J].中国眼耳鼻喉科杂志.2017,17(2):113-115.Hao SJ,Jin L,Li CL,et al.Screening of Candidate Genes for Con⁃genital Microtia[J].Chinese Journal of Ophthalmology and Otorhi⁃nolaryngology,2017,17(2):113-115.
25 Alasti F,Van CG.Genetics of Microtia and Associated Syndromes[J].Journal of Medical Genetics,2009,46(6):361-369.
26 卢境婷,王旭东,代杰文等.颅神经嵴细胞的迁移及特性[J].中华口腔医学研究杂志(电子版).2011,5(6):652-657.Lu JT,Wang XD,Dai JW,et al.The Process and Characteristic of Cranial Neural Crest Cells Migration[J].Chinese Journal of Sto⁃matological Research(Electronic Edition),2011,5(6):652-657.
27 魏建军,潘博,于晓波等.小耳畸形的“二期法”耳廓再造术[J].组织工程与重建外科杂志.2010,6(5):276-278.Wei JJ,Pan B,Yu XB,et al."Two-stage"Ear Reconstruction for Microtia[J].Journal of Tissue Engineering and Reconstructive Sur⁃gery,2010,6(5):276-278.
28 刘亚兰,张华,冯永.神经嵴发育异常导致综合征型耳聋的机制[J].遗传.2014,36(11):1131-1144.Liu YL,Zhang H,Feng Y.Progress in the Study of Syndromic Hearing Loss Resulted from Neural Crest Abnormalities[J].Here⁃ditas(Beijing),2014,36(11):1131-1144.
29 吴荣薇,潘博.小耳畸形的流行病学和遗传学研究进展[J].中华临床医师杂志(电子版).2013,7(1):282-284.Song RW,Pan B.Advances in Epidemiology and Genetics of Mi⁃crotia[J].Chinese Journal of Clinicians(Electronic Edition),2013,7(1):282-284.
30 Liu P,Zhang C,Feng JB,et al.Cross Talk Among Smad,MAPK,and Integrin Signaling Pathways Enhances Adventitial Fibroblast Functions Activated by Transforming Growth Factor-beta1 and In⁃hibited by Gax[J].Arteriosclerosis Thrombosis&Vascular Biolo⁃gy,2008,28(4):725.
