云南省彝族人群SRD5A2基因多态性与前列腺癌的相关性
2018-07-05罗钰辉李康健官润云申吉泓刘孝东李颢
罗钰辉 李康健 官润云 申吉泓 刘孝东 李颢
昆明医科大学第一附属医院(昆明 650032)
前列腺癌是全球范围内男性最常见的恶性肿瘤,2015年有160万前列腺癌患者被确诊,366 000人死于该病[1]。近年来,前列腺癌发病率在我国呈现逐年上升趋势[2]。但是目前前列腺癌的病因尚不明确,基因和环境是其危险因素[3]。由于雄激素在前列腺癌的发生、进展中起到了非常重要的作用[4],而睾酮5-α还原酶Ⅱ(testosterone 5-alpha-reductaseⅡ,SRD5A2)基因编码的睾酮5-α还原酶Ⅱ是雄激素合成过程中睾酮转化为双氢睾酮的关键酶[5],所以SRD5A2基因多态性与前列腺癌易感性的关系受到人们的广泛关注。但是,SRD5A2基因多态性与前列腺癌的相关性研究大多集中于欧美人群,仅有少量中国汉族人群的研究报道,并且缺乏我国少数民族人种的相关研究。因此,我们通过Sanger测序法对122例云南彝族前列腺癌患者与135例云南彝族非前列腺癌健康男性的 SRD5A2基因 rs523349(V89L)、rs9282858(A49T)和TA重复序列多态性进行检测,从而分析云南省彝族人群中SRD5A2基因多态性与前列腺癌的相关性。
1 资料与方法
1.1 一般资料 选择2011年5月至2017年5月在昆明医科大学第一附属医院就诊的122例云南彝族前列腺癌患者为病例组,所有前列腺癌患者均经前列腺穿刺病理证实,年龄51~83岁,平均(65.3±3.8)岁;同期选择135例在我院体检中心体检的年龄匹配的云南彝族非前列腺癌健康男性作为对照组,年龄52~85岁,平均(66.7±3.2)岁。两组年龄差异无统计学意义(P>0.05)。经我院伦理委员会批准后开始研究,所有入选对象均签署知情同意书。
1.2 方法
1.2.1 标本收集及基因组DNA提取 分别收集符合条件受检者外周静脉血3 mL,EDTA抗凝,-80℃冰箱保存。根据DNA盐析提取量化标准协议,用酚/氯仿的混合液进行抽提,稀释至 10 μg/μL,置于-20℃冰箱备用。
1.2.2 相关引物 根据核苷酸序列应用Primer 5.0软件设计引物,由生工生物工程(上海)股份有限公司合成,见表1。

表1 SRD5A2基因多态性位点引物序列Tab.1 Primer sequence of SRD5A2 gene polymorphic loci
1.2.3 PCR反应 30 μL PCR反应体系的配制:10× Taq DNA 聚合酶(rTaq)缓冲液 3 μL,dNTP(2.5 mmol/L)2 μL,rTaq 0.2 μL,50%二甲基亚砜(DMSO)1 μL,正、反向引物各1 μL,DNA模板2 μL,去离子水19.8 μL。PCR反应条件:预变性温度95℃ 3 min,变性温度94℃ 30 s,退火温度60℃45 s,延伸温度72℃45 s,修复延伸温度72℃5 min,循环数35次。
1.2.4 基因多态性检测 (1)准备模板:质粒、PCR产物。(2)电泳检查DNA浓度和质量;检测质粒抽取的质量。(3)测序PCR反应:测序试剂体系配制按ABI Big Dye v3.1测序说明书进行。测序PCR循环条件:96℃ 1 min;25个循环:96℃ 10 s,50℃ 5 s,60℃ 4 min;4℃保温。(4)纯化测序产物(上机前纯化)。(5)ABI 3730XL测序仪上机电泳。(6)分析数据。
1.3 统计学方法 应用IBM SPSS 19.0统计软件,SRD5A2基因多态性位点的基因型和等位基因用计数和百分数表示,Hardy-Weinberg平衡检验以及对病例、对照两组间多态性位点的基因型和等位基因分布的比较均采用卡方检验,并通过计算优势比(OR)及95%置信区间(95%CI)来判断其与前列腺癌的关联强度。P<0.05表示差异有统计学意义。
2 结果
2.1 Hardy-Weinberg平衡检验 分别对病例组及对照组中所检测到的SRD5A2基因多态性位点(rs523349、rs9282858和TA重复序列)的基因型分布频率进行Hardy-Weinberg平衡检验(表2)。结果提示这3个多态性位点其基因型在病例组及对照组中分布均符合Hardy-weinberg平衡(P>0.05),说明本研究对象具有群体代表性。
2.2 SRD5A2基因多态位点的基因型和等位基因频率在病例组和对照组中的分布 在病例组和对照组中均未发现SRD5A2基因rs9282858位点的AA基因型。两组间SRD5A2基因位点rs523349和rs9282858的基因型和等位基因频率分布差异无统计学意义(P>0.05)。而两组间TA重复序列位点的基因型和等位基因频率分布差异有统计学意义(P<0.05),在病例组中含有9次TA重复的基因型[(TA)0(TA)9+(TA)9(TA)9]较对照组多见(P=0.033)。与携带0次TA重复[(TA)0]等位基因者相比,携带9次TA重复[(TA)9]等位基因者患前列腺癌的风险明显增高(OR=2.181,95%CI:1.111 ~ 4.281,P=0.021),见表3。
3 讨论
前列腺癌是一种雄激素依赖性疾病,雄激素在前列腺癌的发生、进展中具有非常重要的作用,所以参与雄激素合成和代谢的基因都可能是前列腺癌的危险因素[4]。睾酮5-α还原酶能够在雄激素合成过程中将睾酮转换为更具有活力的双氢睾酮(DHT)[5]。其有睾酮5-α还原酶Ⅰ(SRD5A1)和
睾酮5-α还原酶Ⅱ(SRD5A2)两种亚型,分别由SRD5A1和 SRD5A2基因编码[5]。在两者中,SRD5A2在雄激素敏感组织(例如:前列腺、睾丸)中具有高表达,并且能够明显增强DHT的生物活性以及与雄激素受体的亲和力,所以SRD5A2可能对前列腺癌的发生产生影响,SRD5A2基因被认为是前列腺癌发病重要的候选基因[6]。近10多年来,SRD5A2基因多态性和前列腺癌易感性之间的关系受到人们的广泛关注。但是,这些研究大多集中于欧美人群,仅有少量中国汉族人群的研究报道,而缺乏我国少数民族人种的相关研究。彝族作为云南人口最多的少数民族之一,亦具有一定的前列腺癌发病率,在彝族人群中研究前列腺癌的易感性对于我们理解和治疗该疾病都具有很重要的意义。
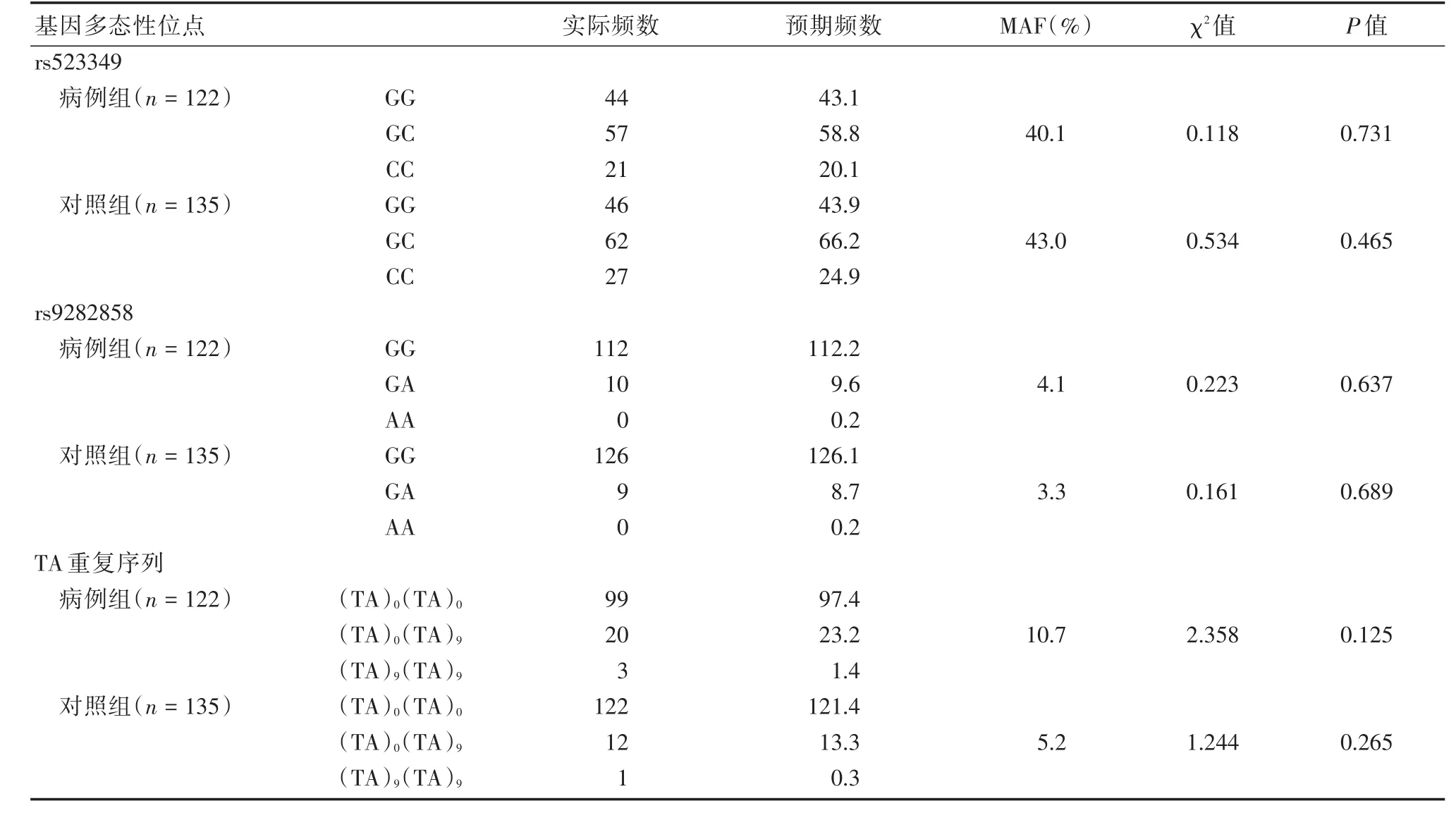
表2 SRD5A2基因多态性位点Hardy-Weinberg遗传平衡检验Tab.2 Hardy-Weinberg Genetic balance test of SRD5A2 gene polymorphic loci

表3 SRD5A2基因多态位点的基因型和等位基因频率在病例组和对照组中的分布Tab.3 Distribution of genotype and allele frequencies in the case group and the control group of the SRD5A2 gene polymorphic loci 例(%)
SRD5A2基因位于2号常染色体短臂(2p23),全长超过40 kb,由5个外显子和4个内含子构成[7]。目前已发现SRD5A2基因中存在多个多态性位点 ,但是rs523349(V89L)、rs9282858(A49T)和TA重复序列多态性是最常见的,也是被研究最多的[8]。rs523349(V89L)多态性是发生在SRD5A2基因第89密码子的一个错义替代,GUA碱基中G变为C,缬氨酸(Val)由亮氨酸(Leu)替代;rs9282858(A49T)多态性是发生在SRD5A2基因第49密码子的另一个错义替代,GCC碱基中变为A,丙氨酸(Ala)由苏氨酸(Thr)替代,因此它们能够通过氨基酸的替代来影响SRD5A2的活性[8]。而TA重复序列多态性位于SRD5A2基因的3′非编码区,是一个长度多态性,它不能影响所形成蛋白质的结构和功能,但是它可以通过改变mRNA的稳定性来调节SRD5A2的产生[8]。
NWOSU等[9]研究显示rs523349位点的错义替代发生率在高加索人中为8.5%,在非裔美国人中为2.5%,在台湾人中为28%。一些研究发现rs523349位点的基因型分布与高风险和低风险人群前列腺癌发病率的分布相一致,CC基因型的发生率在亚洲人群中为22%~25%,而在高加索人群和非裔美国人群中仅为4%;但是GG基因型的发生率在亚洲人群中为27%~29%,而在高加索人群和非裔美国人群中却为58%[10-11]。并且MAKRIDAKIS等[12]通过体外实验发现:同GG基因型相比,CC基因型能够降低5-α还原酶42%的活性。但是关于法国和瑞士人群的研究却发现CC基因型和前列腺癌的易感性相关[13-14]。LI等[6]通过对31个关于rs523349位点基因型的研究进行Meta分析发现:同G等位基因相比,C等位基因和前列腺癌的易感性无关。与Meta分析结果相似,在本研究中rs523349位点的基因型和等位基因频率分布在前列腺癌组和对照组之间没有统计学差异。本研究结果与文献报道的辽宁省汉族人群的研究结果一致[15]。
目前研究发现rs9282858位点丙氨酸(Ala)和苏氨酸(Thr)的错义替代和前列腺癌的病理特点有关,它能够增加5-α还原酶5倍的活性[16]。AA基因型在高加索人群中最常见(3.5%),其次为非裔美国人,亚洲人群或者拉美人群[16]。MAKRIDAKIS等[10]报道rs9282858位点的错义替代和非裔美国人群及拉美人群的高前列腺癌发病率显著相关,并且在进展性和预后不良的前列腺癌患者中过度表达。但是也有一些研究发现在高加索人群和亚洲人群中rs9282858多态性和前列腺癌的易感性无关[17-19]。本研究未发现rs9282858位点的AA基因型,并且GA基因型在前列腺癌组(8.2%)和对照组(6.7%)中的频率也很低,rs9282858多态性与前列腺癌发病风险性无关。本研究结果与文献报道的国内北方汉族人群研究结果相似[20]。
本研究所涉及的3个多态性位点中,TA重复序列多态性是相对研究较少的,至今为止,已发现至少10个TA重复序列多态性的等位基因[(TA)0,(TA)8,(TA)9,(TA)10,(TA)17,(TA)18,(TA)19,(TA)20,(TA)21,(TA)22],但是仅有(TA)0,(TA)9和(TA)18这3个等位基因比较常见,而(TA)0是所有人群中最常见的,(TA)18仅出现在非裔美国人群中[7]。由于具有(TA)18等位基因的非裔美国人群比亚裔美国人群和高加索人群具有更高的前列腺癌发病率,并且在30个前列腺癌患者中有56%的患者存在这个位点的体细胞突变,因此这个位点的多态性可能和前列腺癌的易感性相关。目前TA重复序列长度对5-α还原酶的影响还没有在体外实验中被证实。近年来一些研究发现(TA)9等位基因和前列腺癌的易感性相关[8],但是也有一些研究发现TA重复序列长度和前列腺癌的发病没有相关性[21-22]。NTAIS等[23]通过Meta分析发现TA重复序列多态性可能对前列腺癌易感性有一定影响。在本组研究中,(TA)0等位基因是最常见的(病例组为89.3%,对照组为94.8%),没有发现(TA)18等位基因,携带(TA)9等位基因者较携带(TA)0等位基因者患前列腺癌的风险明显增高(OR=2.181,95%CI:1.111 ~ 4.281,P=0.021)。
本研究与其他一些学者研究的结果存在一定差异,可能与遗传风险因素在不同种族中的作用不同有关,也可能与不同人群基因多态性分布不均有关。本研究局限性主要是样本含量较小,仅研究了云南彝族前列腺癌与SRD5A2基因多态性的关系,而缺乏多民族之间的比较,并且研究位点没有包括其他和雄激素合成代谢相关的基因位点。为解决上述问题,我们可以加大样本含量,将研究对象范围扩大到云南汉族、白族和傣族,进行民族间的比较,并且将研究位点扩大到雄激素受体(AR)基因多态性位点和维生素D受体(VDR)基因多态性位点。
综上所述,本研究是首次对云南少数民族彝族人群进行SRD5A2基因多态性与前列腺癌相关性研究,结果表明SRD5A2基因TA重复序列多态性与前列腺癌发病危险相关。这为云南彝族前列腺癌的基因危险因素研究提供了基础,并且为后期我们增加样本含量来加强我们结论的可靠性提供了方向。
[1]FITZMAURICE C,ALLEN C,BARBER R M,et al.Global,regional,and national cancer incidence,mortality,years of life lost,years lived with disability,and disability-adjusted lifeyears for 32 cancer groups,1990 to 2015:a systematic analysis for the global burden of disease study[J].JAMA Oncol,2017,3(4):524-548.
[2]叶定伟,朱耀.中国前列腺癌的流行病学概述和启示[J].中华外科杂志,2015,53(4):249-252.
[3]CHEN R,REN S,YIU M K,et al.Prostate cancer in Asia:a collaborative report[J].Asian J Urol,2014,1(1):15-29.
[4]MARCELLI M,CUNNINGHAM G R.Hormonal signaling in prostatic hyperplasia and neoplasia [J].J Clin Endocrinol Metab,1999,84(10):3463-3468.
[5]WU Y,GODOY A,AZZOUNI F,et al.Prostate cancer cells differ in testosterone accumulation,dihydrotestosterone conversion,and androgen receptor signaling response to steroid 5α-reductase inhibitors[J].Prostate,2013,73(13):1470-1482.
[6]LI X,HUANG Y,FU X,et al.Meta-analysis of three polymorphisms in the steroid-5-alpha-reductase,alpha polypeptide 2 gene(SRD5A2)and risk of prostate cancer[J].Mutagenesis,2010,26(3):371-383.
[7]REICHARDT J K V,MAKRIDAKIS N,HENDERSON B E,et al.Genetic variability of the human SRD5A2 gene:implications for prostate cancer risk[J].Cancer Res,1995,55(18):3973-3975.
[8]RAJENDER S,VIJAYALAKSHMI K,POOJA S,et al.Longer(TA)n repeat but not A49T and V89L polymorphisms in SRD5A2 gene may confer prostate cancer risk in South Indian men[J].J Androl,2009,30(6):703-710.
[9]NWOSU V,CARPTEN J,TRENT J M,et al.Heterogeneity of genetic alterations in prostate cancer:evidence of the complex nature of the disease[J].Hum Mol Genet,2001,10(20):2313-2318.
[10]MAKRIDAKIS N M,ROSS R K,PIKE M C,et al.Association of mis-sense substitution in SRD5A2 gene with prostate cancer in African-American and Hispanic men in Los Angeles,USA[J].Lancet,1999,354(9183):975-978.
[11]YAMADA Y,WATANABE M,MURATA M,et al.Impact of genetic polymorphisms of 17-hydroxylase cytochrome P-450(CYP17)and steroid 5α-reductase type II(SRD5A2)genes on prostate-cancer risk among the Japanese population[J].Int J Cancer,2001,92(5):683-686.
[12]MAKRIDAKIS N M,DI SALLE E,REICHARDT J K V.Biochemical and pharmacogenetic dissection of human steroid 5αreductase type II[J].Pharmacogenetics,2000,10(5):407-413.
[13]CUSSENOT O,AZZOUZI A R,NICOLAIEW N,et al.Low-activity V89L variant in SRD5A2 is associated with aggressive prostate cancer risk:an explanation for the adverse effects observed in chemoprevention trials using 5-alpha-reductase inhibitors[J].Eur Urol,2007,52(4):1082-1089.
[14]GIWERCMAN Y L,ABRAHAMSSON P A,GIWERCMAN A,et al.The 5α-reductase type II A49T and V89L high-activity allelic variants are more common in men with prostate cancer compared with the general population[J].Eur Urol,2005,48(4):679-685.
[15]佟明,金艳阳,李刚,等.睾酮5-α还原酶Ⅱ基因V89L多态性与前列腺癌预后关系的研究[J].中华男科学杂志,2010(11):990-993.
[16]JAFFE J M,MALKOWICZ S B,WALKER A H,et al.Association of SRD5A2 genotype and pathological characteristics of prostate tumors[J].Cancer Res,2000,60(6):1626-1630.
[17]LATIL A G,AZZOUZI R,CANCEL G S,et al.Prostate carcinoma risk and allelic variants of genes involved in androgen biosynthesis and metabolism pathways[J].Cancer,2001,92(5):1130-1137.
[18]MONONEN N,IKONEN T,SYRJAKOSKI K,et al.A missense substitution A49T in the steroid 5-alpha-reductase gene(SRD5A2)is not associated with prostate cancer in Finland[J].Br J Cancer,2001,84(10):1344-1347.
[19]SODERSTROM T,WADELIUS M,ANDERSSON S O,et al.5α-Reductase 2 polymorphisms as risk factors in prostate cancer[J].Pharmacogenetics,2002,12(4):307-312.
[20]刘建河,李鸿伟,佟明,等.北方汉族人群易感基因多态性与前列腺癌危险关系及对发病种族差异的分析[J].中华医学杂志,2004,84(5):364-368.
[21]KACHAKOVA D,MITKOVA A,POPOV E,et al.Polymorphisms in androgen metabolism genes AR,CYP1B1,CYP19,and SRD5A2 and prostate cancer risk and aggressiveness in Bulgarian patients[J].Turk J Med Sci,2016,46(3):626-640.
[22]SALAM M T,URSIN G,SKINNER E C,et al.Associations between polymorphisms in the steroid 5-α reductase type II(SRD5A2)gene and benign prostatic hyperplasia and prostate cancer[J].Urol Oncol,2005,23(4):246-253.
[23]NTAIS C,POLYCARPOU A,TSATSOULIS A.Molecular epidemiology of prostate cancer:androgens and polymorphisms in androgen-related genes[J].Eur J Endocrinol,2003,149(6):469-477.
