GRIK3胞内区蛋白在原核系统中的表达和纯化
2018-07-05高永辉肖斌刘明廖扬唐荣芝孙朝晖李林海
高永辉 肖斌 刘明 廖扬 唐荣芝 孙朝晖 李林海
中国人民解放军广州总医院(广州 510010)
谷氨酸是一种中枢兴奋性神经递质,参与机体多种重要的生理活动及病理改变。细胞膜表面的谷氨酸受体是游离谷氨酸发挥生物学功能的重要媒介[1-2]。谷氨酸受体分为离子型谷氨酸受体和代谢型谷氨酸受体,其中离子型谷氨酸受体又分为N-甲基-D-天冬氨酸(N-methyl-D-aspartate receptors,NMDA)受体、α-氨基-3-羟基-5-甲基-4异恶唑丙酸(α-Amino-3-hydroxy-5-methyl-4-isoazolepropionic acid,AMPA)受体和红藻氨酸受体(Kainate receptors,KARs)。离子型谷氨酸受体红藻氨酸受体亚基3(glutamate ionotropic receptor kainate type subunit 3,GRIK3)是 KARs家族的 5种亚型(GRIK1、GRIK2、GRIK3、KA1、KA2)中的一员。研究表明GRIK1、GRIK2和GRIK3既可自身组合形成功能性的同质性聚合体,也可彼此互相组装形成有功能的异聚复合体[3-4],两者均在多种神经退行性疾病中发挥重要作用。目前有关GRIK3的大部分研究都集中在中枢神经系统,其在中枢神经系统中的功能和作用机制已经研究的较为详尽[5],但是关于GRIK3在其他系统和疾病中作用机制的研究却非常有限。近年来有研究发现,GRIK3在心脏、胰腺、肺等外周组织也有广泛表达[6],亦有报道称,GRIK3在横纹肌肉瘤、神经母细胞瘤、甲状腺肿瘤、肺癌、星形细胞瘤、多发性骨髓瘤、神经胶质瘤、结直肠癌、乳腺癌等多种肿瘤中均有高表达[7]。谷氨酸受体的过表达对于肿瘤微环境中具有高浓度谷氨酸的肿瘤组织的生长极为重要[8],并可能影响肿瘤的转移潜能[9]。另外已证实NMDA受体家族能够调节肿瘤细胞的生化代谢和增殖能力[10]。本课题组前期对GRIK3在乳腺癌中的生物学功能进行了初步探索,我们发现过表达GRIK3能够促进乳腺癌细胞MCF-7的增殖与迁移,而敲低GRIK3显著抑制乳腺癌细胞SK-BR-3的增殖与迁移(未发表)。为了深入研究GRIK3在肿瘤细胞内的信号传导机制,本课题组2017年3-11月拟筛选并鉴定GRIK3的直接相互作用蛋白。膜蛋白的胞内区是与胞内第二信使相互作用和介导蛋白构象变化的重要区域。为此,我们需要获得纯化的GRIK3胞内段蛋白并进行GST pull down实验。
1 材料与方法
1.1 质粒及菌种 Rosseta菌株、pCzn1质粒、TOP10菌株均购自南京钟鼎生物技术有限公司。
1.2 主要试剂 Tyrptone、Yeast Extract购自 OXOID公司;IPTG、Acr、Bis、Tris购自Sigma公司;Agarose购自上海基因公司;限制性内切酶NheI和XbaI购自TaKaRa公司;DNA胶纯化试剂盒、质粒小提试剂盒购自AXYGEN公司;SDS购自Amresco公司;0.22 μm无菌滤器和透析袋购自Millipore公司;TEMED购自BIO-RAD公司;Protein Marker购自Thermo公司;Ni2+IDA亲和层析胶购自Novagen公司;Pfu DNA聚合酶购自zoonbio公司,货号PC12;其他试剂均为国产分析纯或化学纯。
1.3 仪器 AR5120电子天平(美国AHOM S公司);Biologic LP层析系统、Mini ProteanⅡ垂直平板电泳系统、Gel Doc2000成像系统、水平电泳系统(美国BIO-RAD公司);320-S pH计(美国Mettler Toledo公司);MultiTempⅢ恒温水浴锅、Hofer ΜV-25紫外透射仪(美国Amersham Pharmacia公司);PTC-200基因扩增仪(美国MJ Research公司);雪花状制冰机(日本SANYO公司);台式高速离心机(德国SORVAL公司);JY92-2D超声波细胞粉碎机(中国新芝科器研究所);Allegra 21R台式高速冷冻离心机(美国BECKMAN公司);超净工作台(中国苏净集团);NANODROP2000(Thermo公司)。
1.4 GRIK3表达区段的选择及重组质粒构建按照 Uniprot网站(http://www.uniprot.org/uniprot/Q13003)数据库中对于GRIK3蛋白拓扑结构的描述,选择GRIK3胞内区进行表达,GRIK3各区段截断序列分布如图1所示,胞内区DNA序列由华大基因完成合成拼接(图2)。
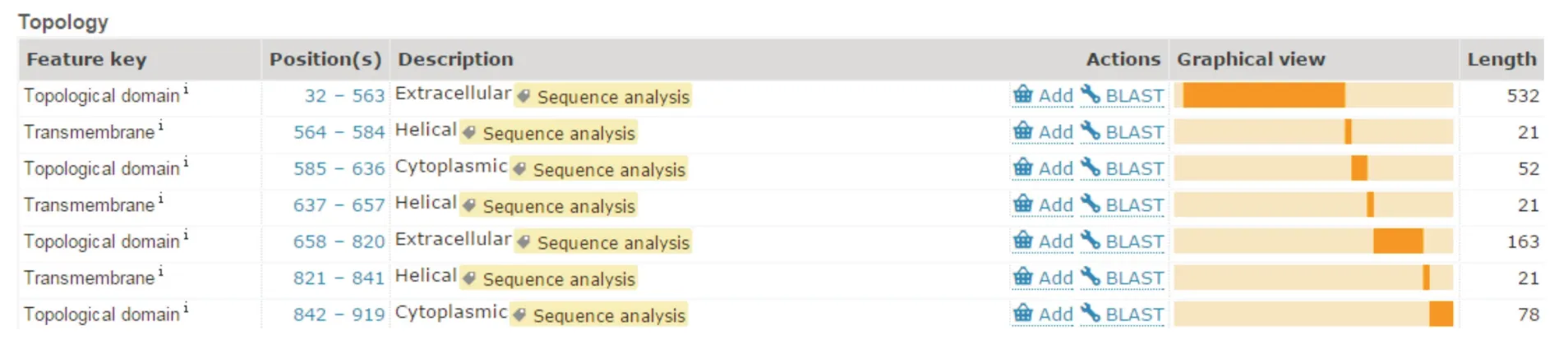
图1 GRIK3蛋白的胞内区、跨膜区及胞外区Fig.1 The intracellular regions,transmembrane regions and extraellular regions of GRIK3 protein

图2 GRIK3蛋白的胞内区拼接序列Fig.2 The splicing intracellular sequence of GRIK3 protein
使用限制性内切酶NheI和XbaI分别对合成的DNA序列和pCzn1空载体进行双酶切,然后把酶切后的DNA和线性化载体进行连接反应,将获得的重组质粒pCzn1-GRIK3转入TOP10克隆菌株后挑取阳性克隆进行测序,测序结果和原始序列对比无误。
1.5 质粒酶切鉴定 以限制性内切酶NheI和XbaI对重组质粒进行切割,用1.5%琼脂糖凝胶电泳来检测pCzn1线性化载体和GRIK3胞内区分子量的大小。
1.6 pCzn 1-GRIK3载体转化至大肠杆菌Rosseta把1 μL重组质粒加入100 μL感受态细菌中,放置在冰上20 min;42℃热激90 s后迅速放在冰中5 min;加入600 μL LB培养液,37℃,220 r/min振摇 1 h,离心后全部涂布于含50 μg/mL Amp的LB平板上,37℃倒置培养过夜。
1.7IPTG诱导pCZN1-GRIK3载体融合蛋白的表达 挑取转化平板上的单克隆接种在含50 μg/mL AMP的3 mL LB培养液的试管之中,37℃220 r/min振摇过夜;第2天按 1∶100接种于50 μg/mL AMP的30 mL LB培养液中,37℃220 r/min振摇菌体至OD600为0.6~0.8(大约 2 h);取出1 mL培养物,室温10 000g离心2 min,弃去上清液后用100 μL 1×上样缓冲液使菌体沉淀重悬;向剩余的培养物中加入IPTG直到终浓度为0.5 mmol/L,对rosseta菌种37℃诱导4 h即可诱导融合蛋白表达;取出1 mL培养物,室温10 000g离心2 min,弃去上清液后用100 μL 1×上样缓冲液重悬菌体沉淀。重悬培养物4 000g离心10 min,弃去上清液,用PBS使菌体沉淀重悬;重悬液进行超声波破碎后离心并分别取上清液与沉淀液加入上样缓冲液重悬;进行12%SDS-PAGE分析。
1.8 融合蛋白的Ni柱亲和纯化 利用低压层析系统,将上清液以0.5 mL/min流速上样至已通过Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose CL-6B亲和层析柱;再用Ni-IDA Binding-Buffer以0.5 mL/min流速冲洗,至流出液的OD280值到达基线;用 Ni-IDA Washing-Buffer(20 mmol/L Tris-HCl,20 mmol/L 咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速冲洗,至流出液的OD280值到达基线;最后用 Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,250 mmol/L 咪唑,0.15 mol/L NaCl,pH 8.0)洗脱目的蛋白,流速为1 mL/min;收集流出液并加入透析袋中,使用 20 mmol/L Tris-HCl,0.10 mol/L NaCl,pH 8.0进行透析过夜;进行12%SDS-PAGE分析。
2 结果
2.1 质粒酶切鉴定 琼脂糖凝胶电泳分析显示,双酶切后GRIK3胞内区基因片段在500~750 bp之间,与目的基因的预期分子量大小相符。重组质粒送华大基因测序后证实插入基因序列正确,无突变、缺失等情况。见图3。
2.2 重组质粒的诱导表达 将重组工程菌的诱导表达产物经12%SDS-PAGE分析,目的蛋白主要存在于上清中(图4),目标条带(含His标签)的相对分子质量约18 kD,大小与蛋白质的理论分子量17.204 kD相符,而未经IPTG诱导的菌液表达产物在相同位置没有明显的目标条带。

图3 重组质粒pCzn1-GRIK3的双酶切鉴定Fig.3 The double enzyme digestion of the recombinant plasmid pCzn1-GRIK3

图4 GRIK3蛋白胞内区原核表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the prokaryotic expressed GRIK3-intra
2.3 Ni柱纯化结果分析 通过Ni柱亲和纯化目的蛋白GRIK3胞内段,经SDS-PAGE分析,洗脱液中可见清晰且单一的目标条带(图5),而未纯化的透析液和流出液中除目标条带以外,还含有明显的杂带,表明成功纯化了GRIK3胞内区。
3 讨论
谷氨酸受体家族的各亚型在中枢神经系统以及神经系统肿瘤中发挥重要作用,然而在其他恶性肿瘤中的生物学功能及作用机制仍有待发现。GRIK3是谷氨酸受体中的红藻氨酸受体亚型成员之一。在脑组织中,红藻氨酸受体参与突触神经信号传递的调节;GRIK3受体富集于海马回突触前部位,并通过红藻氨酸受体促进突触神经传递。
近年来,多项研究表明红藻氨酸受体在恶性肿瘤的发生发展中也起到关键作用。STEPULAK等[7]证实所有的谷氨酸受体亚单位在多种肿瘤细胞系中均有表达,且红藻氨酸受体亚型表达水平较其他受体亚基更高。红藻氨酸受体家族的各亚型蛋白,在特定肿瘤中发挥着不同的作用。LI等[11]利用全基因组关联研究(genome-wide association studies,GWAS)表明GRIK1是HBV引起的肝癌的易感性基因位点;WU等[12]发现GRIK2是胃癌的肿瘤抑制因子,在胃癌发生过程中,GRIK2的启动子被甲基化而抑制GRIK2的基因转录,从而促进了胃癌的发展;PRADHAN等[13]证实GRIK3基因在肺腺癌的不同病理阶段均被甲基化。基于以上研究,笔者认为GRIK3可能在肿瘤细胞发生发展过程中发挥重要作用。但GRIK3的相互作用蛋白和相关信号通路仍不清楚。另外,HUAN等[14]和LIU等[15]认为GRIK3通过神经活性配体-受体途径相互作用,并且与乳腺癌、结肠癌患者的预后显著相关;BAO等发现GRIK3的过度表达与淋巴瘤的转移、YNM分期以及预后均相关,提示GRIK3是淋巴瘤的独立预后因素。这些研究均表明GRIK3可能成为特定肿瘤的潜在检测靶标,也提示GRIK3拮抗剂可能是未来治疗特定肿瘤的有效手段。

图5 GRIK3胞内区蛋白纯化后SDS-PAGE分析Fig.5 SDS-PAGE analysis of purified GRIK3-intra
由于GRIK3为细胞膜蛋白,其分子量较大且蛋白结构复杂,经软件预测含有大量的疏水性结构,进行全长表达较为困难。而膜蛋白的胞内区是传递胞外信号并激活胞内第二信使的重要环节,是膜蛋白功能的重要执行者。故本次实验根据Uniprot网站数据库中对于GRIK3蛋白拓扑结构的描述,选择GRIK3胞内区进行表达。但是本实验没有对目的蛋白进行活性验证,蛋白的活性是否受到影响这有待于后续实验进行研究。
总之,本研究成功构建出插入序列正确的GRIK3胞内区原核表达质粒pCZN1-GRIK3,在E.coli系统中高效表达并以Ni柱亲和层析方式纯化了目的蛋白,为探究膜蛋白GRIK3的相互作用蛋白及其下游信号通路、阐明GRIK3的生物学作用提供了有价值的研究工具。
[1]RIBEIRO M P,CUSTODIO J B,SANTOS A E.Ionotropic glutamate receptor antagonists and cancer therapy:time to think out of the box?[J].Cancer Chemother Pharmacol,2017,79(2):219-225.
[2]TRAYNELIS S F,WOLLMUTH L P,MCBAIN C J,et al.Glutamate receptor ion channels:structure,regulation,and function[J].Pharmacol Rev,2010,62(3):405-496.
[3]LERMA J,PATERNAIN A V,RODRIGUEZ-MORENO A,et al.Molecular physiology of kainate receptors[J].Physiol Rev,2001,81(3):971-998.
[4]侯文婷,刘晓湘,曹德寿.KA受体的研究进展[J].解剖科学进展,2004,10(2):150-154.
[5]袁磊,龚济钦,张海霞,等.红藻氨酸受体与神经退行性变疾病相关性研究进展[J].中国临床新医学,2014,7(4):367-371.
[6]高雪.心脏促离子型谷氨酸受体功能的研究[D].中国协和医科大学,北京:2006.
[7]STEPULAK A,LUKSCH H,GEBHARDT C,et al.Expression of glutamate receptor subunits in human cancers[J].Histochem Cell Biol,2009,132(4):435-445.
[8]LUKSCH H,UCKERMANN O,STEPULAK A,et al.Silencing of selected glutamate receptor subunits modulates cancer growth[J].Anticancer Res,2011,31(10):3181-3192.
[9]RZESKI W,TURSKI L,IKONOMIDOU C.Glutamate antagonists limit tumor growth[J].Proc Natl Acad Sci U S A,2001,98(11):6372-6377.
[10]STEPULAK A,SIFRINGER M,RZESKI W,et al.NMDA antagonist inhibits the extracellular signal-regulated kinase pathway and suppresses cancer growth[J].Proc Natl Acad Sci U S A,2005,102(43):15605-15610.
[11]LI S,QIAN J,YANG Y,et al.GWAS identifies novel susceptibility loci on 6p21.32 and 21q21.3 for hepatocellular carcinoma in chronic hepatitis B virus carriers[J].PLoS Genet,2012,8(7):e1002791.
[12]WU C S,LU Y J,LI H P,et al.Glutamate receptor,ionotropic,kainate 2 silencing by DNA hypermethylation possesses tumor suppressor function in gastric cancer[J].Int J Cancer,2010,126(11):2542-2552.
[13]PRADHAN M P,DESAI A,PALAKAL M J.Systems biology approach to stage-wise characterization of epigenetic genes in lung adenocarcinoma[J].BMC Syst Biol,2013,7:141.
[14]HUAN J,WANG L,XING L,et al.Insights into significant pathways and gene interaction networks underlying breast cancer cell line MCF-7 treated with 17beta-estradiol(E2)[J].Gene,2014,533(1):346-355.
[15]LIU Y,WANG L,WANG B,et al.Pathway analysis based on attractor and cross talk in colon cancer[J].Dis Markers,2016,2016:2619828.
