大豆渣制备细菌纤维素的研究1
2018-07-05邹小周
高 媛 , 邹小周 , 洪 枫 , 陈 琳 *
(1. 纤维材料改性国家重点实验室(东华大学),上海 201620;2. 东华大学 化学化工与生物工程学院,上海 201620)
细菌纤维素(Bacterial Cellulose, BC)是由微生物产生的超细纳米纤维结构纤维素,因其独特的物理化学性质可被广泛应用于造纸、食品、功能材料等领域[1]。作为一种高附加值的生物材料[2],BC还在人造血管[3]、药物缓释[4]、伤口敷料[5]等诸多领域受到研究者的关注[6]。但BC高成本和低产量限制了其工业化生产,特别是较高的培养基碳源成本已成为BC工业化生产和应用的主要障碍。近年来,已有报道利用工农业原料和废弃物制备BC的各种尝试,如利用魔芋[7]、麦秆[8]、稻秆[9-10]、甘蔗糖蜜[11]、纸浆废料[12]、腰果树残渣[13]、废弃棉织物[14]和云杉水解液[15]等。
大豆渣是大豆加工过程中的主要副产物,但由于豆渣所含热能低且口感粗糙,一直以来未引起人们的重视。豆渣过去大多作为家畜饲料或废弃物倾倒,造成了资源浪费和环境污染[16]。目前豆渣主要的利用方式包括:发酵制酱油[17]、食品添加剂、提取膳食纤维、提取水解蛋白等[18-19]。豆渣干物质中一般含有60~70%的糖类[20-21],这些糖类可降解成葡萄糖等可发酵糖。利用这些糖发酵制备BC,不仅可以降低BC生产成本,还可以解决废弃豆渣造成的环境污染等问题。
本文以提取了豆油和蛋白的大豆渣为原料,经酸预水解后再进行酶水解,并以预水解液和酶水解液为碳源分别制备BC,比较两者在BC产量上的差异,拟开发一种新的低成本培养基碳源。
1 实验
1.1 菌体和原料
所用菌种:木葡糖酸醋杆菌DHU-WYZ-1,实验室筛选菌种;大豆渣由南通来宝谷物蛋白公司提供,是经榨油和提取蛋白后的纤维渣;纤维素酶购自上海源叶生物科技有限公司。
1.2 工艺流程

1.3 还原糖得率的测定
还原糖浓度的测定通过3,5-二硝基水杨酸法(DNS法)[22]。还原糖得率通过公式(1)计算得到。
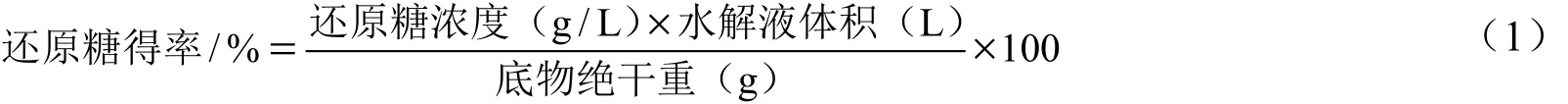
1.4 纤维素酶活测定
采用滤纸酶活检测法测定所使用纤维素酶的酶活[23]。滤纸酶活(filter paper activity,FPA)的定义:在50℃、pH4.8的条件下,每分钟由滤纸底物生成2.0 mg葡萄糖所需的酶用量为一个FPU。
1.5 实验设计方案
1.5.1 酸预处理单因素实验
研究酸浓度、底物浓度、温度和时间对还原糖得率的影响。1)在底物浓度45 g/L、120℃和反应时间30 min条件下,研究酸浓度在1%~11%范围内对还原糖得率影响。2)固定其他条件,酸浓度为5%,研究底物浓度在30~90 g/L范围内对还原糖得率影响。3)固定其他条件,设定反应温度范围为105~120℃(反应器限制,温度最高只能到129℃),研究温度对还原糖得率影响。4)固定其他条件,反应时间15~90 min,研究时间对还原糖得率影响。
1.5.2 酶水解单因素实验
研究酶浓度、底物浓度、温度和时间对还原糖得率的影响。1)在底物浓度30 g/L、pH为4.8、50℃条件下,加入纤维素酶130~325 U/mL,恒温水浴振荡(100 r/min)8 h,研究酶浓度对还原糖得率的影响。2)固定其他条件,酶浓度为325 U/mL,研究底物浓度在40~150 g/L范围内对还原糖得率的影响。3)固定其他条件,设置温度为35~60℃,研究温度对还原糖得率的影响。4)固定其他条件,反应6~30 h,研究时间对还原糖得率的影响
1.6 培养基的制备
1.6.1 稀酸预处理豆渣
底物浓度为60 g/L,酸浓度为5%(w/V),120℃反应30 min,冷却过滤,滤液保存用于制备BC,滤渣用去离子水洗至pH≥4.5并用冻干机冻干36 h,得到酶解底物滤渣。
1.6.2 纤维素酶水解滤渣
准确称取1.1 g已冻干的滤渣于50 mL容器中,加入19 mL去离子水,调节pH为4.8,加入纤维素酶液至反应液中纤维素酶的终浓度为325 U/mL,50℃水浴震荡反应24 h,冷却过滤,滤液保存用于制备BC。
1.6.3 酸预水解液和酶水解液的脱毒及培养基制备
1)活性炭脱毒:向水解液中加入2%(w/V)的活性炭,在室温下剧烈搅拌反应5 min后,在9 500 r/min的条件下离心10 min,取出后再进行倾滤,取出上清液用10 M的NaOH溶液调pH至5.0。2)Ca(OH)2脱毒:加入Ca(OH)2调节水解液的pH至11.0,在30℃下反应3 h,在9 500 r/min的条件下离心10 min,取出上清液后用10 M的H2SO4溶液调pH至5.0[24]。将不同方式处理后的酸预水解液和酶水解液测还原糖浓度,按还原糖添加量为25 g/L配制培养基,并以25 g/L葡萄糖为对照组,分别加入5 g/L胰蛋白胨和3 g/L酵母粉于121℃,20 min条件下灭菌得木醋杆菌发酵培养基(如表1所示)。
1.6.4 基本培养基
葡萄糖25 g/L,胰蛋白胨5 g/L,酵母粉3 g/L,pH为5.0,121℃灭菌20 min。

表1 发酵实验组及所对应的编号
1.7 菌种培养及细菌纤维素的制备
从菌种斜面上取一环木醋杆菌接入含基本培养基的锥形瓶中,在30℃,160 r/min的摇床中培养种子液。将培养1 d的种子液以10%(V/V)的接种量接入50 mL锥形瓶中,锥形瓶内装有各实验组培养基15 mL。接种后,将锥形瓶置于30℃恒温培养箱中静置培养12 d,在液体培养基表面生成细菌纤维素膜。
1.8 细菌纤维素产量的测定
取出培养好的细菌纤维素膜,经蒸馏水多次冲洗后浸入 1%(w/V)的 NaOH溶液中,80℃水浴处理2 h,除去残存的菌体和培养基,取出后清洗,然后再浸入80℃去离子水中清洗2 h,反复多次,直至细菌纤维素膜呈白色半透明状,再用去离子水反复冲洗至中性,经冷冻干燥36 h后称重。计算公式(2)如下。

2 结果与讨论
2.1 酸预处理和酶水解单因素实验
2.1.1 酸或酶等催化剂浓度对还原糖得率的影响
酸水解反应(图1a)中,还原糖得率随酸浓度的增加先上升,后趋于平缓。因为当温度一定时,增加酸浓度能促进半纤维素和少量纤维素降解生成单糖,继续增加酸浓度会使单糖降解成糠醛和羟甲基糠醛等化合物,造成还原糖得率上升缓慢,所以酸浓取5%较合适。在酶水解反应(图1b)中,当底物浓度一定时,还原糖得率随酶浓度的增加先上升,后趋于平缓。说明当酶浓度达到一定程度以后,底物与酶的结合呈饱和状态,过多的酶会造成不必要的浪费,纤维素酶浓度取325 U/mL较合适。
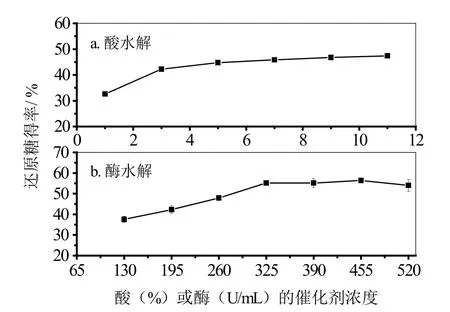
图1 催化剂浓度对还原糖得率的影响
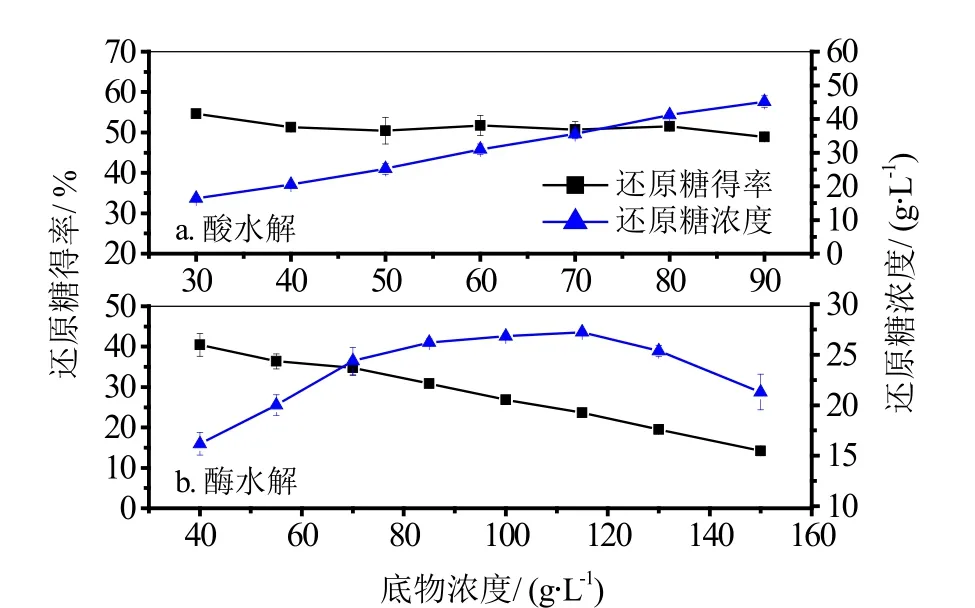
图2 底物浓度对还原糖得率的影响
2.1.2 底物浓度对还原糖得率的影响
酸水解反应(图2a)中,随着底物浓度的增加,还原糖得率变化不大,而还原糖浓度呈递增趋势。在实际操作过程中,底物浓度超过70 g/L,难以搅拌均匀,体系流动性差,底物浓度超过90 g/L,稀酸溶液不能完全浸湿底物,反应物接触不充分。综合考虑,底物浓度为60 g/L较合适。在酶水解反应(图2b)中,还原糖得率随底物浓度的增大逐渐减小,而还原糖浓度先增加后减小。在底物浓度为115 g/L时,糖浓达最大值。因为当底物浓度较高时,相对液量较少,酶解过程中糖的扩散和酶的转移都受到限制,体系不均、流动性差,酶解速率降低,还原糖得率降低。综合考虑,底物浓度选55 g/L较合适。
2.1.3 反应温度对还原糖得率的影响
酸水解反应(图3a)中,在所取温度范围内,还原糖得率逐渐上升,且120℃时还原糖得率最高。在酶水解反应(图 3b)中,还原糖得率随温度的升高,先上升后下降,在 50℃时,达最大值。这与纤维素酶的最适反应温度有关,随着温度升高酶催化反应速率加快,但超过最适反应温度后,继续升高温度会使酶活性降低甚至失活,导致酶解反应速率下降,还原糖得率下降。

图3 反应温度对还原糖得率的影响
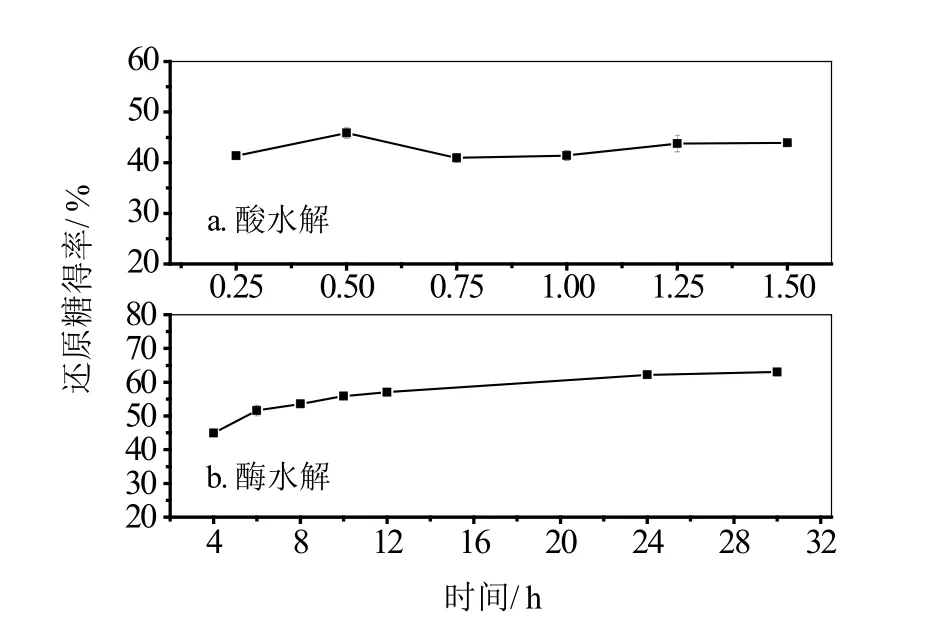
图4 反应时间对还原糖得率的影响
2.1.4 反应时间对还原糖得率的影响
酸水解反应(图4a)中,时间对还原糖得率的影响并不明显,此条件下,反应30 min时还原糖得率最大。在酶水解反应(图4b)中,还原糖得率随反应时间的延长,先上升后趋于平缓,可能是因为随着酶解时间的延长,酶解液中的葡萄糖含量和纤维素二糖含量逐渐增加,对酶水解反应起到了一定的抑制作用。
根据单因素实验,综合考虑酸预处理的适宜条件为:酸浓度为5%,底物浓度为60 g/L,温度为120℃,时间为30 min。此条件下,还原糖得率为51.7%。酶水解的适宜条件为:纤维素酶浓度325 U/mL,底物浓度55 g/L,温度50℃,pH为4.8,时间24 h。此条件下,还原糖得率为54.5%。
2.2 细菌纤维素的产量及分析
2.2.1 发酵过程中还原糖浓度的变化
由图5a可知,以酸预处理液作为碳源的发酵实验中,对照组在0~6 d内木醋杆菌生长较快,第6 d开始还原糖浓度因培养基水分蒸发而回升。Ca(OH)2脱毒组在0~12 d内还原糖一直在消耗。活性炭脱毒组在3~9 d内耗糖较快。未处理组中木醋杆菌从第6 d开始生长,糖浓在9 d内消耗较快。发酵结束时各实验组的耗糖量大小依次为对照组>Ca(OH)2脱毒组>活性炭脱毒组>未处理组。
由图5b可知,以酶水解液作为碳源的发酵实验中,Ca(OH)2脱毒组和对照组的糖浓走向基本一致,前3 d木醋杆菌耗糖较快,后期耗糖较慢。活性炭脱毒组前6 d,糖浓基本不变,从第6 d开始耗糖量上升,且耗糖较快。未处理组的耗糖量从第9 d才开始上升,前期木醋杆菌基本没有生长。发酵结束时各实验组的耗糖量大小依次为对照组>Ca(OH)2脱毒组>活性炭脱毒组>未处理组。
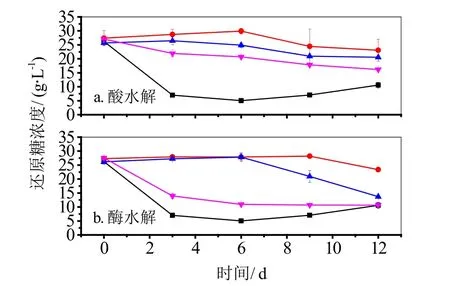
图5 各实验组发酵过程中还原糖浓度的变化对照组活性炭脱毒组未处理组Ca(OH)2脱毒组

图6 各实验组纯化冻干后的BC产量
2.2.2 细菌纤维素的产量
如图6所示,各实验组BC产量排序为D2(酶解液Ca(OH)2脱毒组)>C2(酶解液活性炭脱毒组)>A(葡萄糖对照组)>D1(预处理液Ca(OH)2脱毒组)>B2(酶解液未处理组)>C1(预处理液活性炭脱毒组)>B1(预处理液未处理组)。
未经脱毒处理的酸预处理液和酶解液的BC产量都不高,主要原因推测是预处理液和酶解液中均含有酸预处理时形成的木质纤维素衍生抑制物。木质纤维类原料在高温、低pH的条件下进行预处理,一般会生成抑制物[25]。大豆渣中综纤维素和木质素经过稀酸高温高压水解诱发一系列的副反应,生成呋喃醛(如糠醛和羟甲基糠酸等)和酚类等物质,这些物质能抑制木醋杆菌生长代谢,减少BC的产量[26-27]。另外,由于简单的水洗不能有效的去除附着在酶解底物滤渣上的抑制物,造成酶解液中还残留一些抑制物;同时用活性炭处理的C1和C2两组,C2的BC产量远大于C1,说明酸预处理液中的发酵抑制物可能远多于酶水解液;D1和D2的BC产量分别是酸预处理液和酶解液发酵实验组中最高的,说明Ca(OH)2的脱毒效果优于活性炭脱毒,其中D2的BC产量5.52 g/L为最高,是葡萄糖对照组0.75 g/L的7.4倍,远高于对照组。这可能是因为酶解液中除了有酶作用生成的葡萄糖等糖以外,还产生了一些能促进木醋杆菌生长的低聚糖。另外大豆渣是一种天然产物,可能含有一些能够适应木醋杆菌的生长因子,且酶解底物滤渣中氮元素含量为3.5%(元素分析仪测得),含氮丰富,有利于BC的合成;C2的BC产量是2.86 g/L,仅次于D2,是葡萄糖对照组的3.8倍,脱毒效果也较好,其余实验组的BC产量均低于葡萄糖对照组;其中,以预处理液作为碳源的发酵实验组BC产量均低于以酶解液作为碳源的发酵实验组,这可能是因为水解液中糖成分差异大造成的。张硕等实验分析了七种糖类对木醋杆菌的影响,当发酵初始糖浓为 25 g/L时,木醋杆菌的BC产量排序依次为D-果糖>D-葡萄糖>D-木糖>D-半乳糖>L-阿拉伯糖>D-甘露糖[28],酸预处理过程水解的主要是半纤维素,降解后主要生成L-阿拉伯糖、木糖和半乳糖,预处理液中葡萄糖含量较少,而酶解液中的糖成分主要是葡萄糖。
从实验结果可知,以酶解液作为发酵碳源时,Ca(OH)2脱毒后的BC产量是葡萄糖对照组的7.4倍,说明以大豆渣作为发酵碳源生产细菌纤维素的效果明显优于以葡萄糖为碳源的,能有效降低BC生产成本,提高原料利用率。对比酶水解得到的碳源,虽然酸预处理液实验组的BC产量普遍偏低,但是作为豆渣原料的预处理工序,也产生了一定量的可发酵糖,提高了原料利用率。就两种脱毒方法而言,Ca(OH)2脱毒法优于活性炭脱毒。这与郭香在云杉水解液脱毒工作中得到的结果相同,说明Ca(OH)2脱毒相对于其它方法普遍有效[15]。
3 结论
本研究通过单因素试验考察了酸或酶的催化剂浓度、底物浓度、反应温度和时间对酸预处理和酶水解反应的影响,研究比较了以葡萄糖、酸预处理液、酶解液作为碳源制备BC的产量。结果表明:用Ca(OH)2脱毒后的酶解液作为碳源,获得的BC产量5.52 g/L最高,是对照组0.75 g/L的7.4倍,明显优于葡萄糖对照组。大豆渣价廉量大,稀酸预处理、酶水解过程操作简单,所以大豆渣是制备细菌纤维素的良好碳源,这为细菌纤维素的工业化低成本规模生产提供了一条新的路径。
[1] Reiniati I, Hrymak A N, Margaritis A. Recent developments in the production and applications of bacterial cellulose fibers and nanocrystals[J]. Critical Reviews in Biotechnology, 2016, 37(4): 1-15.
[2] Ullah H, Wahid F, Santos H A, et al. Advances in biomedical and pharmaceutical applications of functional bacterial cellulose-based nanocomposites[J]. Carbohydrate Polymers, 2016, 150(5): 330-352.
[3] Tang J, Bao L, Li X, et al. Potential of PVA-doped bacterial nano-cellulose tubular composites for artificial blood vessels[J].Journal of Materials Chemistry B, 2015, 3(43): 8537-8547.
[4] Abeer M M, Mohd Amin M C, Martin C. A review of bacterial cellulose-based drug delivery systems: Their biochemistry,current approaches and future prospects[J]. Journal of Pharmacy & Pharmacology, 2014, 66(8): 1047.
[5] Sulaeva I, Henniges U, Rosenau T, et al. Bacterial cellulose as a material for wound treatment: Properties and modifications. A Review[J]. Biotechnology Advances, 2015, 33(8): 1547-1571.
[6]谭玉静, 洪枫, 邵志宇. 细菌纤维素在生物医学材料中应用的研究进展[J]. 中国生物工程杂志, 2007, 27(4):126-131.
[7] Hong F, Qiu K. An alternative carbon source from konjac powder for enhancing production of bacterial cellulose in static cultures by a model strain Acetobacter aceti subsp. xylinus ATCC 23770[J]. Carbohydrate Polymers, 2008, 72(3):545-549.
[8] Chen L, Hong F, Yang X X, et al. Biotransformation of wheat straw to bacterial cellulose and its mechanism[J]. Bioresource Technology, 2013, 135(10): 464-468.
[9] Hong F, Zhu Y X, Yang G, et al. Wheat straw acid hydrolysate as a potential cost-effective feedstock for production of bacterial cellulose[J]. Journal of Chemical Technology & Biotechnology, 2011, 86(5): 675-680.
[10] Hong F, Han S. Biorefinery of bacterial cellulose from rice straw: Enhanced enzymatic saccharification by ionic liquid pretreatment[J]. Engineering Sciences, 2011, 9(4): 23-26.
[11] Tyagi N, Suresh S. Production of cellulose from sugarcane molasses using gluconacetobacter intermedius SNT-1: Optimization& characterization[J]. Journal of Cleaner Production, 2016, 112(20): 71-80.
[12] Cavka A, Xiang G, Tang S J, et al. Production of bacterial cellulose and enzyme from waste fiber sludge[J]. Biotechnology for Biofuels, 2013, 6: 25.
[13] Pacheco G, Nogueira C R, Meneguin A B, et al. Development and characterization of bacterial cellulose produced by cashew tree residues as alternative carbon source[J]. Industrial Crops & Products, 2017, 107(15): 13-19.
[14] Hong F, Guo X, Zhang S, et al. Bacterial cellulose production from cotton-based waste textiles: Enzymatic saccharification enhanced by ionic liquid pretreatment[J]. Bioresource Technology, 2012, 104(1): 503-508.
[15] Guo X, Cavka A, Jönsson L J, et al. Comparison of methods for detoxification of spruce hydrolysate for bacterial cellulose production[J]. Microbial Cell Factories, 2013, 12(1): 93-106.
[16]祝团结, 郑为完. 大豆豆渣的研究开发现状与展望[J]. 食品研究与开发, 2004, 25(4): 25-28.
[17]陈霞, 杨香久. 豆渣的综合开发利用[J]. 食品研究与开发, 1996, 17(3): 43-44.
[18]肖少香. 豆渣产品研发综述[J]. 粮食科技与经济, 2006, 31(6): 45-48.
[19]赵影, 韩建春, 郑环宇, 等. 豆渣深加工及综合利用的研究现状[J]. 大豆科学, 2013, 32(4): 555-560.
[20] Riet W B V D, Wight A W, Cilliers J J L, et al. Food chemical investigation of tofu and its byproduct okara[J]. Food Chemistry,1989, 34(3): 193-202.
[21]李里特, 李再贵, 殷丽君. 大豆加工与利用[M]. 化学工业出版社, 2003.
[22] Lindsay H. A colorimetric estimation of reducing sugars in potatoes with 3,5-dinitrosalicylic acid[J]. Potato Research, 1973,16(3): 176-179.
[23] Aney B, Baker J. Measurement of cellulase activities[D]. Laboratory Analytical Procedure, 2008.
[24] Persson P, Andersson J, Gorton L, et al. Effect of different forms of alkali treatment on specific fermentation inhibitors and on the fermentability of lignocellulose hydrolysates for production of fuel ethanol[J]. Journal of Agricultural & Food Chemistry,2002, 50(19): 5318.
[25] Jönsson L J, Martín C. Pretreatment of lignocellulose: Formation of inhibitory by-products and strategies for minimizing their effects[J]. Bioresource Technology, 2016, 199(1): 103-112.
[26] Zhang S, Winestrand S, Guo X, et al. Effects of aromatic compounds on the production of bacterial nanocellulose by Gluconacetobacter xylinus[J]. Microbial Cell Factories, 2014, 13(1): 1-11.
[27] Zhang S, Winestrand S, Chen L, et al. Tolerance of the nanocellulose-producing bacterium Gluconacetobacter xylinus to lignocellulose-derived acids and aldehydes[J]. Journal of Agricultural & Food Chemistry, 2014, 62(40): 9792.
[28]张硕, 杜倩雯, 兰水, 等. 七种糖类对木醋杆菌和红茶菌的影响[J]. 纤维素科学与技术, 2014, 22(4): 18-27.
