玉米黄素双棕榈酸酯乳液制备及其稳定性研究
2018-07-05ERANSevcan倪元颖
温 馨 李 茉 ERAN Sevcan 胡 锐 耿 娜 倪元颖
(1.中国农业大学食品科学与营养工程学院, 北京 100083; 2.霍恩海姆大学食品科学与生物技术所, 斯图加特 70599; 3.北京市西城区食品药品监督管理局, 北京 100033)
0 引言
玉米黄素(Zeaxanthin),又名玉米黄质,与叶黄素(Lutein)为同分异构体,属于含氧类胡萝卜素(Xanthophyll)[1]。玉米黄素、叶黄素和内消旋玉米黄素(meso-Zeaxanthin)被称作黄斑色素[2]。研究表明玉米黄素具有抗氧化,预防和治疗老年黄斑变性,减小白内障患病风险,预防癌症、心血管疾病和糖脂代谢疾病等生理功能[3-4]。人体自身不能合成玉米黄素,主要通过膳食获得。目前已知的富含玉米黄素的食物主要包括枸杞、酸浆、玉米、蛋黄和深绿色蔬菜等[4],其中枸杞和酸浆中玉米黄素的含量最高,是玉米和蛋黄中含量的10倍多,且主要以玉米黄素双棕榈酸酯(ZDP)的形式存在[5-6]。ZDP为游离态玉米黄素的两侧羟基分别与棕榈酸结合而形成的天然类胡萝卜素酯。研究表明类胡萝卜素酯比其对应的游离态含氧类胡萝卜素具有更好的热稳定性、加工稳定性和贮藏稳定性[7-9],因此ZDP比其游离态玉米黄素更适宜作为膳食营养补充剂。另外,ZDP以酯类形式存在,不像游离态含氧胡萝卜素因有游离羟基而存在一定的助氧化活性,因此比其游离态类胡萝卜素更适合作为天然色素用于含脂食品的着色[10]。然而,由于ZDP来源于游离态玉米黄素的双侧羟基被棕榈酸酯化,导致其拥有比游离态玉米黄素更低的极性,更强的疏水性和脂溶性,从而限制了其在水溶体系中作为天然色素的广泛应用,并且影响其生物利用率。
研究表明通过制备类胡萝卜素乳液可以有效地提高其水溶性及加工过程和贮藏过程中的化学稳定性,并且通过调节其在运载体系中的释放、溶解和界面性质来提高其生物利用率[11]。目前,关于类胡萝卜素乳液的研究主要集中于β-类胡萝卜素乳液和番茄红素乳液,研究人员通过优化乳化方法、配方和条件等来制备稳定性好和生物利用率高的乳液[11-12]。目前有少量文献报道了关于叶黄素乳液的制备[13-17],且主要使用游离态的叶黄素制备乳液,仅有一篇文献涉及叶黄素酯制备乳液[14],尚未发现有玉米黄素乳液制备相关的研究,仅有一篇文献关于ZDP脂质体制备的研究[18]。
因此,本文采用几种不同的天然和合成乳化剂通过高压均质制备ZDP乳液,并考察乳化剂种类和浓度、油相种类以及ZDP添加量对乳液稳定性的影响,以期为玉米黄素在作为天然安全的植物色素或者作为具有多种生物学活性的膳食营养补充剂产品上的应用提供理论支持和技术参考。
1 材料与方法
1.1 试验材料与试剂
ZDP,法国Extrasynthése公司;大豆卵磷脂(SL)和蔗糖酯(SE15),武汉远成共创科技有限公司;十聚甘油单油酸酯(PGE18)和十聚甘油单月桂酸酯(PGE12),济南东润精化科技有限公司;吐温80(T80),德国三颗星食品物料公司;乳清分离蛋白(WPI),河南万邦实业有限公司;大豆油(SO),益海嘉里有限公司;中链甘油三酯(MCT),印度尼西亚Musim MAS公司。
试验试剂:磷酸二氢钠和磷酸氢二钠(食品级),连云港科德化工有限公司;尼罗红,北京索莱宝科技有限公司;石油醚、正己烷、无水乙醇均为分析纯(北京化工厂)。
1.2 试验仪器与设备
T6型新世纪紫外可见分光光度计,北京普析通用仪器有限公司;T25型高速分散机,德国IKA公司;FB-110Q型超高压均质机,上海励途机械设备工程有限公司;Zetasizer Nano-ZS型粒径电位仪,英国Malvern公司;LUMiFuge型全功能稳定分析仪,德国LUM公司;LSM 880型激光共聚焦显微镜,德国卡尔蔡司公司;SC-80型全自动色差仪,美国HunterLab公司;Sartorious BP221S型电子天平,德国Sartorious公司;pHS-3C型精密pH计,德国Sartorious公司;Hitachi Himac CR22g型高速冷冻离心机,日本日立株式会社;KQ-500DE型超声波清洗器,昆山市超声仪器有限公司。
1.3 试验方法
1.3.1ZDP乳液的制备
取定量ZDP标准品溶解于石油醚中,超声处理至完全溶解,于棕色瓶中充氮保存。在449 nm下测定ZDP溶液的吸光度,并通过其在石油醚中的摩尔吸光系数(ε449 nm=133 400 L/(mol·cm),确定其物质的量浓度[19]。取定量ZDP溶液,将其加入SO或MCT中,超声处理至混合均匀,氮吹至质量恒定,即为油相(质量分数2%);称取定量乳化剂于烧杯中,加入配制好的10 mmol/L磷酸盐缓冲溶液(pH值 7.0),搅拌至完全溶解,即得到水相(质量分数98%)。通过高速分散机制备粗乳液,在10 000 r/min下将油相缓慢加入到水相中,剪切2 min。将制得的粗乳液通过高压均质机制备乳液,均质压力60 MPa,循环3次,即得ZDP乳液,分装于小瓶中,4℃充氮避光保存。
1.3.2ZDP乳液制备参数的优化
(1)乳化剂种类:分别以SL、PGE18、PGE12、SE15、T80和WPI为乳化剂,以0.5%添加量,加入磷酸盐缓冲溶液为水相;在SO或MCT中添加400 nmol ZDP为油相,按照1.3.1节所述乳液制备方法制备ZDP乳液,测定不同乳化剂制备的ZDP乳液理化指标,选择适宜制备ZDP乳液的乳化剂。
(2)乳化剂质量分数:以PGE18为乳化剂,质量分数分别为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%,加入磷酸盐缓冲溶液制备水相,油相制备同上,测定不同乳化剂质量分数制备的ZDP乳液理化指标。
(3)ZDP添加量:以PGE18为乳化剂,质量分数为0.8%,加入磷酸盐缓冲溶液制备水相;在MCT中分别添加4、8、16、24、32、40 nmol/g的ZDP为油相,制备乳液并测定不同ZDP添加量制备的ZDP乳液理化指标。
1.3.3ZDP乳液的评价指标
(1)粒径、多分散系数(Polydispersity index,PdI)和zeta电位:采用Zetasizer Nano-ZS型粒径电位仪测定,基于动态光散射检测乳液粒径,基于电泳光散射检测zeta电位。PdI用以表征乳液粒径光强分布,PdI小于0.7时适宜于采用此法分析粒径。样品于测定前用10 mmol/L磷酸盐缓冲溶液稀释100倍,以减少多重光散射引起的测量误差。
(2)激光共聚焦显微镜观察:量取2 mL乳液,加入0.1 mL尼罗红染液(用无水乙醇配制质量浓度为1 mg/mL)用于脂肪染色,充分混匀。取适量染色后的乳液于干净的载玻片上,盖上盖玻片,观察并于60倍油镜下采集图像。
(3)稳定性分析:采用LUMiFuge型全功能稳定分析仪,通过离心加速的同时用近红外检测乳液透光率变化来快速测定乳液稳定性。将约0.8 mL乳液注入试管底部,设定温度25℃,转速4 000 r/min,每10 s采集一次样品透光率的特征曲线,共采集400次。
(4)ZDP保留率测定:取乳液3 mL,加入3 mL提取液(乙醇与正己烷体积比1∶2)提取3次,合并上层有机相,氮吹至干。将干提取物溶于3 mL石油醚中,振荡混匀,于449 nm下测定吸光度,通过摩尔吸光系数计算其含量。结果以ZDP保留率表示,即贮藏一段时间后乳液中ZDP含量占其原始含量百分比。
(5)颜色测定:采用全自动色差仪测定乳液颜色。将乳液盛于样品皿中,以标准白板为对照,在反射模式下测定其CIELAB三色值,即L*、a*、b*值。其中,L*表示亮度,L*=0表示黑色,L*=100表示白色;a*>0表示红色,a*<0表示绿色;b*>0表示黄色,b*<0表示蓝色。
1.3.4数据处理与分析
2 结果与分析
2.1 乳化剂种类对ZDP乳液的影响
选取4种合成乳化剂(PGE18、PGE12、SE15、T80)和2种天然乳化剂(SL和WPI)通过高压均质机制备ZDP乳液。图1为不同乳化剂制备的ZDP乳液的平均粒径和多分散系数。由图可知,天然乳化剂SL和WPI制备的ZDP乳液平均粒径(297.7~388.7 nm)显著大于合成乳化剂所制备的ZDP乳液平均粒径(184.8~306.3 nm)。在合成乳化剂中,PGE18和T80制备的ZDP乳液平均粒径(184.8~243.2 nm)显著(P<0.05)小于其他2种乳化剂PGE12和SE15(235.6~306.3 nm)。采用天然大分子乳化剂,如蛋白,制备的乳液粒径大,是由于其相对于小分子的非离子型乳化剂吸附速率低,在快速的高压均质时间内无法迅速吸附到油水界面起到快速乳化作用,同时,大分子乳化剂表面活性低,不能有效地降低界面张力[20-21]。MAO等[22]也发现使用小分子乳化剂(吐温20和PGE12)通过高压均质在不同均质压力下(20、80、140 MPa)制备的β-胡萝卜素乳液粒径(121.8~279.8 nm)均显著小于大分子乳化剂(辛烯基琥珀酸淀粉和WPI)制备的乳液(194.3~673.8 nm)。而SL虽然也是小分子乳化剂,但在本试验中乳化能力仍较差,可能是由于其较低的亲水亲油平衡(HLB)值,通常在7左右[23],明显低于其他4种小分子乳化剂HLB值13~15。

图1 乳化剂种类对ZDP乳液粒径和PdI的影响Fig.1 Effect of different emulsifiers on size and PdI of ZDP emulsions注:不同小写字母表示粒径(SO)差异显著;不同大写字母表示粒径(MCT)差异显著。
同时,不同的油脂来源(SO或MCT)对以不同乳化剂制备的ZDP乳液平均粒径影响不一致。对于PGE18和WPI制备的ZDP乳液,SO为油相的乳液平均粒径显著大于MCT为油相的乳液(P<0.05),而对于SL、PGE12和T80制备的乳液,SO为油相的乳液平均粒径则显著小于MCT为油相的乳液(P<0.05)。对于SE15乳化制备的ZDP乳液,油相为SO或MCT对其平均粒径无显著影响(P>0.05)。SALVIA-TRUJILLO等[24]发现采用不同比例长链甘油三酯(LCT)(玉米油)和MCT为油相制备β-胡萝卜素乳液时,随着LCT质量分数由0增加至100%,乳液平均粒径由146 nm增加至415 nm,并认为可能是由于LCT比MCT有更高的黏度,在高压均质时液滴不易被分散,从而形成了更大的粒径。上述研究中采用的乳化剂是吐温20,这与本试验中采用PGE18和WPI为乳化剂时得到的结果一致,与其他4种乳化剂结果不同。这可能是因为,除了油脂种类的影响外,乳化剂种类对乳液粒径也有较大的影响。乳液粒径是由乳化剂种类和浓度、油相种类和比例、乳化方法和条件(比如高压均质的压力和循环次数)等多种因素共同决定的。
不同乳化剂制备的ZDP乳液多分散系数(PdI)介于0.191~0.477之间,均小于0.7,颗粒分布均匀(图1)。其中,不论油相为SO或MCT,十聚甘油单脂肪酸酯(PGE18和PGE12)制备的ZDP乳液PdI均显著低于其他乳液(P<0.05)。

图3 不同乳化剂制备的ZDP乳液激光共聚焦显微镜图像Fig.3 Confocal laser scanning microscopy images of ZDP emulsions prepared by different emulsifiers

图2 乳化剂种类对ZDP乳液zeta电位的影响Fig.2 Effect of different emulsifiers on zeta-potential of ZDP emulsions注:不同小写字母表示zeta电位(SO)差异显著;不同大写字母表示zeta电位(MCT)差异显著。
zeta电位反映了胶体体系中的界面动电势,zeta电位的绝对值越高,表明体系稳定性越高,这是由于液滴间的强静电斥力能阻止其聚集[25]。图2为不同乳化剂制备的ZDP乳液zeta电位。SL和SE15乳化的ZDP乳液液滴带有较高的负电荷(-28.4~-25.4 mV),PGE18、PGE12和WPI居中(-17.3~-9.6 mV),而T80乳化的液滴带有最少的负电荷(-5.0 mV)。SL为阴离子型乳化剂因而乳液液滴带负电荷,WPI制备的乳液因体系pH值大于其蛋白等电点而带负电荷,但是,其他4种乳化剂均为非离子型乳化剂,理论上应不带电荷。YIN等[26]也发现吐温20、PGE12和蔗糖酯制备的β-胡萝卜素纳米分散体液滴带有负电荷,其zeta电位分别为-8.2、-17.6、-30.9 mV。ANARJAN等[27]的研究也表明吐温系列和蔗糖酯系列乳化剂制备的虾青素纳米分散体zeta电位为负值(-30.0~-14.1 mV)。这可能是由于在中性条件下水中的OH-选择性吸附到油水界面上,或者是在乳化剂产品或油相中存在一些阴离子杂质,比如游离脂肪酸[28]。
图3为不同乳化剂制备的ZDP乳液微观结构,使用尼罗红对脂滴染色,并通过激光共聚焦观察采集图像。由图可以看出,不同乳化剂制备的乳液粒径与Zetasizer Nano-ZS型粒径电位仪测得的乳液平均粒径和粒径分布结果基本一致。SL和SE15乳化的乳液粒径较大,且粒径大小分布不均匀,这与其PdI较大(SO: 0.477、0.419;MCT:0.296、0.369)的结果也相符,并且在乳液观察过程中出现了一定的聚结或絮凝现象。WPI乳化的乳液虽然粒径较大,但是颗粒大小分布均匀,其PdI(SO: 0.385; MCT: 0.262)也小于SL和SE15。从激光共聚焦图像上看WPI乳化的乳液颗粒粒径较小可能是因为乳液颗粒外层为大分子蛋白,核心为脂滴,而本试验中只使用尼罗红给脂滴染色,外层蛋白质不可见。PGE18、PGE12和T80制备的ZDP乳液平均粒径较小,但T80制备的乳液颗粒分布大小不一,也验证了其较高的PdI值(SO: 0.388; MCT: 0.392),高于PGE18和PGE12(SO: 0.298、0.247;MCT:0.191、0.211)。
本试验应用LUMiFuge型全功能稳定分析仪来测定不同乳液的物理稳定性,结果如图4所示,纵坐标为乳液离心过程中特定位置在不同时间的透光率,横坐标为样品与离心轴的距离。透光率变化越小,说明乳液越稳定。对于以SO为油相制备的ZDP乳液,PGE18和PGE12为乳化剂的乳液具有较好的物理稳定性,在图中表现为离心过程中透光率变化较小。对于以MCT为油相制备的ZDP乳液,所有乳化剂均表现出了较SO为油相时更好的物理稳定性。其中,PGE18和PGE12较其他几种乳化剂又呈现显著较小的透光率变化。因此,PGE18和PGE12为乳化剂时,不论油相为SO或MCT,ZDP乳液均呈现出较好的物理稳定性。

图4 不同乳化剂制备的ZDP乳液LUMiFuge分析图Fig.4 Transmission profiles of ZDP emulsions prepared by different emulsifiers
为考察不同乳化剂制备的ZDP乳液化学稳定性,分别测定了不同乳液在4℃避光贮藏14 d和28 d后ZDP保留率的变化,结果如图5所示。贮藏14 d后,不同乳化剂制备的乳液中仍保留84.4%~93.3%的ZDP,而当贮藏28 d后,不同乳化剂制备的乳液中ZDP保留率出现显著差别(58.5%~90.8%)。相比于以SO为油相(图5a),以MCT为油相时(图5b)乳液中ZDP降解较慢,除T80为乳化剂外(61.4%),28 d后乳液中仍保留80%以上的ZDP。然而,以SO为油相制备的ZDP乳液中,SL、PGE18和PGE12为乳化剂制备的乳液仍保留80%以上的ZDP,而SE15、T80和WPI只分别保留64.4%、71.2%和58.5%的ZDP。肉眼观察贮藏28 d后的不同ZDP乳液,可以发现MCT制备的不同乳液中,除SL、SE15和WPI乳化制备的乳液有轻微上浮现象和T80乳化的乳液液面有些许油滴析出外,其余未见明显变化。然而,以SO为油相制备的各不同乳液均出现上浮现象,其中SE15和WPI乳化制备的乳液出现明显分层,SL和T80制备的乳液出现轻微分层和少量油滴析出,而PGE18和PGE12制备的乳液仅出现些许油滴析出,表现出了较好的贮藏稳定性。
游学产业链初步形成,管理日趋规范。游学产业属于教育和旅游的交叉行业,主要通过校外教育、教育旅游、户外活动、亲子体验、研学修学、人文旅行、社会实践、营地教育等形式,有针对性地向学生群体提供教育服务产品。从现有市场数据分析,60%~70%的份额由国内外合作学校直接对接而形成,20%被中介机构及教育培训机构的假期游学项目占据,通过旅行社组织的占15%,另外,这几年纯游学产品网络平台正在兴起。
综上所述,不管是以SO还是MCT为油相,小分子乳化剂PGE18乳化制备的ZDP乳液均具有较小的平均粒径(184.8~219.1 nm),且粒径分布均匀,以及具有较好的物理稳定性和化学稳定性。因此,本试验选用PGE18作为乳化剂制备ZDP乳液。
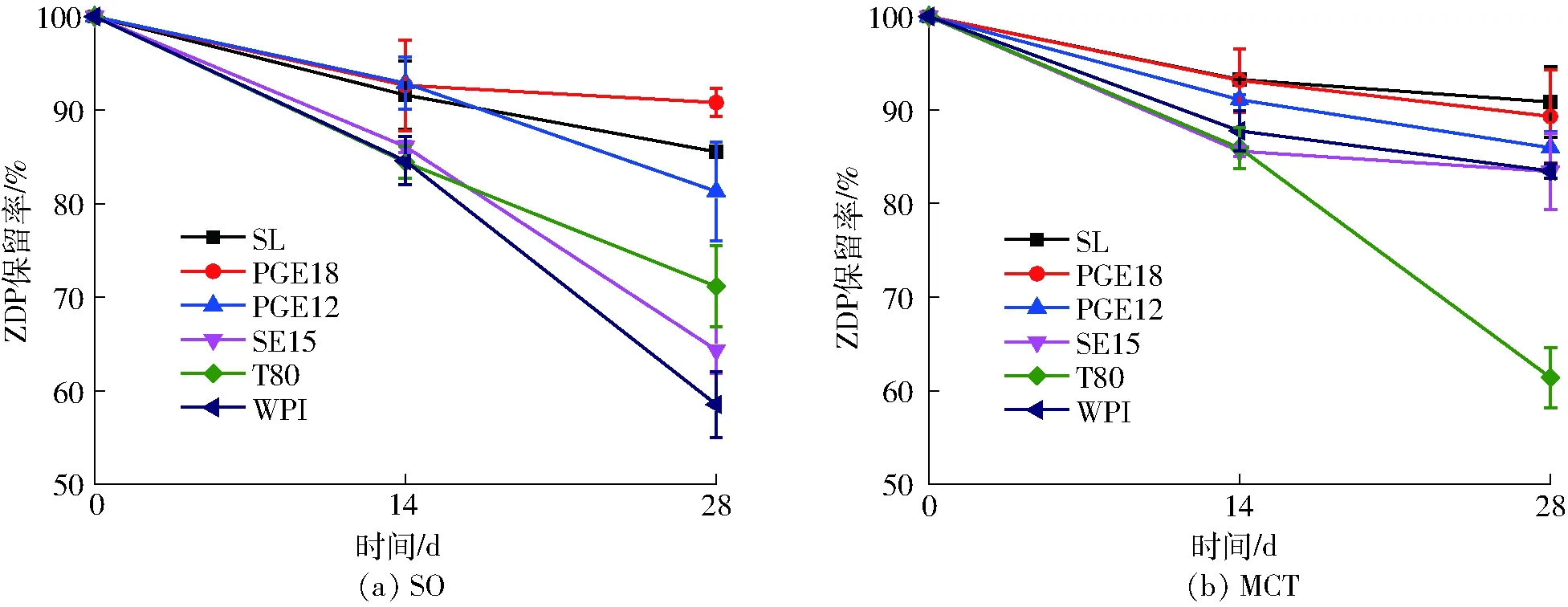
图5 ZDP乳液在贮藏过程中ZDP保留率的变化Fig.5 Degradation of ZDP in different emulsions during storage at 4℃
2.2 乳化剂质量分数对ZDP乳液的影响
乳化剂质量分数是乳液制备中需要考虑的一个重要因素。当乳化剂质量分数过低时,乳化剂无法充分覆盖液滴表面,容易引起液滴聚集或分层现象,而乳化剂质量分数过高时又会造成浪费,提高成本,且不利于乳液的稳定[29]。因此,采用不同质量分数的PGE18为乳化剂,分别以SO或MCT为油相,高压均质制备ZDP乳液,以找到适宜的乳化剂质量分数。由图6可以看出,随着乳化剂质量分数的增加,ZDP乳液的平均粒径和PdI逐渐减小,且在质量分数为0.8%时达到最小值(SO:200.2 nm;MCT:177.7 nm)。进一步增加乳化剂质量分数至1.0%,以SO为油相的乳液粒径大小和分布无显著变化。继续增加乳化剂质量分数至1.2%,ZDP乳液粒径大小显著增加,粒径分布不均匀(PdI增加)。

图6 乳化剂质量分数对ZDP乳液粒径和PdI的影响Fig.6 Effect of different PGE18 concentrations on size and PdI of ZDP emulsions注:不同小写字母表示粒径(SO)差异显著;不同大写字母表示粒径(MCT)差异显著。

图7 乳化剂质量分数对ZDP乳液zeta电位的影响Fig.7 Effect of different PGE18 concentrations on zeta-potential of ZDP emulsions注:以SO为油相制备的不同乳化剂质量分数的ZDP乳液zeta电位无显著差异;不同大写字母表示zeta电位(MCT)差异显著。
对于zeta电位的变化,乳化剂质量分数对SO为油相的ZDP乳液无明显影响,对于以MCT为油相的ZDP乳液,随着乳化剂质量分数的增加,zeta电位绝对值逐渐增加,在乳化剂质量分数为0.6%时达到最高值,之后再增加乳化剂质量分数无显著变化(图7)。因此,本试验选用质量分数为0.8%的PGE18作为乳化剂,MCT为油相来制备ZDP乳液,贮藏试验结果表明4℃贮藏28 d ZDP保留率高达90%。
2.3 ZDP添加量对ZDP乳液的影响
ZDP在人体消化系统内可水解为玉米黄素单体和两分子棕榈酸,玉米黄素在小肠上皮细胞吸收进入血液循环系统并发挥其在人体视觉和大脑中的重要作用[30]。尽管大量研究表明每天定量摄入玉米黄素和叶黄素的益处,但至今仍未有机构给出玉米黄素的可耐受最高摄入量。欧洲食品安全局(EFSA)根据大鼠试验结果除以200倍安全因子给出的日允许摄入量(Acceptable daily intake,ADI)为0.75 mg/(kg·d)或53 mg/d(70 kg成人)[31]。基于VAN DE KRAATS等[32]进行的人体试验研究表明连续6个月摄入玉米黄素20 mg/d对人体无副作用,因此本试验在4 nmol/g乳液的基础上,逐步增加ZDP在乳液中的添加量(摩尔质量浓度)至40 nmol/g,即每500 mL乳液中含约20 mg ZDP。
以质量分数为0.8%的PGE18为乳化剂,以MCT为油相,添加不同量的ZDP制备乳液,试验结果如表1所示。可以看出,随着ZDP添加量的增加,乳液平均粒径逐渐增大,但除ZDP添加量4 nmol/g和40 nmol/g时有显著差异(P<0.05),其余各添加量并无显著差异。并且,不同ZDP添加量的乳液zeta电位并无显著差异(P>0.05)。

表1 不同ZDP添加量乳液的粒径、PdI和zeta电位Tab.1 Size, PdI, and zeta-potential of emulsions with different concentrations of ZDP
图8为不同ZDP添加量的乳液的颜色变化图像(从左到右ZDP添加量增大)和CIELAB三色值。由图像可以看出,随着ZDP添加量的增加,乳液的颜色由淡黄色逐渐变深至橙黄色。与图像一致,随着ZDP添加量的增加,乳液的亮度值L*逐渐降低,而红绿值a*和黄蓝值b*逐渐显著增加(P<0.05)。因此,ZDP乳液除了作为功能乳饮料外,还有作为天然的食用色素使用的潜力。
3 结论
(1)选用不同乳化剂通过高压均质制备ZDP乳液,结果表明乳化剂种类对ZDP乳液粒径、电位、物理稳定性和贮藏稳定性有显著影响。天然乳化剂SL和WPI制备的ZDP乳液平均粒径大,且稳定性一般。小分子乳化剂中T80制备的乳液虽然平均粒径小,但贮藏稳定性较差。PGE18制备的ZDP乳液平均粒径小,分布均匀,且物理稳定性和贮藏稳定性好,为制备ZDP乳液的较佳乳化剂。
(2)油相种类(SO和MCT)对ZDP乳液粒径、PdI和稳定性均有影响,对乳液电位无明显影响。以MCT为油相制备的ZDP乳液,相比以SO为油相制备的乳液在快速稳定性和贮藏稳定性上有显著优势,但以T80为乳化剂时例外。
(3)乳化剂质量分数对ZDP乳液粒径、PdI和电位有显著影响。以PGE18为乳化剂,质量分数为0.8%时,制得的乳液粒径小,分布均匀,zeta电位绝对值高。
(4)以质量分数为0.8%的PGE18为乳化剂,以MCT为油相,所制得的ZDP乳液平均粒径小,分布均匀,物理稳定性和贮藏稳定性好。并且,增加ZDP添加量至40 nmol/g乳液仍能制得粒径小于200 nm、分布均匀和较为稳定的ZDP乳液。
1 惠伯棣.类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社, 2005.
2 BONE R A, LANDRUM J T, TARSIS S L. Preliminary identification of the human macular pigment[J]. Vision Research, 1985, 25(11): 1531-1535.
3 刘美宏, 刘回民, 郑明珠, 等. 玉米黄素生物活性及其在食品中应用研究进展[J]. 食品工业, 2016(12): 242-248.
LIU Meihong, LIU Huimin, ZHENG Mingzhu, et al. Research progress on bioactivities of zeaxanthin and its application in foods[J]. The Food Industry, 2016(12): 242-248.(in Chinese)
4 蔡靳, 惠伯棣, 蒋继志. 玉米黄素及在食品中的应用研究进展[J]. 中国食品添加剂, 2012(3): 200-207.
CAI Jin, HUI Bodi, JIANG Jizhi. Progress on research in zeaxanthin and its application in foods[J]. China Food Additives, 2012(3): 200-207.(in Chinese)
6 WEN X, HEMPEL J, SCHWEIGGERT R M, et al. Carotenoids and carotenoid esters of red and yellowPhysalis(PhysalisalkekengiL. andP.pubescensL.) fruits and calyces[J]. Journal of Agricultural and Food Chemistry, 2017, 65(30): 6140-6151.
7 AHMAD F T, ASENSTORFER R E, SORIANO I R, et al. Effect of temperature on lutein esterification and lutein stability in wheat grain[J]. Journal of Cereal Science, 2013, 58(3): 408-413.
8 MELLADO-ORTEGA E, HOMERO-MÉNDEZ D. Effect of long-term storage on the free and esterified carotenoids in durum wheat (Triticumturgidumconv.durum) and tritordeum (×TritordeumAscherson et Graebner) grains[J]. Food Research International, 2017, 99(2): 877-890.
9 SCHWEIGGERT U, KURZ C, SCHIEBER A, et al. Effects of processing and storage on the stability of free and esterified carotenoids of red peppers (CapsicumannuumL.) and hot chilli peppers (CapsicumfrutescensL.)[J]. European Food Research and Technology, 2007, 225(2): 261-270.
10 SUBAGIO A, MORITA N. Prooxidant activity of lutein and its dimyristate esters in corn triacylglyceride[J]. Food Chemistry, 2003, 81(1): 97-102.
11 SOUKOULIS C, BOHN T. A comprehensive overview on the micro- and nano-technological encapsulation advances for enhancing the chemical stability and bioavailability of carotenoids[J]. Critical Reviews in Food Science and Nutrition, 2018, 58: 1-36.
12 MCCLEMENTS D J, RAO J. Food-grade nanoemulsions: formulation, fabrication, properties, performance, biological fate, and potential toxicity[J]. Critical Reviews in Food Science and Nutrition, 2011, 51: 285-330.
13 WEIGEL F, WEISS J, DECKER E A, et al. Lutein-enriched emulsion-based delivery systems: influence of emulsifiers and antioxidants on physical and chemical stability[J]. Food Chemistry, 2018, 242: 395-403.
14 KHALIL M, RAILA J, ALI M, et al. Stability and bioavailability of lutein ester supplements from Tagetes flower prepared under food processing conditions[J]. Journal of Functional Foods, 2012, 4(3): 602-610.
15 FREDE K, HENZE A, KHALIL M, et al. Stability and cellular uptake of lutein-loaded emulsions[J]. Journal of Functional Foods, 2014, 8: 118-127.
16 DAVIDOV-PARDO G, GUMUS C E, MCCLEMENTS D J. Lutein-enriched emulsion-based delivery systems: influence of pH and temperature on physical and chemical stability[J]. Food Chemistry, 2016, 196: 821-827.
17 GUMUS C E, DAVIDOV-PARDO G, MCCLEMENTS D J. Lutein-enriched emulsion-based delivery systems: impact of Maillard conjugation on physicochemical stability and gastrointestinal fate[J]. Food Hydrocolloids, 2016, 60: 38-49.
18 米佳, 禄璐, 罗青, 等. 枸杞玉米黄素双棕榈酸酯脂质体的制备及其体外抗氧化活性研究[J/OL]. 食品工业科技: 1-12[2018-04-08]. http:∥kns.cnki.net/kcms/detail/11.1759.TS.20180308.1434.030.html.
MI Jia, LU Lu, LUO Qing, et al. Preparation andinvitroantioxidant activity determination ofLyciumbarbarumL. zeaxanthin dipalmitate liposome[J]. Science and Technology of Food Industry: 1-12[2018-04-08].(in Chinese)
19 BRITTON G. Carotenoids. Spectroscopy [M]. vol. 1B. Basel, Boston, Berlin: Birkhäuser Verlag, 1995: 13-62.
20 STANG M, KARBSTEIN H, SCHUBERT H. Adsorption kinetics of emulsifiers at oil-water interfaces and their effect on mechanical emulsification[J]. Chemical Engineering and Processing: Process Intensification, 1994, 33: 307-311.
21 KARBSTEIN H, SCHUBERT H. Developments in the continuous mechanical production of oil-in-water macro-emulsions[J]. Chemical Engineering and Processing: Process Intensification, 1995, 34: 205-211.
22 MAO L, YANG J, XU D, et al. Effects of homogenization models and emulsifiers on the physicochemical properties of β-carotene nanoemulsions[J]. Journal of Dispersion Science and Technology, 2010, 31: 986-993.
23 MCCLEMENTS D J, BAI L, CHUNG C. Recent advances in the utilization of natural emulsifiers to form and stabilize emulsions[J]. Annual Review of Food Science and Technology, 2017,8(1): 205-236.
24 SALVIA-TRUJILLO L, QIAN C, MARTIN-BELLOSO O, et al. Modulating β-carotene bioaccessibility by controlling oil composition and concentration in edible nanoemulsions[J]. Food Chemistry, 2013, 139(1-4): 878-884.
25 丁俭, 齐宝坤, 姜楠, 等. 超声处理大豆分离蛋白-壳聚糖复合物结构性质研究[J/OL].农业机械学报, 2017,48(9):352-358.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20170945&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2017.09.045.
DING Jian,QI Baokun,JIANG Nan, et al.Structural properties of soybean protein isolate-chitosan complex treated by ultrasonic[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2017,48(9):352-358.(in Chinese)
26 YIN L J, CHU B S, KOBAYASHI I, et al. Performance of selected emulsifiers and their combinations in the preparation of β-carotene nanodispersions[J]. Food Hydrocolloids, 2009, 23(6): 1617-1622.
27 ANARJAN N, TAN C P. Effects of selected polysorbate and sucrose ester emulsifiers on the physicochemical properties of astaxanthin nanodispersions[J]. Molecules, 2013, 18(1): 768-777.
28 MCCLEMENTS D J. Food emulsions: principles, practices, and techniques[M]. Boca Raton: CRC Press, 2005.
29 刘夫国, 王迪, 杨伟, 等. 乳铁蛋白-多酚对β-胡萝卜素乳液稳定性的影响[J/OL]. 农业机械学报, 2015, 46(6):212-217.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20150630&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2015.06.030.
LIU Fuguo, WANG Di, YANG Wei, et al. Effect of lactoferrin-polyphenol conjugates on stability of β-carotene emulsions[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(6): 212-217.(in Chinese)
30 SAJILATA M G, SINGHAL R S, KAMAT M Y. The carotenoid pigment zeaxanthin—a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2008, 7(1): 29-49.
31 EDWARDS J A. Zeaxanthin: review of toxicological data and acceptable daily intake[J]. Journal of Ophthalmology, 2016, 2016: 1-15.
32 VAN DE KRAATS J, KANIS M J, GENDERS S W, et al. Lutein and zeaxanthin measured separately in the living human retina with fundus reflectometry[J]. Investigative Ophthalmology and Visual Science, 2008, 49(12): 5568-5573.
