组织蛋白酶S水平与慢性阻塞性肺疾病严重程度及CT表型的关系
2018-07-05李耕谊殷少军柳毅李虹宋爽孔志斌左晟刘华朱珍
李耕谊 殷少军 柳毅 李虹 宋爽 孔志斌 左晟 刘华 朱珍
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)特征性的病理学改变存在于气道、肺实质和肺血管。在外周气道内,慢性炎症反应导致气道壁损伤和修复的过程反复发生。修复过程导致气道壁结构重塑,胶原含量增加及瘢痕组织形成,这些病理改变造成气道狭窄,引起固定性气道阻塞[1-2]。FEV1占预计值%的变化和包括急性发作频率等各种临床参数是目前最常用的评估COPD严重程度和疗效的终点指标,但这些参数有局限性,无法在短时间内观察到明显的动态变化。近年来研究显示,组织蛋白酶S作为一种蛋白酶可促进COPD肺气肿发生和小气道重塑,参与COPD的发生发展[3-4]。本文旨在探讨血浆组织蛋白酶S是否与COPD严重程度存在关联,及是否可作为评估COPD表型尤其是影像学表型的潜在生物标志物,对临床COPD的治疗起到重要的指导意义[5-6]。
对象与方法
一、研究对象
选择2015年6月至2017年5月在我院呼吸内科门诊随诊的COPD稳定期患者361例,其中男268例,年龄(65.1±10.8)岁,女93例,年龄(66.2±11.1)岁。根据中华医学会呼吸病学分会制定的“慢性阻塞性肺疾病诊治指南(2013年修订版)”综合评估分组标准,将入选患者分为4组:A组:mMRC<2级、FEV1占预计值%≥50%且近一年急性加重次数<2次;B组:mMRC≥2级、FEV1占预计值%≥50%且近一年急性加重次数<2次;C组:mMRC <2级、FEV1占预计值%<50%或近一年急性加重次数≥2次;D组:mMRC≥2级、FEV1占预计值%<50%或近一年急性加重次数≥2次。肺功能评估的风险与急性加重评估的风险结果不一致时,以最高风险为准。同时纳入健康对照组196例,均为同期肺功能正常的健康体检者,其中男147例,平均年龄(65.8±10.4)岁;女49例,平均年龄(66.9±11.6)岁。本研究经上海第六人民医院临床伦理委员会审核批准,研究对象均签署知情同意书。
患者纳入标准:①需符慢性阻塞性肺疾病(2013年修订版)的诊断标准:除外其他疾病,吸入支气管扩张剂后1 s用力呼气容积/用力肺活量%(forced expiratory volume in onesecond/forced vital capacity, FEV1/FVC)<70%;②近2个月内均处于临床稳定期:咳嗽、咳痰和呼吸困难无明显加重者为稳定期;③接受正规治疗;④3个月内吸入药物剂型剂量维持不变;⑤3个月内未使用抗生素。排除标准:①口服糖皮质激素者;②合并支气管扩张症、支气管哮喘、肺间质纤维化和肺部恶性肿瘤等除COPD以外的肺部疾病;③合并糖尿病、肥胖等代谢性疾病;④合并心功能不全、高血压、动脉粥样硬化等心血管或脑部疾病;⑤合并慢性肾脏疾病。
二、研究方法
采用改良版英国医学研究委员会呼吸问卷(modified British Medical Reseach Council, mMRC) 进行呼吸困难评分或采用慢阻肺患者自我评估测试(COPD assessment test, CAT)问卷进行评估,记录过去1年急性加重次数。测量所有研究对象的血压、身高、体质量,计算体质量指数(body mass index,BMI)。
血糖、血脂和肌酐测定使用酶法,糖化血红蛋白用高压液相法。估算的肾小球滤过率(estimated glomerular filtration rate, eGFR)应用慢性肾脏病流行病学合作研究(chronic kidney disease epidemiology collaboration, CKD-EPI)公式计算[7]:女性:Scr≤62 μmol/L,eGFR=144×(Scr/62)-0.329×(0.993)年龄;Scr>62 μmol/L,eGFR=144×(Scr/62)-1.209×(0.993)年龄。男性:Scr≤80 μmol/L,eGFR=141×(Scr/80)-0.411×(0.993)年龄;Scr>80 μmol/L,eGFR=141×(Scr/80)-1.209×(0.993)年龄。GFR变化率通过以下的公式计算:(研究结束时的eGFR-基线eGFR)/(基线eGFR×随访时间)。所有研究对象在入选当天整夜禁食,次日清晨静卧位,采集外周静脉血10 ml,肝素抗凝,以离心半径8 cm,3 000 r/min离心5 min,分离血浆,-80 ℃冰箱储存备检。采用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒(美国R&D公司,明尼阿波利斯,明尼苏达州,美国)测定血浆总组织蛋白酶S浓度。试剂盒测定组织蛋白酶S的检测下限为15.6 pg/ml。
肺功能检测采用瑞士席勒Spirovit SP-1肺功能仪检查肺功能。记录主要指标包括FEV1/FVC、FEV1占预计值%、DLCO、 RV/TLC。
所有研究对象接受美国GE公司胸部高分辨率CT(high-resolution computed tomography, HRCT)检查,分别在吸气末憋气和呼气末憋气连续扫描主动脉弓、气管隆突上1 cm、隆突下1 cm、右肺静脉下1 cm和右膈膜上2 cm。
肺气肿程度评估:在GE软件Thoracic VCAR中,设置CT值<950 HU为低密度区,即为肺气肿,自动辨识并定量低衰减区域(low attenuation area, LAA)并计算其占全肺体积的百分比(LAA%),即肺气肿指数。根据Kitaguch方法进行LAA分级[8]:首先计算各层面的LAA评分:0分:LAA<5%,1分:5%≤LAA<25%,2分:25%≤LAA<50%,3分:50%≤LAA<75%,4分:LAA>75%。将主动脉弓、气管隆突下1 cm、右膈膜上2 cm这3个解剖层面6个视野评分相加评估肺气肿总和:0级:0分,1级:1~6分,2级:7~12分,3级13~18,4级19~24分;
气道管壁厚度的测定:管开口处三维重建支气管模型,软件自动求得2倍气道壁厚度与气道直径比(2 times the ratio of airway wall thickness to outer diameter, 2T/D)、管壁面积占总横截面积比(ratio of wall area to total airway area, WA)。检查由2名放射科主治医师采用盲法独立进行,并由1名放射科主任医师审核,然后取平均值。
三、统计学方法
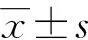
结 果
一、患者临床资料
各组对象的性别、年龄、吸烟指数、BMI和血压等一般状况无显著差异(P>0.05)。各组间的生化指标包括尿素氮、血肌酐、eGFR、空腹血糖、糖化血红蛋白等差异无统计学意义(P>0.05),见表1。
二、组织蛋白酶S水平
COPD患者A、B、C、D四组的组织蛋白酶水平分别为(20.1±10.1)ng/ml、(27.9±9.8)ng/ml、(35.2±11.3)ng/ml、(41.9±11.7)ng/ml,均显著高于对照组(6.4±3.6)ng/ml(P<0.01);COPD患者A、B、C、D四组间组织蛋白酶水平均有显著差异(P<0.01)。
三、肺功能及CT影像学
各组对象肺功能指标包括FEV1/FVC、FEV1占预计值%、肺一氧化碳弥散量(diffusion of the lungs for carbon monoxide, DLCO)、残气容积/肺总量(residual volume/total lung capacity, RV/TLC)均存在显著差异(P<0.01),且与对照组相比,A、B、C、D各组患者的FEV1/FVC、FEV1占预计值%和DLCO的水平均显著降低,而RV/TLC的水平较对照组显著升高(P<0.05);各组研究对象HRCT参数包括LAA%、2T/D和WA的水平均存在显著统计学差异(P<0.01),且与对照组相比,A、B、C、D各组患者的LAA%、2T/D和WA的水平显著增加(P<0.05),见表2。
四、不同气流受限程度及肺气肿程度患者组织蛋白酶S的水平
GOLD Ⅰ级-GOLD Ⅳ级的组织蛋白酶S水平分别为(21.9±11.5) ng/ml、(25.6±10.3) ng/ml、(33.5±11.1)ng/ml、(39.8±10.6)ng/ml,不同GOLD分级的组织蛋白酶S水平差异显著(P<0.01),提示随着气流受限程度的增加,组织蛋白酶S的水平显著升高。LAA 0级-LAA 3级的组织蛋白酶S水平分别为LAA 3级(22.6±10.7)ng/ml、(30.1±9.7)ng/ml、(33.8±11.0)ng/ml、 (42.5±12.4)ng/ml,不同LAA分级的组织蛋白酶S水平差异显著(P<0.01),提示肺气肿越明显,组织蛋白酶S水平越高。
五、相关性及回归分析
COPD患者的组织蛋白酶S水平与FEV1/FVC(r=-0.667)、FEV1占预计值%(r=-0.591)呈显著负相关,与LAA%(r=0.483)、2T/D(r=0.72)和WA(r=0.549)呈显著正相关(P<0.05)。将所有观测变量引入Logistic回归模型,采用多元逐步回归方法筛选严重气流受限和重度肺气肿发生的独立危险因子。以性别(男=1,女=0),年龄(大于等于60岁=1,小于60岁=0),组织蛋白酶S、尿素氮、肌酐、eGFR、空腹血糖、糖化血红蛋白等指标作为自变量(X),将是否患有严重气流受限(FEV1占预计值%<50%)作为因变量Y(患病=1,未患病=0),另一方面,将是否患有重度肺气肿改变(LAA %≥15%)作为因变量Y(患病=1,未患病=0)。回归分析提示,组织蛋白酶S、年龄为严重气流受限的独立危险因子[P=0.0493,比值比(OR)=3.06, 95%可信区间(95%CI) 1.5~6.8;P=0.0137,OR=4.56, 95%CI1.7~7.9]。同时,组织蛋白酶S(P=0.0147,OR=8.41, 95%CI0.9~26.4)也是重度肺气肿发生的独立危险因子。
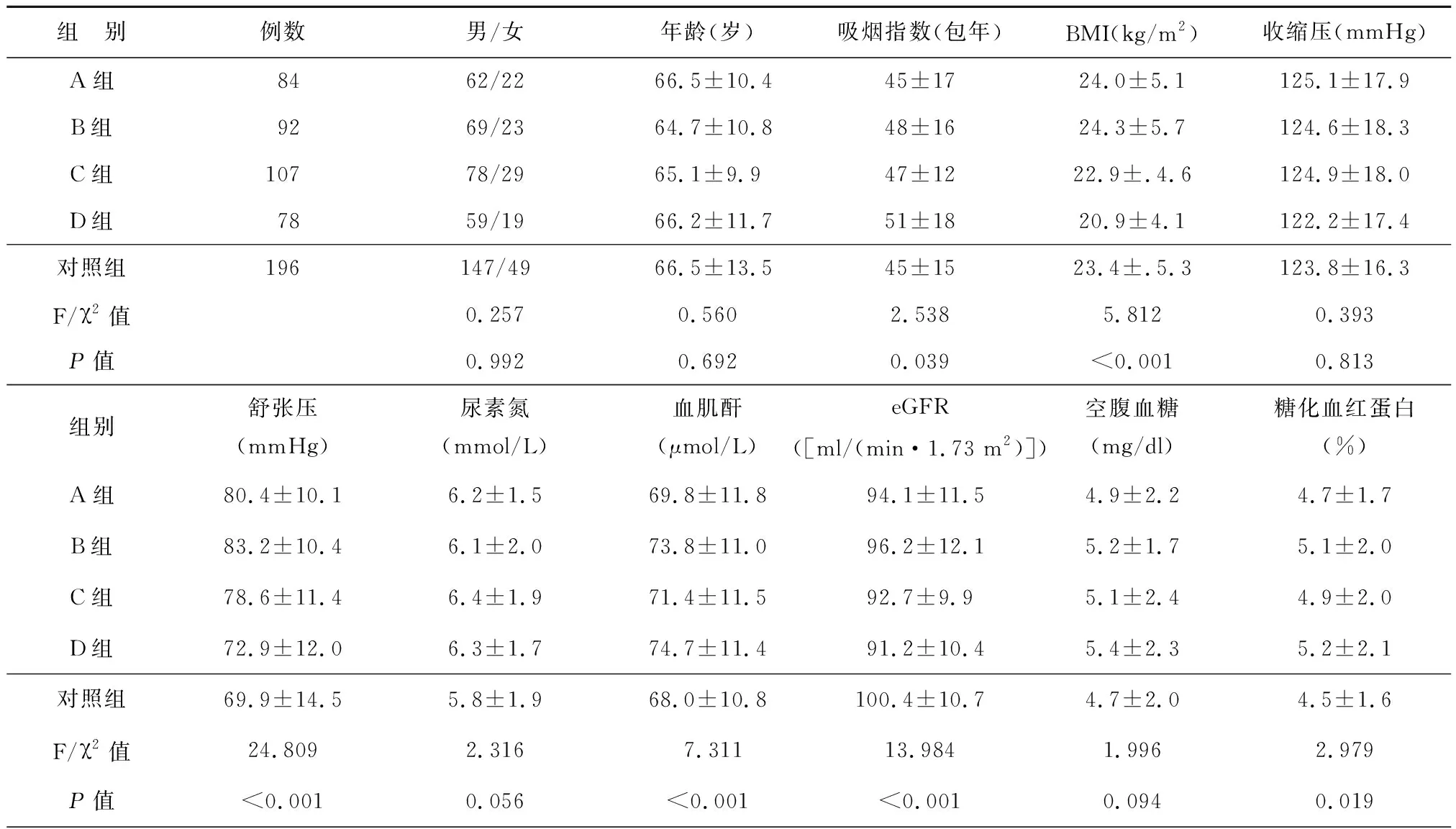
表1 各组患者临床一般资料
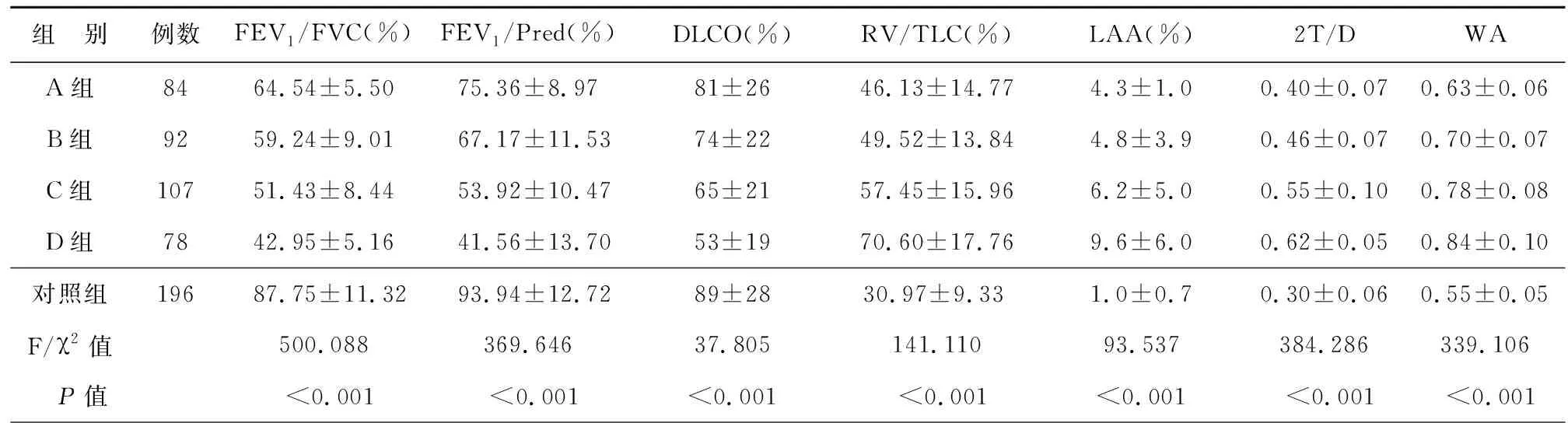
表2 各组肺功能及HRCT影像学参数比较
讨 论
COPD的发病机制尚未完全明了,近期研究已识别到一些潜在作为新型治疗靶点的分子和信号通路[9-10]。蛋白酶是其中一种,已经证实肺内蛋白酶和抗蛋白酶失衡可导致肺气肿的发展。中性粒细胞弹性蛋白酶、基质金属蛋白酶、半胱氨酸蛋白酶等蛋白酶也可促进COPD肺气肿发生和小气道重塑[11-12]。组织蛋白酶S是半胱氨酸蛋白酶家族的一员,人体组织蛋白酶S最早从肺泡巨噬细胞中提取到,主要分布在淋巴结、脾脏、肺等器官,广泛分布于巨噬细胞和树状突细胞等参与COPD发病机制的主要细胞内的溶酶体酸性蛋白酶中,其可有效降解弹性蛋白的蛋白酶,也参与适应性免疫反应,在抗原递呈中发挥重要作用。组织蛋白酶S可驱动MHC Ⅱ介导的T细胞活化,后者分泌INF-γ可激活巨噬细胞、趋化炎症因子集聚致肺损伤部位,提升肺内氧化应激状态,从而分泌大量蛋白水解酶[13-14]。
COPD患者支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)组织蛋白酶S水平和活性显著升高,其升高原因可能与COPD患者自身免疫反应相关[15]。有报道认为慢性阻塞性肺病是一种自身免疫性疾病,抗弹力蛋白、肺上皮细胞抗体、内皮细胞抗体在疾病的进展中起到作用,尤其是在严重疾病的患者中[16]。过度表达IL-13和IFN-γ的转基因小鼠,其BALF中组织蛋白酶S增高,更易出现肺部炎症,同时更容易出现肺部结构破坏而导致肺气肿[17-18]。在过度表达IFN-γ的转基因小鼠中,组织蛋白酶S可通过促进上皮细胞凋亡,导致气道扩张,加速肺气肿的发展[19]。Geraghty等[15]的研究已表明IFN-γ诱导巨噬细胞表达组织蛋白酶S可能有助于促进COPD的发展。本研究提示,与健康对照组相比,COPD患者血浆组织蛋白酶S水平显著升高,提示组织蛋白酶S与COPD发病可能相关;且根据COPD综合评估分组,COPD病情越严重,组织蛋白酶S水平越高,提示组织蛋白酶S与综合评估分组的病情相关;本研究对COPD患者血浆组织蛋白酶S水平与患者气流受限程度(FEV1/FVC、FEV1占预计值)、低衰减区域(LAA)、气道壁厚度(2T/D、WA)等指标进行相关分析,结果提示组织蛋白酶S水平与气流受限、肺气肿、气道重塑相关,且可能参与其发病机制;进一步的多元回归分析提示,组织蛋白酶S不仅为严重气流受限(FEV1占预计值%<50%)的独立危险因子,同时也是重度肺气肿(LAA%≥15%)发生的独立危险因子,进一步证实了组织蛋白酶S与COPD发病和病情进展有关,表明其参与COPD气流受限、肺气肿、气道重塑的形成。Nakajima等[4]对COPD患者血浆组织蛋白酶S进行研究,发现COPD患者血浆组织蛋白酶S水平与患者气流受限程度和肺气肿程度相关,与本研究结果相一致,并且本研究还测定了组织蛋白酶S水平与气道壁厚度的相关性,提示组织蛋白酶S在COPD气道重塑中可能起到一定的作用。
综上所述,本文结果显示血浆组织蛋白酶与COPD综合评估的病情严重程度和CT评估的肺气肿及其他协变量相关,提示可将组织蛋白酶S作为COPD的表型标志物,其对COPD的个体化治疗及疗效监测存在潜在的指导意义。本文尚存在一定的局限性:①血浆组织蛋白酶S,无法确定其活化程度以及其来源;②组织蛋白酶S受血肌酐、血糖、血压、年龄、激素用药情况等多种因素影响,研究设计方案有待改进与细化来规避这些混淆因素的干扰;③有必要对诱导痰或支气管肺泡灌洗液中组织蛋白酶S水平进行检测,明确气道局部组织蛋白酶S的分泌情况;④有必要进一步探讨血浆组织蛋白酶S与COPD患者气道炎症因子或气道重塑相关因子的关系,深入研究组织蛋白酶S在COPD发生发展中的作用机制。
参 考 文 献
1 任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志(电子版), 2009, 2(2): 104-115.
2 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版) [J]. 中华结核和呼吸杂志, 2013, 36(4): 67-80.
3 Reddy AT, Lakshmi SP, Muchumarri RR, et al. Nitrated Fatty Acids Reverse Cigarette Smoke-Induced Alveolar Macrophage Activation and Inhibit Protease Activity via Electrophilic S-Alkylation[J]. PLoS One, 2016, 11(4): e0153336.
4 Nakajima T, Nakamura H, Owen CA, et al. Plasma Cathepsin S and Cathepsin S/Cystatin C Ratios Are Potential Biomarkers for COPD[J]. Dis Markers, 2016, 2016: 4093870.
5 曾天星, 洪旭初. 慢性阻塞性肺疾病的表型及治疗[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(2): 216-219.
6 黄宇婷, 刘翱. 慢性阻塞性肺疾病患者影像学表型的临床治疗及疗效探究[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 2(9): 51-55.
7 Wang HB, Xia XK, Wu JH. Assessment of CKD-EPI equation estimating glomerular filtration rate[J]. J Int Lab Med, 2011, 32(9): 936-941.
8 Kitaguch Y, Fujimoto K, Kube K, et al. Characteristics of COPD phenotypes classified according to the findings of HRCT[J]. Respir Med, 2006, 100(10): 1742-1752.
9 Barnes PJ. Cellular and molecular mechanisms of asthma and COPD[J]. Clin Sci (Lond), 2017, 131(13): 1541-1558.
10 Lavorini F, Pedersen S, Usmani OS, et al. Dilemmas, Confusion, and Misconceptions Related to Small Airways Directed Therapy[J]. Chest, 2017, 151(6): 1345-1355.
11 Ishii T, Abboud RT, Wallace AM, et al. Alveolar macrophage proteinase/ antiproteinase expression in lung function and emphysema[J]. Eur Respir J, 2014, 43(1): 82-91.
12 Guyot N, Wartelle J, Malleret L, et al. Unopposed cathepsin G, neutrophil elastase, and proteinase 3 cause severe lung damage and emphysema[J]. Am J Pathol, 2014 , 184(8):2197-210.
13 Shi GP, Munger JS, Meara JP, et al. Molecular cloning and expression of human alveolarmacrophage cathepsin S, an elastinolytic cysteine protease[J]. J Biol Chem, 1992, 267(11): 7258-7262.
14 Riese RJ, Wolf PR, Brömme D, et al. Essential rolefor cathepsin S in MHC class Ⅱ-associated invariant chain processing and peptide loading[J]. Immunity, 1996, 4(4): 357-366, 1996.
15 Geraghty P, Greene CM, O′Mahony M, et al. Secretory leucocyte proteaseinhibitor inhibits interferon-γ-induced cathepsin S expression[J]. J Biol Chem, 2007, 282(46): 33389-33395.
16 Cosio MG, Saetta M, Agusti A. Immunologic aspectsof chronic obstructive pulmonary disease[J]. N Engl J Med, 2009, 360(23): 2396-2454.
17 Wang Z, Zheng T, Zhu Z, et al. Interferon γ induction ofpulmonary emphysema in the adult murine lung[J]. J Exp Med, 2000, 192(11): 1587-1599.
18 Zheng T, Zhu Z, Wang Z, et al. Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase-and cathepsin dependent emphysema[J]. J Clin Invest, 2000, 106(9): 1081-1093.
19 Zheng T, Kang MJ, Crothers K, et al. Role of cathepsin S dependent epithelial cell apoptosis in IFN-γ-induced alveolar remodeling and pulmonary emphysema[J]. J Immunol, 2005, 174(12): 8106-8115.
