心肺联合超声判断肺水肿的发生及机制
2018-07-05徐静胡明冬刘双林王建春李琦
徐静 胡明冬 刘双林 王建春 李琦
呼吸困难是常见危重症主诉之一,系呼吸循环受累的共同表现,是影响重症患者预后的独立危险因素。其发生病因较多,主要包括肺源性、心源性、神经精神性、血源性及中毒性等原因,其中心肺疾患所致的呼吸困难占绝大多数,肺水肿是临床较常见危重征象。目前根据肺水肿性质的不同可分为以下两类:心源性肺水肿(也称静水压升高性肺水肿)和非心源性肺水肿(也称渗透性肺水肿),二者临床表现相似,但病因和治疗均存在显著不同,临床上多结合病史、症状、实验室检查来鉴别二者。传统检测手段主要包括生物标志物、超声心电图和放射影像学检查,其中影像学辅助检查是诊断急性呼吸困难的主要手段,但绝大部分医院CT检查不能在床旁开展,在转运和检查过程中也存在潜在的风险。此外X线和CT检查都有射线暴露,有些医疗机构还不能在第一时间拿到检查结果,这些因素都会增加早期鉴别诊断的难度,尽快识别危重症患者的病因,快速指导救治对预后至关重要。
传统观念认为超声波无法穿透肺脏,因为肺部的气体介质会完全反射超声波束,造成声屏障,所以肺部一直被认为是超声检查的禁区。研究表明,以往被认为属于伪差的肺部超声征象逐渐成为评价肺部病变的重要依据。肺部超声是近年来发展的评估监测肺部改变、指导治疗的有效工具,可监测肺部的变化及气与水的平衡,评估肺泡受损、判断间质与肺泡含水量变化,并动态结合静态分析判断病情,指导治疗[1]。
一、肺部超声机制
在肺部超声检查中,超声波束会在气体-肺组织界面发生反射或折射。在正常肺组织中,超声波束被完全反射从而产生伪像,限制了其对深部组织结构特征的进一步探查。但是在肺脏内气体和液体混合存在时,随着肺组织中液体逐渐增加,超声检查会出现不同类型的征象,因为疾病不同其相应的气液比(肺组织内气体所占比例)也不同,在不同病变类型的肺组织中,气液比可简单划分为:胸腔积液约为0,肺实变约为0.1,肺间质综合征约为0.95,正常肺组织约为0.99,气胸约为1.0,慢性阻塞性肺疾病或哮喘失代偿期约为0.98。基于上述肺内不同病变组织气液比例不同所组成的连续征象谱,构成了肺部重症超声的理论基础。另外肺部超声除了能显示正常的影像,更多的征象来自超声所产生的伪像,当肺部组织的含气量明显减少,超声波束可以直接穿过肺部组织,可以显示肺部的真实病变,而当肺部组织含气量逐渐增加时,超声波束在气体-肺组织界面发生反射或折射,从而显示出A线/B线等一系列伪像。
二、心肺联合超声的重要性与实用性
目前床旁心肺联合重症超声具有独特的优势,对急性肺水肿的诊断价值越来越大,其可实现心脏功能、容量、肺水三个关键因素的评估,对急性肺水肿的病因可作出方向性诊断,进而明确治疗方向,此外在后续的治疗过程中心肺联合重症超声检查还可评价治疗的效果,具有准确、实时、动态、直观等特点。世界重症超声联盟(World Interactive Network Focus on Critical Ultrasound, WINFOCUS)组织的国际肺部超声共识会议再次强调了肺部超声对呼吸监测的重要性与实用性[2]。
三、心肺联合超声鉴别肺水肿病因
心肺联合超声检查可快速鉴别肺水肿病因。静水压升高性肺水肿和渗透性肺水肿二者在肺部超声上均表现为B征象,但其分布与病因有所不同。静水压升高性肺水肿的B线分布比较均匀,且无胸膜线的改变,胸膜滑动征不受影响[3]。 常继发于心功能不全与容量负荷过重,心脏超声表现为心脏收缩功能的显著下降及下腔静脉内径增宽等容量过负荷的表现;而渗透性肺水肿的B线分布则表现为重力依赖区较重、非重力依赖区较轻,甚至会出现肺实变等征象,另外由于渗出的液体黏性较高,胸膜滑动征通常也会减弱甚至消失,常常继发于重症感染、急性呼吸窘迫综合征(acute respiratory distres syndrome, ARDS)等,其心功能往往正常甚至可能收缩增强,容量一般也无过负荷的表现。因此,心肺联合超声检查可迅速鉴别静水压升高性肺水肿和渗透性肺水肿[4-6]。
四、肺部超声检查方法
鉴于近年来对肺部超声的不断认识,规范重症超声的操作流程,需要掌握以下超声基础知识及具体检查方法。
1. 探头及检查位点: 肺部超声的检查对探头无明确的要求,低频腹部探头、微凸探头、高频血管探头、阵列心脏探头等均可以进行肺部超声检查。肺部超声遵循BLUE(急诊床旁肺部超声)流程,将胸部的检查位点标准化,称作BLUE点,该方案主要是通过“蓝手“的方法进行定位,在检查前,比较检查者与被检查者的手,并通过双手在胸壁上所投射的位点确定检查的位置。BLUE方案的主要检查位置包括上蓝点、下蓝点、膈肌点、PLAPS点。上蓝点:定义为上蓝手的第三指与第四指之间,在其掌跖关节处。下蓝点:定义为下蓝手的掌心。膈肌点:下蓝手小拇指的下缘的位置即为膈肌线的位置,膈肌线的延长线与腋中线的交点即为膈肌点。PLAPS点:位于后方,腋后线与下蓝点水平延长线的交点。这四个点大略遵循了肺部解剖,尽可能避开了心脏。
2. 重症肺部超声10种标志性征象: 蝙蝠征(胸膜线),肺滑动征(沙滩征),A线(水平伪影),四边形征和正弦波征(胸腔积液),碎片征和组织样征象(肺实变),B线和肺彗星尾征(间质综合征),肺滑动征消失并出现平流层征提示气胸,肺点代表气胸。两个或更多的征象,肺搏动征和动态支气管充气征,常常用于区分肺炎和肺不张[7]。A线的出现代表正常通气的肺,如果A线缺失,则代表肺的生理特性发生了改变,使肺组织通过其他方式传递声波,最常见的改变就是肺间质水肿,B线的出现提示间质综合征,其数量直接与间质液体量相关。肺火箭征是指超声在气体和水的界面上产生强烈的混响(声束在体内形成多次反射),表现为B线,一个超声视野出现≥3根火箭样发射的B线,称为“肺火箭征”。B线具有6大特征:①起源于胸膜线;②垂直于胸膜线发出的高回声,界限清晰、类似激光样波束,延伸至屏幕远端且无衰减,与肺滑动同步移动,与A线不同时出现;③当胸膜无活动时,B线也处于静止状态;④B线数量取决于肺脏的气液比例,B线之间的平均距离可由线性和凸性探头测量;⑤无B线表现、孤立的B线或B线局限在膈肌上最后一个肋间被认为是正常表现;⑥当B线大量布满整个肺野时,往往表示肺血管外肺水含量的增多。若前胸及侧胸壁出现弥漫的B线,则被定义为弥漫性间质综合征。后胸壁扫查到B线提示重力依赖性肺水形成。
3. 超声方案: 有关肺水肿,急性肺水肿时可见多条与胸膜表面垂直的大B线及火箭征,为双侧对称性[8-12]。有研究提出利用肺部超声B型联合脑钠肽(brain natriuretic peptide, BNP)诊断急性心源性肺水肿的急诊胸部超声鉴别呼吸急促病因(emergency thoracic ultrasound in the differentiation of the etiology of shortness of breath, ETUDES)方案。该方案将双侧胸腔分为八个区域,记录各区域B线数目,见图1,双侧胸壁出现3条以上B线的区域越多,心源性肺水肿可能性越大。如每侧胸壁有3个以上区域均有3条以上B线出现则诊断心源性肺水肿可能性超过90%[13]。Sekiguchi等[14]提出用于早期诊断急性低氧性呼吸衰竭的危重病患者超声检查(critical care ultrasonography, CCUS)诊断流程,该方案主要评估B线区域、胸腔液性暗区、左心功能及下腔静脉(IVC)状态,见图2。根据综合表现判断引起急性低氧性呼吸衰竭的常见病因如ARDS、心源性肺水肿等[15]。患者一旦出现低氧性呼吸衰竭,立即在床旁行胸部超声探查B线,基于上述ETUDES、CCUS两个方案,若双侧肺部出现大于3条B线的区域越多,肺水肿可能性越大,在ETUDES方案中强调了每侧胸壁有3个以上区域均有3条以上B线出现,诊断心源性肺水肿可能性超过90%。在CCUS方案中3个以下的区域出现B线主要应考虑单侧肺炎、肺不张、慢阻肺、肺栓塞、气胸可能,评分为0分;若B线≥3个区域,则评分为+3分,需进一步行胸部及心脏超声检查,若左侧胸腔积液深度>20 mm,评分为+4;若中-重度左室功能减低,评分为+3;若IVC最小内径<23 mm则评分为-2。累计评分≤3分,则考虑急性呼吸窘迫综合征,若评分≥6分则考虑心源性肺水肿或合并急性呼吸窘迫综合征。
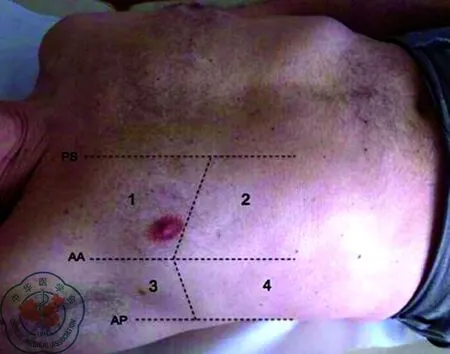
图1 八区扫描法(PS:胸骨旁线;AA:腑前线;AP:腋后线)
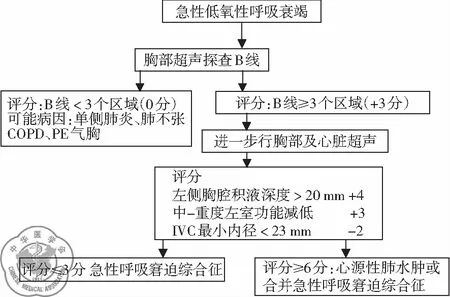
图2 急性低氧性呼吸衰竭CCUS诊断流程
4. 呼吸困难超声诊断流程: 练睿等[13]针对国外呼吸困难流程的优劣,结合急诊医师的工作性质、环境以及临床思维,分析一种疾病的多个超声影像,根据超声影像特点分层评估和诊断,制订了优化的急性呼吸困难超声诊断流程,见图3,首先明确有无填塞性的呼吸困难(液、气胸,心包积液),其次区别心源性和肺源性呼吸困难,最后再进一步明确肺源性呼吸困难的原因。与国外的流程相比,该流程更加简洁、快速明确危及生命的病因且简单易学。
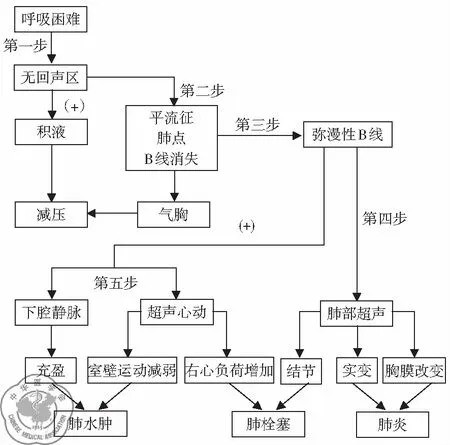
图3 改良呼吸困难诊断流程图
五、检查流程中需注意的问题
发生急性肺水肿时,临床上通常会采取脱水来减轻容量过负荷的治疗方案,但若病情危重合并循环不稳定及组织灌注不足,在容量治疗的方向选择上就会陷入两难的困境。此时超声对容量状态的评估可能有助于快速明确容量治疗的方向,可以通过了解下腔静脉内径和塌陷程度来实现,低血容量患者下腔静脉内径要比正常血容量患者小,而扩张、固定的下腔静脉通常提示患者处于容量过负荷状态[14-17]。腔静脉是距离右心房最近的回流血管,是器官与右心之间的桥梁,能够较好地反映右心功能,只要右心压力出现变化,腔静脉内径就会出现相应变化,比动脉系统的相关指标如血压、心率、主动脉直径更能反映患者的容量状态。在控制通气的机械通气患者中,吸气相时胸腔内压增加,静脉回流受阻,使得下腔静脉扩张[18]。腔静脉增宽一般定义为下腔静脉内径大于2 cm,腔静脉变小在自主呼吸时内径小于1 cm,控制通气时小于1.5 cm。目前在剑突下下腔静脉平面,肝静脉远心端呼气末测量。如果出现固定扩张的下腔静脉,提示存在容量反应性的可能性很小,此时循环不稳定并非容量因素所致,而肺水肿与容量过负荷可能性较大。下腔静脉的测量部位包括剑突下和右侧经腹腋后线,需要注意在不同部位所测下腔静脉内径和变异度存在的差异,无法相互替代,而下腔静脉内径形变指数则可用于下腔静脉内径的综合立体评估[19-20]。需要注意的是,应用重症超声检查时应结合病史,不应该忽视慢性心脏疾病显而易见的超声征象,如忽视了慢性心功能不全、慢性肺动脉高压,则容易将固定扩张的下腔静脉误判为容量过负荷;同样,在扩张性心肌病时,如以左心高动力和左心室腔容积减少作为低容量的参考标准,则会误诊误治。另外在临床中还需除外心脏压塞、急性肺心病等右心压力增高等因素,腔静脉内径才能较好地反映患者容量状态[21-22]。
重症超声检查对心脏功能可以快速做出简易判断,了解是否存在心脏问题,提供定量或半定量诊断,而并不强调复杂而特殊的测量技术,这有别于常规的心脏超声检查。在心功能评估方面,定性诊断主要包括心脏的大小和功能(如左、右心室大小、射血分数等),半定量诊断主要是指心脏功能的强弱程度(如左心室高动力、动力正常、低动力、严重低动力)。左心功能最重要且常用的评价方法是通过不同的心脏超声切面定性判断左室的整体及局部运动情况。收缩功能的评价主要就是观察室壁的增厚及向心运动。正常(内膜向心移动30%,室壁增厚大于50%);轻度运动减低(内膜向心移动20~30%,室壁增厚30~50%);重度运动减低(内膜向心移动<20%,室壁增厚<30%);室壁无运动(无内膜向心移动,室壁增厚<10%);室壁矛盾运动(收缩期室壁矛盾运动)[22]。随着组织多普勒技术的发展,心脏超声测量心肌本身或内在机能的指标逐步出现,如心肌收缩速度、应变和应变率等,这些指标结合基础指标(如射血分数、心输出量等)形成系统性心功能评估,有助于在重症患者血流动力学评估中早期发现心功能异常,指导早期进行滴定处理[23]。心肌应变测量是针对心肌各节段的变形,在定量评价心肌各节段的收缩和舒张功能时,心肌应变与心肌的收缩和舒张功能密切相关,因此能准确评估心肌收缩和舒张功能[24]。
重症超声检查已经成为救治危重症患者工作中不可或缺的、较为先进的检测手段,与其他诊治工具相比具有不可比拟的优势,几乎是同步、现场的诊断与治疗,达到指导床旁、现场问题的快速解决。随着技术的进步和经验的积累,以往被认为属于“伪差”的肺部超声正逐渐成为ICU医师评价肺部病变的重要方法。通过重症超声检查可以及时发现病因,了解疾病的发生、发展过程,从而能够及时快速诊断并制定相应的治疗方案,指导重症患者从诊断-治疗-评估再到治疗的过程,紧密参与临床病情的观察,自然而然的与其他监测工具的合理整合,真正做到了与重症患者管理的有机结合。心肺床旁超声操作可重复性强,无创即时,比传统方法或单独应用肺部超声更能连续追踪心肺等功能的实时改变,予目标导向性治疗,连续评估动态调整,有助提高诊断准确率与治疗效果。心肺联合超声检查可快速鉴别肺水肿的病因及相应机制,对低氧性急性呼吸衰竭的病情分析可以发挥重要作用,但在临床应用中需不断实践并完善,最终才能成为指导精细调整治疗的重要手段[25]。重症医学已发展到了亚专业化的阶段,尽管处于发展阶段,但重症超声检查作为多系统、多器官评估的工具,作为重症医学的一个关键环节,进行专业化发展是其必由之路。
参 考 文 献
1 王晓亭, 刘大为. 重症超声是整合重症医学的有力武器[J]. 中华内科杂志, 2013, 52(8): 631-633.
2 Volpicelli G, Elbarbary M, Blaivas M, et al. Internationalevidence-based recommendations for point of-care lungultrasound[J]. Intensive Care Med, 2012, 38: 577-591.
3 Al Deeb M, Barbic S, Featherstone R, et al. Point-of-care ultrasonography for the diagnosis of acute cardiogenic pulmonary edema in patients presenting with acute dyspnea: a systematic review and meta-analysis[J]. Acad Emerg Med, 2014, 21(8): 843-852.
4 Silva S, Biendel C, Ruiz J, et al. Usefulness of cardiothoracic chest ultrasound in the management of acute respiratory failure in critical care practice[J]. Chest, 2013, 144(3): 859-865.
5 Bataille B, Riu B, Ferre F, et al. Integrated use of bedside lung ultrasound and echocardiography in acute respiratory failure: a prospective observational study in ICU[J]. Chest, 2014, 146(6): 1586-1593.
6 Wang XT, Liu DW, Zhang HM, et al. Integrated cardiopulmonary sonography: a useful tool for assessment of acute pulmonary edema in the intensive care unit[J]. J Ultrasound Med, 2014, 33(7): 1231-1239.
7 Lichtenstein D, van Hooland S, Elbers P, et al. Ten good reasons to practice ultrasound in critical care[J]. Anaesthesiol Intensive Ther, 2014, 46(5): 323-335.
8 Lichtenstein D, Meziere G, Biderman P, et al. The comet-tail artifact. An ultrasound sign of alveolar-interstitial syndrome[J]. Am J Respir Crit Care Med, 1997, 156(5): 1640-1646.
9 Picano E, Frassi F, Agricola E, et al. Ultrasound lung comets: aclinically useful sign of extravascular lung water [J]. J Am SocEchocardiogr, 2006, 19(3): 356-363.
10 Agricola E, Bove T, Oppizzi M, et al. “Ultrasound comet-tail images”:a marker of pulmonary edema: a comparative study with wedge pressure and extravascular lung water[J]. Chest, 2005, 127(5): 1690-1695.
11 Fagenholz PJ, Gutman JA, Murray AF, et al. Chest ultrasonography for the diagnosis and monitoring of high-altitude pulmonary edema[J]. Chest, 2007, 131(4): 1013-1018.
12 Bedetti G, Gargani L, Corbisiero A, et al. Evaluation of ultrasound lung comets by hand-held echocardiography[J]. Cardiovasc Ultrasound, 2006, 4: 34.
13 练睿, 张国强. 床旁超声在急性呼吸困难中的临床应用[J] . 中国医刊, 2016, 51(9): 1-6.
14 Sekiguchi H, Schenck LA, Horie R, et al. Critical Care ultrasonography differentiates ARDS, pulmonary edema, and other causes in the early course of acute hypoxemic respiratory failure[J]. Chest, 2015, 148(4): 912-918.
15 Jambrik Z, Gargani L, Adamicza A, et al. B-lines quantify the lung water content:a lung ultrasound versus lung gravimetry study in acute lung injury[J]. Ultrasound Med Biol, 2010, 36(12): 2004-2010.
16 Dipti A, Soucy Z, Surana A, et al. Role of inferior vena cava diameter in assessment of volume status: a meta-analysis[J]. Am J Emerg Med, 2012, 30(8): 1414-1419.
17 Zengin S, Al B, Genc S, et al. Role of inferior vena cava and right ventricular diameter in assessment of volume status: a comparative study: ultrasound and hypovolemia[J]. Am J Emerg Med, 2013, 31(5): 763-767.
18 王小亭, 刘大为, 于凯江, 等. 中国重症超声专家共识[J]. 中华内科杂志, 2016, 55(11): 369-383.
19 张青, 刘大为, 王小亭, 等. 超声观测不同部位下腔静脉内径及其变异度的研究[J]. 中华内科杂志, 2014, 53(11): 880-883.
20 张青, 刘大为, 王小亭, 等. 超声观测不同部位下腔静脉内径形变指数的研究初探[J]. 中华内科杂志, 2015, 54(6): 491-495.
21 Schmidt GA, Koenig S, Mayo PH. Shock: ultrasound to guide diagnosis and therapy[J]. Chest, 2012, 142(4): 1042-1048.
22 刘大为, 王小亭. 主编, 重症超声[M]. 北京: 人民卫生出版社, 2017: 56-67.
23 Vieillard-Baron A, Caille V, Charron C, et al. Actualincidence of global left ventricular hypokinesia in adult septic shock[J]. Crit Care Med, 2008, 36(6): 1701-1706.
24 Salem R, Vallee F, Rusca M, et al. Hemodynamicmonitoring by echocardiography in the ICU: the role ofthe newecho techniques[J]. Curr Opin Crit Care, 2008, 14(5): 561-568.
25 许兆军, 陈培服主译. 急诊与危重症监护超声手册[M]. 成都: 四川大学出版社, 2015: 47-70;142-149.
