猪胎盘中生物活性肽的制备及含量测定
2018-07-04张尚卫黄大鹏
张尚卫,黄大鹏
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319)
胎盘肽(placental polypeptide,PP)又称胎盘免疫调节肽、胎盘转移因子,是从动物胎盘中分离提纯得到的由核苷酸、肽类、和各种氨基酸等小分子物质混合而成的多肽。研究发现[1]胎盘肽具有抗菌抗氧化、提高机体免疫力等多种生物活性功能,它不仅能够促进T淋巴细胞E受体表达,还能促进淋巴细胞有丝分裂,从而增强细胞免疫。采用超声波破碎[2]、酶解[3]、组织匀浆[4]等方法,均能从鲜活胎盘中释放并提取出胎盘肽,胎盘组织中细胞壁的破碎以及固液分离程度对胎盘肽的提取效率有较大影响,不同的提取工艺对不同动物胎盘中胎盘肽的提取效率也不尽相同。目前我国基础母猪存栏大约3 500万头,每年可产出大量猪胎盘。研究猪胎盘内含有的活性物质,对合理利用数量庞大的猪胎盘资源具有重要意义。本试验用组织匀浆法提取猪胎盘肽,采用Tricine-SDS-PAGE 电泳法和考马斯亮蓝 G-250法对猪胎盘肽分子量大小和含量进行测定,为猪胎盘的进一步研究提供参考依据。
1 材料与方法
1.1 材料
猪鲜活胎盘由大庆市龙凤区某养殖场提供;丙烯酰胺、甲叉双丙烯酰胺为天津市科密欧化学试剂有限公司产品;溴芬兰、巯基乙醇均为北京科昊达生物技术公司产品 ;冰醋酸、尿素、甘油为国药集团化学试剂有限公司产品;三羟甲基氨基甘氨酸(ttricine)、十二烷基磺酸钠(SDS)为Biomo公司产品;Tris碱、TEMED为上海化学试剂公司产品 ;过硫酸铵(AP)为BIB产品 ;超低分子蛋白marker为北京索莱宝公司产品;考马斯亮蓝G-250、牛血清蛋白均为北京Solarbio公司产品。
1.2 方法
1.2.1 猪胎盘肽的提取 选取6付刚娩出鲜活猪胎盘,将其分为A、B、C、D、E、F 6个组,从每付胎盘中3个随机部位各剪取1 g胎盘组织,并分别标记为A1、A2、A3;B1、B2、B3……F1、F2、F3,将胎盘组织用盐水冲洗干净后用吸水纸把水分吸净,加入1.5倍去离子蒸馏水,置于高速组织捣碎匀浆机(12 000 r/min,3 min/次,10次)匀浆,经3次反复冻融后于高速冷冻离心机冷冻离心(8 000 r/min,20 min),取上清液用0.45 μm微孔滤器进行微滤处理,以除去不溶性杂质,将提取液进行分装,置-80℃冷冻保存备用。
1.2.2 Tricine-SDS-PAGE 电泳法检测猪胎盘肽分子量
1.2.2.1 试剂的配置与灌胶 电泳液的配置与灌胶参照周国华[5]改良后的 Tricine-SDS-PAGE电泳法进行,凝胶由3层不同密度胶体构成,分别为分离胶、间隙胶和浓缩胶。
1.2.2.2 上样与电泳 电泳仪和电泳槽安装完毕后,加入电泳液,下槽装阳极缓冲液,上槽装阴极缓冲液。将待测液和上样缓冲液以1∶1混合均匀后,沸水浴加热5 min后冷却,开始上样。取20 μL蛋白质标准品加入第1个点样孔,另外分别从每组样品液中取20 μL依次加入点样孔内。先将电压调至30V约1.5 h,待样品进入分离胶后电压升至120V至电泳结束。
1.2.2.3 染色和脱色 电泳结束后将胶至于染色液中缓慢振荡染色20 min,之后转移至脱色液中进行脱色,脱色至条带清晰后进行照胶分析。
1.2.3 考马斯亮蓝G-250法测定胎盘肽的含量
1.2.3.1 试剂的配置 考马斯亮蓝G-250溶液与标准蛋白质溶液均按常规方法进行配置与保存[6]。
1.2.3.2 制作标准曲线 取6支10 mL具塞试管分别编号0、1、2、3、4、5号,并按表1中所示分别加入相应试剂,充分混匀2 min后在595 nm波长下测定其吸光度值(OD),然后绘制标准曲线并求出标准方程。

表1 标准曲线制作表
1.2.3.3 待测液的测定 吸取0.01 mL样品溶液,用蒸馏水补至0.1 mL,再加入5 mL考马斯亮蓝G-250显色剂,充分混匀2 min后在595 nm波长下进行比色,并记录吸光值(需重复实验)。如表2所示,然后根据所得吸光度值(OD)带入标准方程中计算蛋白质含量。按以下公式计算胎盘组织中所含胎盘肽的含量。
样品蛋白质含量(mg/g鲜重)=[查得的蛋白质含量(μg)/样品的重量(g)×1 000]×稀释倍数

表2 样品液的测定表
1.3 数据分析
采用Excel软件对数据进行分析,用胎盘中3个不同部位的平均数±标准差表示此胎盘中胎盘肽分子质量和含量。
2 结果
2.1 猪胎盘肽分子量检测结果
由图1可看出6组份猪胎盘样在14.4 ku处均有较为清晰的蛋白质条带,其他条带不明显。对标准蛋白质样品的分子质量的对数(lg Mr)和在分离胶中的相对迁移率(Rf)进行了回归分析,绘制标准曲线(图2),并得出相应的线性回归方程为y=-0.599 5Rf+1.316 7,r=0.993 2。从标准蛋白曲线中查得6组猪胎盘中胎盘肽分子质量分别为14.219、13.801、12.012、12.357、11.326、10.197 ku,明确表明猪胎盘中含有小分子多肽。

A、B、C、D、E、F分别为6组猪胎盘肽样品相对分子质量条带
A,B,C,D,E,F were relative molecular mass bands of 6 pig placental peptide samples
图1猪胎盘肽和标准蛋白电泳图
Fig.1 Pig placental peptide and standard protein electrophoresis

图2 标准蛋白曲线
2.2 猪胎盘肽含量测定结果
2.2.1 标准曲线回归方程建立 用分光光度计,以试剂空白对照做参比,在595 nm波长下测定标准蛋白溶液吸光度值(OD)。以蛋白质含量为横坐标,吸光值(OD)为纵坐标绘制标准曲线(图3),并得出相应的线性回归方程y=0.006x+0.014 9,r=0.998 3,曲线很好的符合郎伯-比尔(Lamber-Beer)定律。

图3 牛血清白蛋白标准曲线
2.2.2 猪胎盘中胎盘肽的含量 由表3可知,6组胎盘中胎盘肽的含量不同,且同一胎盘不同部位胎盘肽的含量也不相同。6组猪胎盘中胎盘肽的平均含量分别为0.67 mg/g±0.07 mg/g、0.82 mg/g±0.03 mg/g、0.81 mg/g±0.02 mg/g、0.70 mg/g±0.11 mg/g、0.79 mg/g±0.03 mg/g及0.84 mg/g±0.04 mg/g。
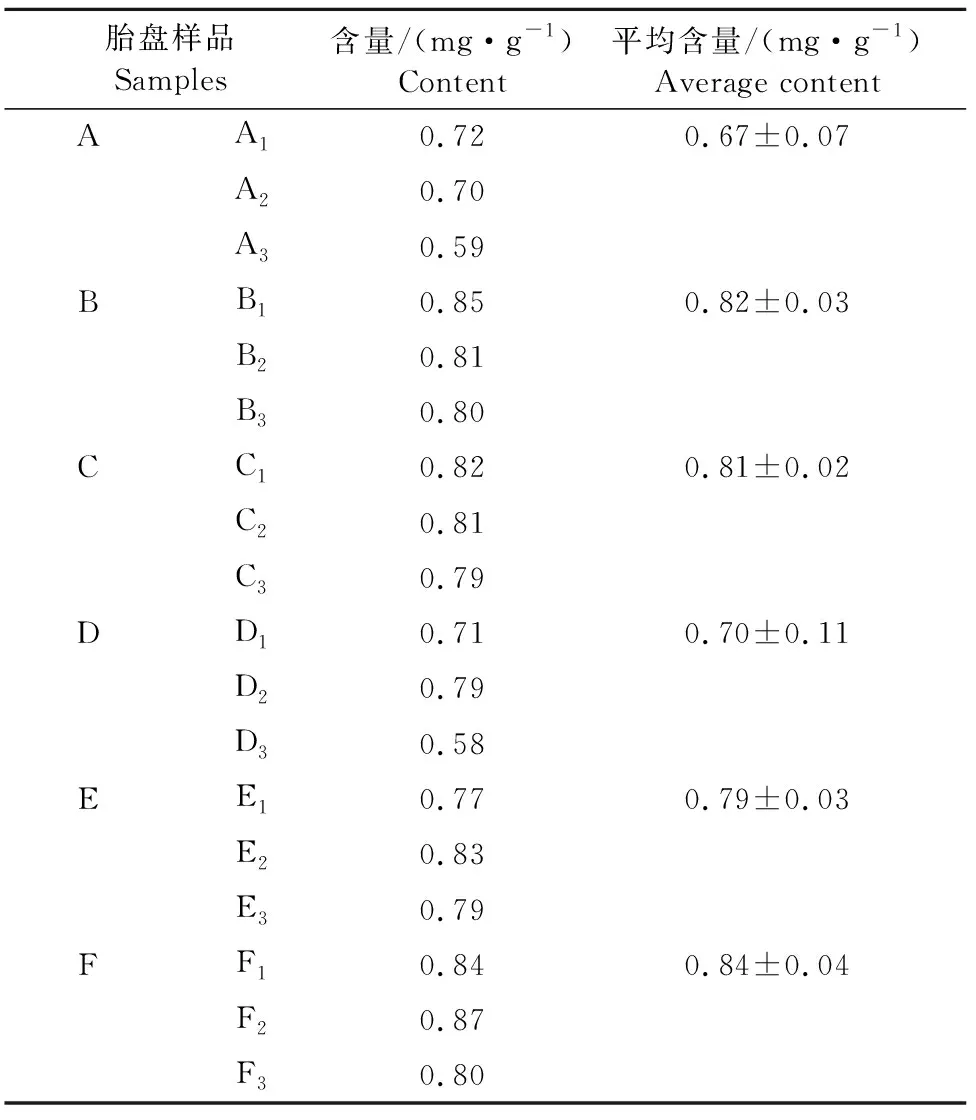
表3 猪胎盘肽含量测定结果
3 讨论
3.1 胎盘肽的提取工艺
动物体内的生物活性肽主要源于蛋白质,对于活性肽的提取首先应考虑到如何将其蛋白质更好的溶解释放,同时尽可能少的破坏其多肽结构。提取动物组织中多肽首先要使组织细胞破碎和固液分离,这一步也是分离纯化阶段的重要环节。细胞破碎的方法通常有组织匀浆法、超声波破碎法和酶解法,前两种方法即为物理方法提取活性多肽,其原理均是通过外力将细胞破碎,使细胞中的多肽或蛋白质进入到溶液中,然后进行下一步的提取纯化。酶解法即是利用生物酶制剂将细胞壁或者细胞膜充分溶解和消化,使其细胞内的蛋白质和多肽等内容物释放溶解,但应用此方法需严格掌握酶的专一性以及反应条件,只有选择合适的酶,并且在适应的温度和pH条件下才能充分酶解释放胞内物质而不过多破坏其结构。以上几种方法的最终目的以及基本原理都是将细胞破碎后释放出胞内物质,但目前超声波破碎法和酶解法均无成套的关键技术,制作工艺复杂,成本较高,不具备大批量生产的条件。本试验采用组织匀浆法获得了透明清亮较为优质的猪胎盘肽,相比之下,组织匀浆法工艺较简单,关键技术较为成熟,且适合大规模生产。
3.2 猪胎盘肽分子质量测定分析
用SDS-PAGE分离鉴定蛋白质,其有效分离范围取决于聚丙烯酰胺的浓度和交联度,即胶体孔径的大小,分离胶浓度越大,其孔径越小,孔径的大小直接影响到蛋白质分离的效果。汪建雄等[7]研究发现分离胶浓度为100 g/L、120 g/L时,胶体孔径过大,得不到清晰条带,当分离胶浓度为150 g/L时条带效果得到改善,分离胶浓度达180 g/L、200 g/L时条带效果较清晰,当浓度达250 g/L时,电泳受阻严重,说明分离胶孔径已经太小。对于小分子多肽(Mr<10 ku)而言,即使用高浓度聚丙烯酰胺凝胶的 SDS-PAGE 也不能够完全分离,由于在含SDS 缓冲液的样品中,小分子肽的浓缩较为困难,因为二者成为复合体后所带的电荷和大小皆与SDS本身类似,因此小分子多肽的浓缩对SDS-PAGE 来说就成了一个突出问题[8]。
本试验采用改良后的Tricine-SDS-PAGE电泳法[5]对猪胎盘肽相对分子质量进行测定,得到了较为清晰的条带,改良后的Tricine-SDS-PAGE中加入的尿素在一定程度上能够有效的减少小分子多肽与SDS的结合量,而甘油则能缓解间隙胶和分离胶快速聚合时引起的断层问题[9]。由电泳结果可知6组猪胎盘肽分子质量分别为14.219、13.801、12.012、12.357、11.326、10.197 ku。这与李小梅[10]所报道的猪胎盘肽分子质量(14.4 ku)相差较小,而与周国华等[11]所测得的猪胎盘肽分子质量(6 ku)结果相差较大,这可能与猪的品种以及胎次或是提取工艺的不同有关,其真正原因有待于进一步的研究。同时,由图1可以看出6条样品带中A组和D组条带颜色较浅,也许是样品的浓度不够高而导致,由此猜测不同胎盘或是同一胎盘的不同部位其胎盘肽的含量是不同的。
3.3 猪胎盘肽含量的测定分析
考马斯亮蓝法测定蛋白质含量已经得到广泛的应用,被众多科研工作者认为是一种稳定而可靠的蛋白质测定方法。此方法对仪器设备的要求不高,简便而精准,据估计考马斯亮蓝法比紫外吸收法灵敏10倍~20倍,比Lowry法约高4倍[12]。但是环境温度、光照强度、蛋白质孵育温度及时间等因素对试验结果的准确性均有较大影响[13-14]。本试验应用考马斯亮蓝法,对猪胎盘中胎盘肽的含量进行测定,由结果可知,6组猪胎盘中胎盘肽的含量分别为0.67 mg/g±0.07 mg/g、0.82 mg/g±0.03 mg/g、0.81 mg/g±0.02 mg/g、0.70 mg/g±0.11 mg/g、0.79 mg/g±0.03 mg/g及0.84 mg/g±0.04 mg/g,这与周国华所报导的猪胎盘肽含量相差较大,这可能与以上提出的影响因素有关。从试验结果中得知不同猪胎盘中胎盘肽的含量不同,且同一胎盘中不同部位的胎盘肽含量也不相同,这可能与猪的品种以及猪的体质或是胎次有关,具体原因还需要进一步研究。
参考文献:
[1] 侯银臣,吴 丽,刘旺旺,等.羊胎盘免疫活性肽的制备及其活性[J].中国食品学报,2016,16(1):123-129.
[2] 唐文林.猪胎盘综合利用工艺与应用研究[D].江南大学,2014.
[3] 王 晶,林志颖,林立梅,等.牛羊胎盘免疫调节因子的提取及对PANC-Ⅰ增殖和迁移影响的比较[J].农业生物技术学报,2016,24(12):1863-1871.
[4] 任兴宏.羊胎盘免疫活性小分子肽的分离纯化[D].西南大学,2010.
[5] 周国华,孟凡军,王永志,等.羊和猪胎盘肽的制备及其生物活性的初步研究[J].家畜生态学报,2006,27(3):000019-22.
[6] 姜亦超,白洪健,郭 鸰,等.考马斯亮蓝法测定粪便中蛋白质含量及应用[J].食品研究与开发,2013,34(21):77-79.
[7] 汪建雄,隋秀芝.用SDS-PAGE电泳法测定小分子多肽分子量的研究[J].丝绸,2001(12):44-45.
[8] Cleveland D W,Fischer S G,Kirschner M W,et al.Peptide mapping by limited proteolysis in SDS and analysis by gel electrophoresis[J].J Biol Chem,1977,252(3):1102-1106.
[9] 马兴亮.奶山羊胎盘肽的分离提纯及其对小白鼠免疫功能的影响[D].山东农业大学,2008.
[10] 李小梅.猪胎盘肽冻干粉的制备及功效考察[D].扬州大学,2016.
[11] 周国华.家畜胎盘肽的制备及其生物活性的研究[D].山东农业大学,2006.
[12] 周跃男,王 湛,赵小川,等.浅谈蛋白质含量的定量检测方法[J].食品研究与开发,2014(7):127-130.
[13] 赵 卓,籍浩天,刘东波,等.光照对考马斯亮蓝法测定蛋白质浓度影响的研究[J].吉林师范大学学报(自然科学版),2015(2):112-116.
[14] Zhao Z,Ya-Ru J I,Hao-Tian J I,et al.Effects of temperature on determination of protein concentration with Coomassie brilliant blue method[J].J Anhui Agri Sci,2015.
