基于L-苹果酸铜锌配位聚合物的合成和结构表征
2018-07-04陶家宇幸国香袁雪梅杜丽婷徐海军
杨 剑 陶家宇 幸国香 孟 婷 袁雪梅 杜丽婷 徐 莉 徐海军*,
(1南京林业大学化学工程学院,江苏生物质绿色燃料与化学品重点实验室,南京 210037)
(2南京林业大学理学院,南京 210037)
配位聚合物是金属离子与有机配体通过配位键或者其他弱相互作用力而形成的具有周期性结构的晶体材料[1-2]。这类晶体材料具有结构多样性和优良的物理化学性能,在气体吸附、催化、光电磁新材料和生命科学等领域具有广泛的应用前景;在配合物中引入超分子构筑多孔道金属有机骨架材料,在分子识别、离子交换等方面具有潜在的应用价值[3-5]。在配位聚合物结构中,金属离子的配位模式以及配体的配位能力和几何构型对材料的结构多样性具有很大的影响。近年来,金属离子中研究较多的是过渡金属离子,常见的有Coギ、Niギ、Mnギ、Znギ、Cdギ、Agガ、Cuガ、Cuギ等金属离子; 除此之外,稀土金属因配位数高,能形成结构复杂的配合物[6-10],而碱土金属离子半径小,能提高金属骨架材料密度[5-9],也越来越受到广泛关注。
有机配体在配合物中可以采用不同的方式与金属离子进行配位,配位聚合物中常见的配体有多羧酸化合物、多氮化合物以及席夫碱等,其中多羧酸化合物与多氮化合物分别属于电负性和中性桥联配体。多羧酸化合物在构筑一系列具有新颖结构的配合物时展现了灵活的键合方式和多样的构象,使得这类有机配体在配合物合成中备受青睐[11-15]。羟基多羧酸如苹果酸在动植物代谢中起着至关重要的作用,这类配体配位模式多样,配位能力强,且易与Cu、Zn、Fe等生命元素形成配合物,在配位化学中属于多功能配体,使其在医药和生命科学方面具有应用价值[16-18]。目前有关羟基多羧酸构筑金属有机骨架材料的研究已有较多报道[1-6]。多氮化合物如联吡啶在与金属离子配位后表现出较高的催化和生物活性[19-20];另外,引入含氮杂环结构单元的配体对调节配位聚合物结构性质具有重要影响[24-25]。鉴于此,在已有的有机酸金属离子与第二配体相互作用的基础上,本文采用L-苹果酸锌和L-苹果酸铜分别与2,2′-联吡啶、菲咯啉反应,得到了3种配位聚合物{[Zn(mal)(2,2′-bipy)]2·5H2O}n(1)、{[Zn(mal)(Phen)(H2O)]2·3H2O}n(2)和{[Cu(mal)(Phen)]2·4H2O}n(3)。
1 实验部分
1.1 试剂与仪器
CuCl2、Zn(OAc)2·2H2O、L-苹果酸、2,2′-联吡啶、菲咯啉、碳酸钠、乙醇均为分析纯。美国Perkin Elmer傅里叶变换红外光谱仪、Perkin-Elmer 2400元素分析仪、德国Bruker D8 VENTURE单晶X射线衍射仪。粉末X射线衍射(PXRD)测试使用日本理学UltimaⅣ组合型多功能水平X射线衍射仪,用Cu Kα 辐射(λ=0.154 056 nm),工作电压为 40 kV,管电流为 30 mA,扫描速率为5°·min-1,扫描范围为5°~50°,温度为室温。
1.2 配合物的合成
{[Zn(mal)(2,2′-bipy)]2·5H2O}n(1)的合成:将 0.5 mmol苹果酸溶解于5 mL水,在苹果酸溶液中慢慢加入0.5 mmol碳酸钠,待反应完全后,0.5 mmol Zn(OAc)2·2H2O 溶解于 5 mL 水,然后将醋酸锌水溶液慢慢加入到上述的苹果酸溶液中,室温搅拌4 h。再将 0.5 mmol 2,2′-联吡啶溶解于 15 mL 乙醇,待完全溶解后,将前面溶液慢慢加入2,2′-联吡啶溶液,混合后,室温搅拌反应1 h,过滤,滤液放置在烧杯中自然挥发得到无色晶体化合物。元素分析按C28H34N4O15Zn2计算值(%):C,42.18;H,4.30;N,7.03。实验值(%):C,42.25;H,4.25;N,6.97。 IR(KBr):3 440,1 590,1 410,1 300,1 100,1 030,766 cm-1。
{[Zn(mal)(Phen)(H2O)]2·3H2O}n(2)的合成:将 0.5 mmol Zn(OAc)2·2H2O 溶解于 5 mL 水,0.5 mmol菲咯啉溶解于5 mL乙醇,然后将醋酸锌溶液慢慢加入菲咯啉溶液,混合搅拌1 h;再将0.5 mmol苹果酸溶解于5 mL水,在苹果酸溶液中慢慢加入0.5 mmol碳酸钠,待反应完全后,将苹果酸钠溶液加入前述溶液中,室温搅拌反应2.5 h。过滤,滤液放置在烧杯中自然挥发得到无色晶体化合物。元素分析按C32H34N4O15Zn2计算值(%):C,45.46;H,4.05;N,6.63。实验值(%):C,45.41;H,4.11;N,6.58。 IR(KBr):3 420,1 600,1 520,1 400,1 320,1 100,729 cm-1。
{[Cu(mal)(Phen)]2·4H2O}n(3)的合成:将 0.5 mmol CuCl2溶解于5 mL水中,0.5 mmol菲咯啉溶解于5mL乙醇,然后将氯化铜溶液慢慢加入菲咯啉溶液,混合搅拌1 h;再将0.5 mmol苹果酸溶解于5 mL水,在苹果酸溶液中慢慢加入0.5 mmol碳酸钠,待反应完全后,将苹果酸钠溶液加入前述溶液中,室温搅拌反应2.5 h。过滤,滤液放置在烧杯中自然挥发得到蓝色晶体化合物。元素分析按C32H32Cu2N4O14计算值(%):C,46.66;H,3.92;N,6.80。实验值(%):C,46.61;H,3.88;N,6.75。 IR (KBr):3 414,1 618,1 510,1 399,1 321,1 200,781,621 cm-1。
1.3 晶体结构的测定
选取大小合适的配合物晶体,置于带有石墨单色器的Bruker D8 VENTURE X射线衍射仪上,用Mo Kα(λ=0.071 073 nm)射线,在一定 θ范围内以 ω扫描方式收集数据。晶体结构用直接法解出,数据还原和结构解析工作分别使用SAINT-5.0和SHELXL-97[21]。氢原子全部通过理论加氢完成。有关晶体学数据详见表1。
CCDC:1821171,1;1821173,2;1821176,3。

表1 配合物1~3的晶体学数据Table 1 Crystallographic data of complexes 1~3
2 结果与讨论
2.1 配合物晶体结构
配合物1属于正交空间群P212121,最小不对称单元由 1 个 Zn2+离子、1 个 L-苹果酸根、1 个 2,2′-联吡啶分子和5个未配位的水分子构成。其中Zn2+与来自2,2′-联吡啶的2个氮原子和2个L-苹果酸根的4个氧原子配位形成六配位的扭曲八面体构型(图1a)。配合物1的部分键长与键角见表2,与具有扭曲三角双锥构型的一维链状配位聚合物{[Zn(malate)(2,2′-bipy)]·3H2O}n类似[7]。 在晶体中每个苹果酸根以R构型方式桥联2个扭曲八面体结构单元。沿a轴方向2个相邻的Zn2+离子单元通过L-苹果酸根进行桥联,形成无限延伸的一维链结构(图1b)。2条平行链以面对面的方式重叠,通过彼此吡啶环之间弱的π-π相互作用 (0.371 4和0.370 7 nm)构成了一个梯状双链结构(图1c),类似于一维梯状配位聚合物{[Cu(malate)(2,2′-bipy)]·3H2O}n[7,12]。
配合物2结晶于正交空间群P212121,最小不对称结构单元中由2个Zn2+离子,2个菲咯啉分子,2个L-苹果酸根,2个配位水分子和3个溶剂水分子组成;其中Zn1和Zn2都是六配位,但2个Zn2+离子采取不同的配位模式。因而,配合物2的空间群及配位方式都不同于已有的文献报道[3,6]。配合物2的部分键长与键角见表3。Zn1与菲咯啉的2个氮原子、1个L-苹果酸根的羧酸氧原子和羟基氧原子以及另外一个L-苹果酸根的羧酸氧原子、1个水分子的氧原子进行配位,形成了扭曲八面体构型,其中N5,N6,O11和O5i组成赤道面, 而O1和O3i则处在轴向位置,O1-Zn1-O3i键角为 169.80(8)°。 Zn2与1个菲咯啉的2个氮原子、1个苹果酸根中的2个羧基氧原子和1个羟基氧原子、1个水分子中的氧原子进行配位,形成扭曲的八面体,其中O8,O6,O12和N7组成赤道面,平均偏差0.038 2 nm,而N8和O10则处在轴向位置,O10-Zn2-N8的键角为176.11(9)°(图2a)。 Zn1 和 Zn2 分别与菲咯啉的 2 个氮原子形成1个螯合的五元环,其中Zn2与苹果酸的1个烷氧基、2个羧基分别形成1个五元螯合环和1个六元螯合环。Zn-O的键长值在0.203 9(2)~0.214 3(2)nm 范围, 而 Zn-N 键长在 0.210 2(3)~0.2235(2)nm范围,Zn-O键长平均值弱短于Zn-N键长,与类似六配位结构的配合物中Zn-O和Zn-N键长很相近[6]。另外,Zn1和Zn2不仅在配位模式上存在不同,在堆积方式上也呈现出明显的不同。与配合物1类似,2个相邻的Zn1在a轴方向上通过 L-苹果酸根的桥联作用形成链状配位结构(图2b),而Zn2仅作为一个独立的单元存在。对于Zn1形成的一维链状配位结构,2个相邻的链之间不存在有效的 π-π 堆积作用(0.436 3 和 0.451 3 nm);而 Zn2 形成的独立结构单元之间有很弱的分子间作用(π-π堆积距离为 0.390 4 nm)(图2c)。

表2 配合物1的部分键长(nm)与键角(°)Table 2 Selected bond lengths (nm)and angles (°)for complex 1

图1 (a)配合物1的最小不对称单元图;(b)配合物1沿a轴方向形成的一维链;(c)配合物1通过ππ堆积形成的梯状双链结构Fig.1 (a)Molecular structure of complex 1;(b)1D chain structure of complex 1;(c)Ladder-shaped double chains structure of complex 1

图2 (a)配合物2的分子结构;(b)配合物2沿a轴方向的配位结构图;(c)配合物2的梯状双链结构Fig.2 (a)Molecular structure of complex 2;(b)1D chain structure of complex 2;(c)Ladder-shaped double chains structure of complex 2

表3 配合物2的部分键长(nm)与键角(°)Table 3 Selected bond lengths (nm)and angles (°)for complex 2
配合物3的不对称结构单元由2个苹果酸根、2个铜离子、2个菲咯啉分子及4个溶剂水分子组成,为单斜空间群P21,2个铜原子配位方式不一样(图3a),不同于六配位聚合物{[Cu(mal)(phen)]·H2O·MeOH}n[1]和 双 核 配 合 物 [Cu2(mal)(NO3)(phen)3]NO3·4H2O[23]。配合物3的部分键长与键角见表4。其中,Cu1与1个L-苹果酸中羟基氧和2个 L-苹果酸根的2个羧基氧及1个菲咯啉的2个氮原子配位,形成五配位的畸变三角双锥构型,来自苹果酸的α-羟基氧原子O2、另一个苹果酸的β-羧基氧原子O6和菲咯啉的1个氮原子N1构成基本平面,苹果酸根中α-羧基氧原子O1和菲咯啉的剩余氮原子N2位于轴向位置。O6iv-Cu1-N1、N1-Cu1-O2和O6iv-Cu1-O2 的 键 角 分 别 是 146.98(13)°、109.98(14)°和102.72(14)°,总键角是 359.68°(接近 360°);O1-Cu1-N2 键角为 172.46(14)°,Cu1-O 和 Cu1-N 键长分别在 0.192 1(3)~0.221 2 (3)nm 和 0.200 7(3)~0.201 7(3)nm,与五配位的铜苹果酸配合物相似[1]。相邻的Cu1离子间通过L-苹果酸根桥联形成Z字型的一维链(图3b)。Cu2为六配位的扭曲八面体结构,配位原子分别是3个羧基氧原子和1个羟基氧原子以及1个菲咯啉的2个氮原子,配位原子 O7、O4、O12、N3与铜原子构成了这个八面体的赤道平面,O3和N4两原子分别位于八面体的2个轴向位置上。O7-Cu2-N3、O7-Cu2-O4iii和 O4iii-Cu2-N3 的 键 角 分 别是 109.57(13)°、95.86(12)°和 154.22(13)°,总键角是359.65°(接近 360°),O3-Cu2-N4 键角为 169.34(13)°;Cu2-O12 键长为 0.273 8(5)nm,为弱的配位键,其他Cu2-O 和 Cu2-N 键长在 0.194 6(3)~0.218 2(3)nm 和0.201 5(3)~0.201 7(4)nm,与 Cu1-O/N 键长相当,并与其他苹果酸铜配合物类似[23]。同样,相邻的Cu2离子间通过 L-苹果酸根桥联形成一维链(图3c)。另外,2条平行的一维链之间的菲咯啉环存在π-π相互作用(0.347 3和0.353 0 nm),以面对面的方式相互嵌入构成新颖的梯状双链超分子二维层状结构(图3d),同链的菲咯啉环及交替菲咯啉环相互平行。

表4 配合物3的部分键长(nm)与键角(°)Table 4 Selected bond lengths (nm)and angles (°)for complex 3
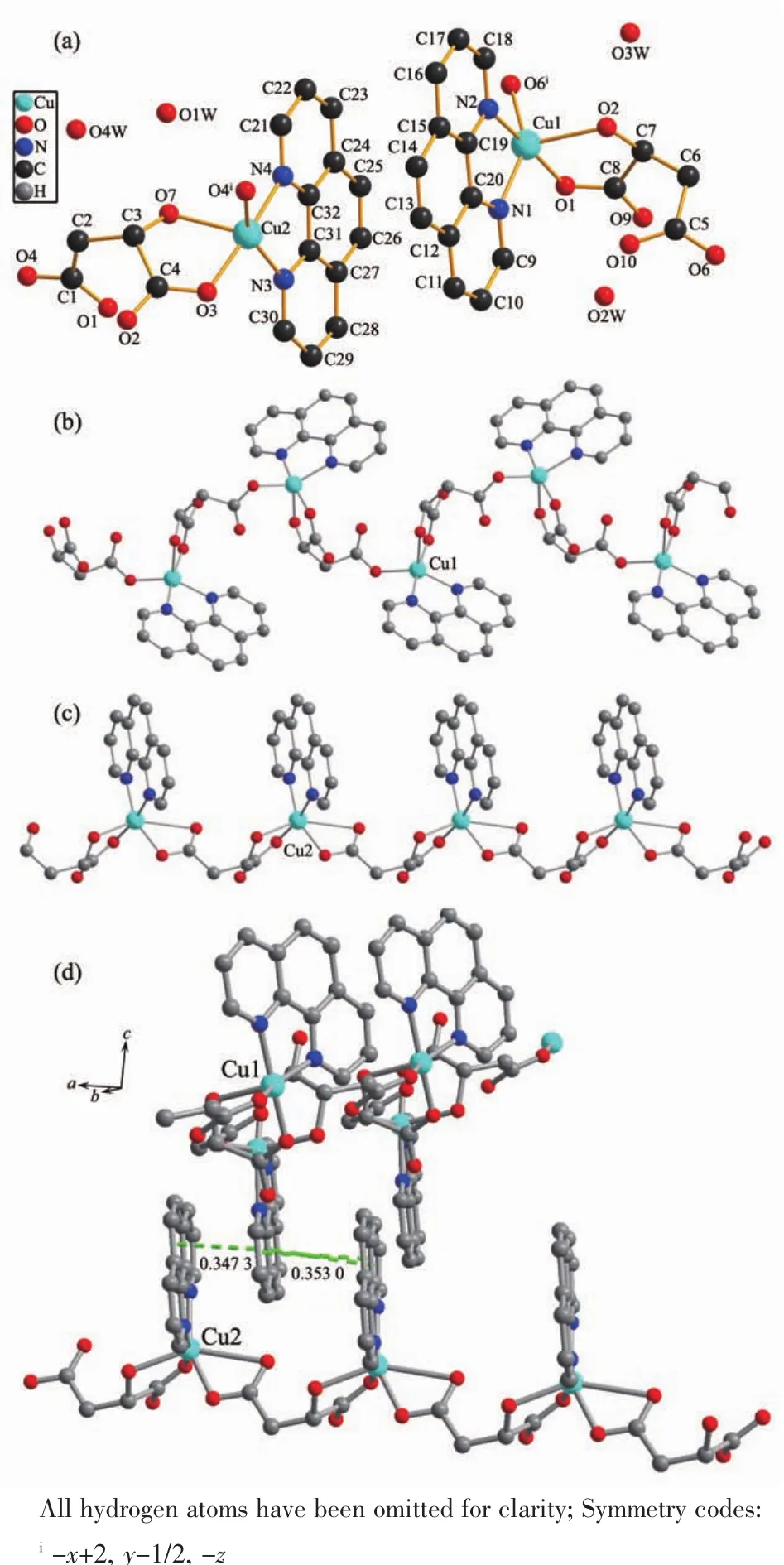
图3 (a)配合物3的分子结构;(b)配合物3的Cu1一维链;(c)配合物 3的 Cu2一维链;(d)配合物3的二维层状结构Fig.3 (a)Molecular structure of complex 3;(b)1D chain structure of Cu1 in complex 3;(c)1D chain structure of Cu2 in complex 3;(d)Noninterpenetrating layer-structure of complex 3
2.2 粉末XRD衍射
图4 为配合物1~3的粉末XRD衍射图与根据单晶结构模拟的XRD图。两者基本一致,表明合成配合物是纯相,没有杂相。

图4 配合物1~3的粉末XRD衍射图Fig.4 Powder XRD patterns of complexes 1~3
2.3 IR光谱
在配合物的红外光谱中,配合物1中2,2′-联吡啶的特征吸收峰分别出现在766和772 cm-1,与配体相比吸收向低波数方向移动,这可能是由于吡啶N原子与金属离子发生配位后,吡啶环振动减弱所致。配合物2和3菲咯啉中具有孤电子对的2个N原子参与配位,与锌原子之间形成了一个螯合五元环,配合物2和3中菲咯啉的芳环骨架振动出现在1 500 cm-1附近。
三个配合物在3 500 cm-1左右呈现的宽吸收峰归属于羟基的伸缩振动吸收带,是由于未脱氢的羟基参与配位及配合物中含有结晶水所致。在1 600和1 400 cm-1处的强吸收分别归属于羰基的不对称伸缩 νas(COO-)及对称伸缩 νs(COO-)振动;而 1 719 cm-1附近并没有出现-C=O的特征吸收峰,表明羧酸脱掉质子以酸根形式与金属离子发生配位[12]。
3 结 论
以 L-苹果酸为桥联配体,2,2′-联吡啶和菲咯啉为辅助配体,构建了3个新颖的铜、锌配合物,分别为扭曲八面体构型或者畸变三角双锥结构。配合物1中,2条平行链以面对面的方式重叠,通过吡啶环之间弱的π-π相互作用构成了新颖的梯状双链结构;配合物2中,一个不对称单元中存在2种不同配位方式的Zn离子,且Zn1在a轴方向上通过L-苹果酸根的桥联作用形成一维链结构,而Zn2仅作为一个独立的单元存在。配位物3中,通过L-苹果酸根桥联及菲咯啉的π-π弱相互作用构成新颖的梯状双链二维层状结构。
[1]Li D S,Wang Y Y,Luan X J,et al.Eur.J.Inorg.Chem.,2005(13):2678-2684
[2]Yu X Y,Fu Y,Fu J T,et al.J.Mol.Struct.,2018,1157:530-535
[3]Xu X X,Lu Y,Wang E B,et al.Inorg.Chim.Acta,2007,360(2):455-460
[4]Guo F S,Chen Y C,Liu L J,et al.Chem.Commun.,2012,48(100):12219-12221
[5]Chen L L,Tan H L,Xu F G,et al.Luminescence,2018,33(1):161-167
[6]He X,Lu C Z,Yan Y.Inorg.Chem.Commun.,2004,7(7):851-853
[7]Song Y S,Yan B,Chen Z X.J.Solid State Chem.,2006,179(12):4037-4046
[8]SUN Yin-Xia(孙银霞),ZHAO Ya-Yuan(赵亚元),LI Chun-Yu(李春宇),et al.Chinese J.Inorg.Chem.(无机化学学报),2016,32(5):913-920
[9]Park M K,Lim K S,Park J H,et al.CrystEngComm,2016,18(23):4349-4358
[10]Bing Y Y,Yu M H,Hu M.RSC Adv.,2015,5(58):47216-47224
[11]Sen S,Neogi S,Aijaz A,et al.Dalton.Trans.,2014,43(16):6100-6107
[12]LI Dong-Sheng(李 东 升 ),WANG Xiao-Yu(王 尧 宇 ),LIU Ping(刘萍),et al.Acta Chim.Sinica(化学学报),2005,63(6):550-554
[13]Xin N,Sun Y Q,Zheng Y F,et al.J.Solid State Chem.,2016,243:267-275
[14]TAN Xiong-Wen(谭雄文),LI Chang-Hong(李昶红),LI Dong-Ping(李 东 平),et al.Chinese J.Inorg.Chem.(无 机 化 学 学报),2009,25(10):1877-1881
[15]XIAO Bo-An(肖伯安),CHEN Shui-Sheng(陈水生).Chinese J.Inorg.Chem.(无机化学学报),2017,33(2):347-353
[16]Zhou Y H,Wang Z Y.Transition Met.Chem.,2015,40 (1):89-98
[17]Chowdhury M A.J.Biomed.Mater.Res.A,2017,105 (4):1184-1194
[18]SHI Juan(史娟),LI Jiang(李江),GE Hong-Guang(葛红光).Chinese J.Inorg.Chem.(无 机 化 学 学 报 ),2017,33(3):463-470
[19]Feng X,Liu L,Wang L Y,et al.J.Solid State Chem.,2013,206:277-285
[20]Kamatchi T S,Chitrapriya N,Kumar S L A,et al.RSC Adv.,2017,7(27):16428-16443
[21]Sheldrick G M.Acta Crystallogr.Sect.A:Found.Crystallogr.,2008,A64:112-122
[22]Guo Y,An H,Li Y,et al.Inorg.Chim.Acta,2004,357:4582-4586
[23]Zhang X D,Sun J Y,Zhao Z,et al.Acta Crystallogr.Sect.C:Cryst.Struct.Commun.,2006,C62:m4-m6
[24]Li Q,Hu H,Li C,et al.Chin.J.Struct.Chem.,2017,36(2):273-279
[25]Elsaidi S K,Mohamed M H,Banerjee D,et al.Coord.Chem.Rev.,2018,358:125-152
