艰难梭菌研究现状
2018-07-04肖艳艳张智洁秦晓松
肖艳艳, 张智洁, 秦晓松
(中国医科大学附属盛京医院 检验科,辽宁 沈阳 110004)
艰难梭菌(Clostridiumdifficile,CD)可以存活于正常人的肠道中,是最常见的胃肠道条件致病菌之一。患者因为应用抗菌药物等原因导致肠道菌群失调后艰难梭菌开始大量繁殖,但只有产毒艰难梭菌致病。艰难梭菌的感染率不断升高,是发达国家最常见的导致住院患者腹泻感染的原因之一[1],我国的艰难梭菌感染(Clostridiumdifficileinfection,CDI)患病率也在不断上升,同时CD还是养老院和一些健康护理机构人员感染胃肠炎的主要原因[2]。治疗艰难梭菌感染的费用巨大,一篇关于CDI疾病费用的综述研究显示,住院患者(每位患者/住院/事件/感染)平均费用为8 911~30 049美元不等[3]。然而CDI的诊断还未引起足够的重视,资料表明部分艰难梭菌感染者未被及时诊断或者被误诊,其中医生对标本送检的意识对正确诊断艰难梭菌感染格外重要[4-5]。本文对CD的致病机制、流行病学、诊断、治疗等方面进行介绍,以加深人们对于CD的理解并引起重视,从而提高CD的预防效果。
1 流行病学
导致美国公共卫生问题的病原菌中,CD的人口相关发病率高居榜首,据估计可达147/100 000[6],长期居住在护理机构中的患者流行率更高,约为1.85%[7]。每年超过40万人感染艰难梭菌,其中大约有2.9万人死亡[2]。2009年我国上海市一家医院研究发现中国住院患者CDI的患病率仅为1.7/10 000住院患者[8],而我国最近的一篇meta分析显示,我国2010年至2016年有腹泻症状的产毒CD的汇集发生率是14%[9]。我国的CDI发病率升高可能与人口老龄化以及滥用抗生素等因素有关。2002年一种新型(BI/NAP1/027型)艰难梭菌高产毒株在欧洲暴发,使得CD引起了更多的关注,该型菌株引起的临床症状更加严重,且易复发,预后较差[10]。最近几年,西欧的BI/NAP1/027发生率已经降低,因为CDI发病率降低,同时由于这个分型导致的病例也在减少,但是北美依旧有持续的BI/NAP1/027菌株存在,东欧等国家BI/NAP1/027菌株仍在持续增加[11-13]。Cheng等[14]报道了我国分别于2012年和2013年发现了2株高毒力BI/NAP1/027菌株。不同地域发病率不同,可能跟不同地区的抗生素使用情况有关。
2 艰难梭菌致病机制
艰难梭菌是一种专性厌氧菌,革兰阳性粗大杆菌,约(1.3~1.6)μm×(3.6~6.4)μm。艰难梭菌可存活于水、土壤、蔬菜、动物体内及医院环境中,其繁殖体通常在离开肠腔24 h内死亡。艰难梭菌芽胞对一般消毒措施有非常强的抵抗力,可存在于环境中数月[15],在100 ℃环境中1 h内死亡。
存活于正常人肠道中的艰难梭菌,由于抗菌药物的使用导致肠道微生物系统主要组成菌的缺失,给产毒艰难梭菌的生长创造了环境,最后导致艰难梭菌感染的发生。CD芽胞的形成和生长是决定CD毒素的重要因素。CD芽胞形成于营养物质缺乏的稳定期。CD芽胞的生长只发生于肠道下游,某种程度上,下游肠道氧浓度可以忽略不计。下游肠道存在一些物质,尤其是胆汁酸,初级胆酸可以被完整肠道系统分解成次级胆酸,次级胆酸能够抑制产毒艰难梭菌的生长。毒素A、B通过磷酸化丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)激活肠上皮细胞的核因子(factor-κB,NF-κB)和激活蛋白1(activator protein 1,AP-1),促进促炎症因子,如IL-8等的转录,破坏细胞间紧密连接和上皮细胞完整性,导致细胞骨架破坏,最后导致CDI的发生[16]。
2.1 胆汁酸的作用
胆汁酸产生于肝脏并被分泌入小肠。大多数胆汁酸都在回肠末端被重吸收,但大约有5%流入大肠。Taur等[17]研究发现初级胆酸能够刺激肠道系统艰难梭菌芽胞的产生,可导致定殖个体的艰难梭菌的生长和产毒。完整肠道微生物系统中的部分厌氧菌可以把初级胆酸转化为次级胆酸,次级胆酸能够抑制产毒艰难梭菌的生长。
2.2 毒素A、B 及二元毒素致病机制
CD菌体本身不致病,艰难梭菌通过分泌毒素A、毒素B以及二元毒素致病。艰难梭菌的毒素A、B属于大梭菌糖基化毒素(large clostridial glucosylating toxin,LCGT)[2]家族成员。毒素A、B分别由基因tcdA和tcdB编码,这两个基因位于致病性决定区(pathogenicity locus,PaLoc)。PaLoc含有5个基因,分别为tcdA、tcdB、tcdC、tcdE、tcdR[18](图1)。tcdA和tcdB距离较近,被tcdE分离。毒素A为肠毒素,可以引起肠道黏膜损伤和液体分泌;毒素B是细胞毒素,可刺激单核细胞产生炎性因子,引起炎性反应进而使肠黏膜细胞变性、凋亡甚至坏死和脱落[19]。以前的研究认为多数艰难梭菌感染是由毒素A导致的[20],但是近年来的研究表明毒素B也可以使其致病,分别只产生毒素A、B或同时产生两种毒素的艰难梭菌均可导致疾病的发生。tcdE编码一种蛋白,该蛋白可将毒素A、B从细胞内释放出来。tcdB上游是tcdR,可以正向调控tcdA和tcdB的表达。tcdA的下游是tcdC,是毒素产量的负调控基因[19]。一些菌株也产生二元毒素,也称艰难梭菌转移酶(Clostridiumdifficiletransferase,CDT),由CDT位点编码。二元毒素名称的由来是因为它由两个亚基组成,分别命名为CDTa和CDTb,是细胞产生和分泌的两个单独多肽,这些多肽结合成一个强有力的细胞毒素,即CDT[21]。粪便中检测到CD可能是产毒CD、不产毒CD或者是两者都存在[22]。不产毒CD没有PaLoc,不产生毒素。一般认为不产毒菌株与人类疾病的发生无关,但是已有研究证实PaLoc的水平转移可能导致不产毒艰难梭菌产生活性毒素[23]。此外,目前还有很多国家已经陆续发现了BI/NAP1/027高产毒菌株,该菌株除产生 A、B 毒素外,还产生CDT,而且产A毒素的量约为普通菌株的16倍,产B毒素量约为普通菌株的23倍,有更强的致病性,可以导致更高的死亡率[24]。
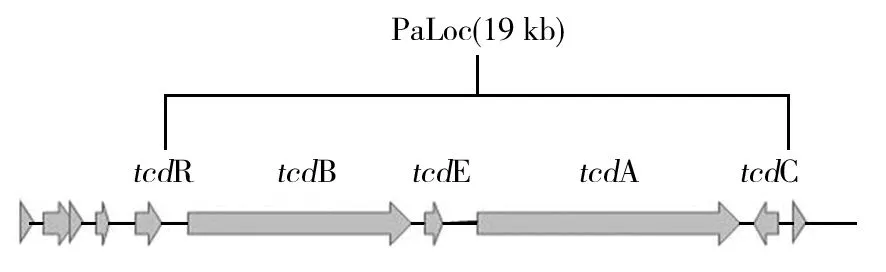
图1 艰难梭菌致病决定区[18]Fig.1 The PaLoc of Clostridium difficile[18]
3 危险因素
医院相关性艰难梭菌感染(hospital-associatedClostridiumdifficileinfections,HA-CDIs)被认为是CDI的主要原因,近年来研究显示社区获得性艰难梭菌感染率(community-acquiredClostridiumdifficileinfection,C-CDI)正在上升[25-26],Penit等[27]关于C-CDI的横断面研究提示我们低估了C-CDI的发生率和影响,而且抗菌药物的不合理使用也会促进C-CDI的发生,Reigadas等[28]提到C-CDI和低龄化是临床CDI未能被诊断的危险因素。长期看护机构(long-term care facilities,LTCFs)的CDI发生率也在不断增加[29-30]。
长期医疗机构的环境污染是CDI的危险因素,长期医疗中心的细菌传播主要是由于环境中存在细菌[31]。其他可能导致CDI的危险因素包括:①抗菌药物的不合理使用:目前为止最常见的抗菌药物包括广谱头孢菌素类、氟喹诺酮类和克林霉素。Slimings等[32]的meta分析显示克林霉素和三代头孢菌素是导致CDI的最高危因素。一些健康个体在之前没有应用抗生素的情况下也会感染CDI[33]。②年龄>65岁:高龄患者肠道免疫功能减退,肠道微生态容易发生紊乱,导致CD易于繁殖。老年是CDI发展、复发和死亡的主要危险因素之一[34]。Shorr等[35]对美国参加医疗保险且大于65岁的老年人进行了一项回顾性队列研究,研究显示老年人在发生CDI的这一年的死亡率和费用增加。③应用质子泵抑制剂(proton pump inhibitor,PPI):Roughead等[36]的meta分析显示使用PPI是CDI的一个可控的危险因素,临床医师在治疗有此危险因素的CDI时应考虑PPI对CDI的影响。④之前有CDI病史。⑤机体存在免疫抑制(包括恶性肿瘤和器官移植等因素)[37]。Falcone等[38]第一次提出男性也是CDI的危险因素之一。
4 艰难梭菌感染的临床表现
CDI的临床表现可以从无症状定殖到严重的伪膜性肠炎(pseudomembranous colitis,PMC)、中毒性巨结肠甚至死亡。病人感染艰难梭菌后常表现为腹泻(≥3次/24 h),腹泻可为水样便、黏液便、黏液血便,罕见大量血便,常伴有腹痛、发热或外周血白细胞增高。根据临床表现可以分为轻中度CDI、重度CDI以及复杂性CDI[39]。
5 艰难梭菌的检测
5.1 产毒菌株检测
5.1.1 核酸扩增试验(nucleic acid amplification tests,NAATs) NAATs包括单重PCR(monoplex polymerase chain reaction)、多重PCR(multiplex polymerase chain reaction)等。检测毒素基因有很好的准确性,单重PCR敏感性为0.86~0.92,特异性为0.94~0.97,多重PCR敏感性为0.68~1.00,特异性为0.92~1.00[40]。但高敏感性PCR方法也存在假阳性的可能性[41],即只应用PCR方法可能会把正常定殖的艰难梭菌误认为CDI。
5.1.2 粪便培养 将标本接种于环丝氨酸-头孢西丁-果糖琼脂(cycloserine-cefoxitin fructose agar,CCFA)选择性培养基、厌氧血平板等培养基上进行培养,24~48 h后观察平板是否有可疑菌落。粪便培养简单易行,价格低廉,单纯的细菌培养不能用于CD的诊断,只能用于进行菌株分型、细菌耐药等进一步检测[39]。
5.1.3 产毒菌株的培养(cytotoxigenic culture,CC) CC是检测艰难梭菌的参考方法之一。首先将收集到的粪便与无水乙醇充分混合1 h,去除杂菌,而在这个过程中有芽胞的艰难梭菌可以存活。将标本接种于CCFA选择性培养基,在厌氧条件下培养48 h,通过在体外环境下对可疑菌落进行细胞毒素试验(the cell cytotoxicity assay,CCTA)等检测来验证菌株是否具有产毒能力。产毒菌株的培养在方法学等方面也存在很多不同之处,包括培养条件的不同以及如何检测艰难梭菌是否在体外产毒等。由于CC和NAATs存在很好的关联性,可作为CDI诊断的金标准[42],但CC也存在着不足之处,通常其检测时间需要5 d左右,不能及时为临床用药提供参考。
5.1.4 艰难梭菌谷氨酸脱氢酶(glutamate dehydrogenase, GDH)的检测 GDH是一种由gluD编码的代谢酶,在产毒和不产毒艰难梭菌菌株都高度表达。GDH的检测具有较高的敏感性和阴性预测值(negative predictive value,NPV)[43-45],因此经常被作为艰难梭菌初筛实验,阴性结果即可排除艰难梭菌感染,阳性结果须进一步检测,检测方法包括毒素EIAs或者应用分子方法检测毒素基因。GDH检测的优点是检测时间短、费用低。
5.2 CD毒素检测
5.2.1 细胞毒素试验(the cell cytotoxicity assay,CCTA) CCTA用于检测粪便中的CD毒素。将细胞(通常是Vero细胞)培养于粪便滤液中,分别于24 h和48 h镜下观察是否产生细胞病变效应(cytopathic effect,CPE),若产生CPE,再加入特定的抗毒素进行细胞毒素中和实验以验证实验的准确性。该实验方法需要专业细胞培养技术,周期长,并且在CCTA临床确切方法的确定以及细胞系的使用和粪便的过滤、稀释等方面都存在尚待统一的问题,因此很少在临床应用。CCTA被看作是金标准[42],因为与无腹泻的病人相比,CCTA阳性的病人有更严重的后果。一项前瞻性多中心研究的试验结果显示,CCTA是诊断CDI的参考方法,即CCTA阳性提示腹泻症状是由CDI所致[40]。
5.2.2 A/B毒素的免疫学检测(A/B enzyme immunoassays, A/B EIAs) 近几年,毒素A/B的检测由于检测费用低、耗时短且易于操作等优点而成为实验室诊断CDI最常用的检测方法。该方法通过检测艰难梭菌的A、B毒素来确定被检者是否存在CDI。因为部分艰难梭菌不产生毒素A,故现在临床实验室中要求同时检测毒素A和毒素B。Planche等[46]总结了早期实验中此项检测方法的敏感度波动于69%~99%,特异度波动于94%~100%,因此不支持A/B EIAs作为CDI的独立诊断手段。陈日炳等[47]运用A/B EIAs方法同时检测粪便和血液中艰难梭菌的表达情况,研究结果提示检测血清中艰难梭菌毒素A、B对诊治艰难梭菌感染腹泻的患者有一定的意义,但在临床实验中检测血液中艰难梭菌表达情况还有待进一步的研究。
5.3 联合检测
到目前为止还没有可以单独检测艰难梭菌的方法,因此现在多推荐应用两步法或者三步法进行检测[48]。使用不适合的检测方法组合可能导致医院内CDI的假爆发,导致很多假阳性病例。这种诊断浪费医院资源,也影响病人的治疗,此外应用一种敏感度低的方法来诊断CDI会增加医院中艰难梭菌的传播。因此应在临床实践中寻找一种敏感性高、阴性预测值较高的试验作为检测的第一步,阳性结果再进行特异度较高的筛查试验,以期提高结果准确性。
5.3.1 两步法 两步法是应用GDH检测作为初筛试验,阴性标本即可报告阴性结果,GDH阳性标本再应用CC、A/B EIAs或NAATs等方法进行进一步的确证实验,相应的结果即可报告临床。该法的优点之一是如果标本为GDH检测阴性,即可报告结果,节省了检测时间和检测成本,具体流程见图2。欧洲临床微生物和疾病感染协会(European Society of Clinical Microbiology and Infectious Diseases,ESCMID)[49]提出了另一种两步法诊断策略,即对临床标本同时进行GDH和A/B EIAs检测,全阳性结果即可认为标本为CDI阳性,全阴性结果即可认为标本为CDI阴性,对于GDH阳性、A/B EIAs阴性的结果需应用NAATs或CCTA等方法进行确证试验,阴性结果可排除CDI诊断,阳性结果需进行临床评估,以确认患者是CDI或CD携带者(图3)。国际上也推荐应用NAATs进行初筛,阴性结果即可确诊为阴性,阳性结果再应用A/B EIAs进行确证[50]。GDH检测快速,价格低廉,因此该法在临床两步法中应用最广,但特异度不高;NAATs较GDH试验特异度高,但NAATs价格更昂贵,且可能存在过度诊断的可能性,使用 PCR 法检测 CDI 的机构降低了病人隔离、安排检查和经验性抗生素疗法等的时间。
5.3.2 三步法 三步法也是应用GDH作为初筛试验,阴性标本即可报告阴性结果,阳性标本进行A/B EIAs检测,对于A/B EIAs阴性的标本进行NAATs等检测方法进行最后的确证实验。该法也是保证临床结果准确性的实验策略之一,见图4。
5.4 各种方法性能比较
艰难梭菌检测方法比较见表1。临床不仅要对有临床检测要求的标本进行CD检测,还应对临床所有不成形便进行艰难梭菌的筛查检测[51],以减少艰难梭菌的漏检,提高临床CDI的确诊率。对于腹泻患者,不推荐对患者进行重复送检,因为重复送检并不会提高诊断的正确率,反而会给患者增加医疗负担。目前推荐两步法或者三步法进行组合检测,而单一检测方法中NAATs的准确率相对最高[49]。

图2 两步法流程图Fig.2 The two-step flow chart

图3 两步法流程图Fig.3 The two-step flow chart
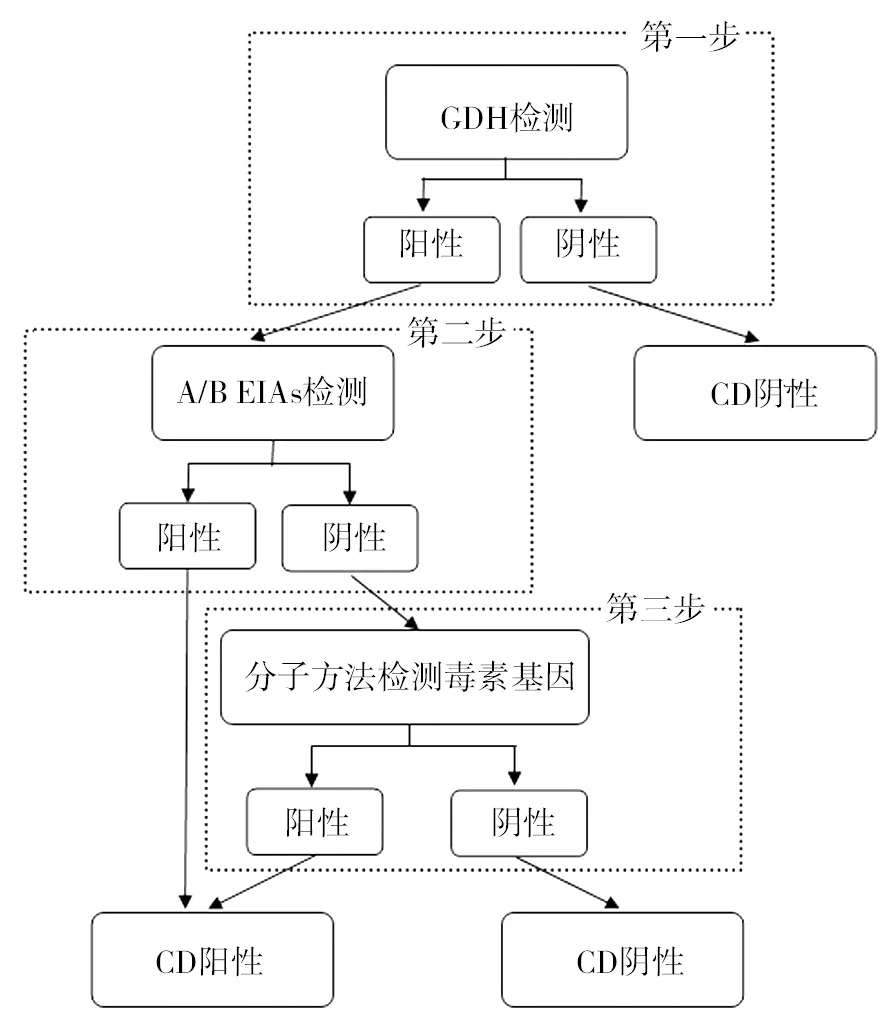
图4 三步法流程图Fig.4 The three-step flow chart

表1 艰难梭菌检测方法比较(修改自Surawicz等文献)[39]Table 1 Comparison of the detection methods of clostridium difficile (modified from Surawicz etc.[39])
注:a:粪便培养见可疑菌落后需进一步鉴定,因此粪便培养法无敏感度和特异度
6 艰难梭菌的治疗
6.1 药物治疗
6.1.1 抗菌药物治疗 甲硝唑和万古霉素是目前治疗CDI的一线用药,甲硝唑对厌氧革兰阳性、阴性杆菌和球菌都有较强的抗菌作用,价格低,疗效迅速确切。万古霉素抗菌谱较窄,对革兰阳性球菌和革兰阳性杆菌有较强的杀菌作用,对CD的作用尤为显著,是治疗艰难梭菌相关性腹泻的首选药物,但价格较贵。CDI的治疗时间一般是10~14 d。美国胃肠病学会[39]以及欧洲临床微生物学和传染病学会[52]等推荐应用甲硝唑治疗成人首发或首次复发的轻、中度CDI;严重、多次复发和对甲硝唑耐药的CDI成人患者口服万古霉素进行治疗;严重、复杂CDI应用万古霉素口服和万古霉素静脉输液,以及万古霉素配伍生理盐水灌肠进行治疗。万古霉素和甲硝唑的不足之处在于两者的抗菌谱较宽,同时应用两种药物后易导致肠道紊乱,导致治愈的CDI患者有相当高的复发率[53]。
6.1.2 非达霉素 2011 年非达霉素成为治疗CDI相关性腹泻的第三种药物[39],与万古霉素相比,非达霉素可以减少CDI复发率[54],原因可能是非达霉素不影响正常的结肠菌群[55]。非达霉素只能口服给药,药物价格较昂贵,适合应用于复发或者严重CDI患者[56]。
6.1.3 新型抗菌药物 目前Ridinilazole、Surotomycin、Cadazolid等几种窄谱抗菌药物都在进行临床试验,可能对CDI的治疗有益处[54]。Wilcox等[57]对2 655名成年人进行了两个双盲、随机、安慰剂对照试验,结果显示,Bezlotoxumab与安慰剂相比有更低的复发率,同时与安慰剂有相似的安全性,提示Bezlotoxumab也是治疗CDI的可期待药物之一。在甲硝唑、万古霉素以及非达霉素治疗失败或粪便微生物移植(faecal microbiota transplantation,FMT)不可用或者被禁用的情况下,可以应用Rifaximin进行治疗[58]。
6.2 外科治疗
美国胃肠病学会推荐对所有复杂CDI的患者均应该进行外科会诊。复杂CDI患者伴有下列任何一种 CDI 继发性表现时应考虑外科治疗:低血压需要血管升压素治疗,败血症和器官衰竭表现、意识改变、WBC≥50 000/μL、乳酸≥5 mmol/L或内科连续治疗5 d后未见好转。严重复杂CDI已经明确的外科手术方式为结肠次全切除术加回结肠造口术。在患者发展到休克或器官衰竭之前,早期外科干预可以提高患者生存率[39]。
6.3 粪便微生物移植(faecal microbiota transplantation,FMT)
把健康个体的粪便植入患者体内,通过移植健康人的粪便使患病个体建立起正常的肠道菌群从而治疗CDI。近日,由来自10余个国家28位专家提出的关于FMT的欧洲会议共识推荐应用FMT治疗轻度或严重复发CDI(recurrence clostridium difficile infection,rCDI),并对FMT临床应用的具体问题进行了阐述,包括FMT的适应症、粪便捐献者的选择等问题[59]。rCDI患者的菌群比例失衡,通过外来供者的粪便引入正常菌群能改变这种情况,恢复菌群活性,FMT的治愈率可达80%[60]。另一种方法不是通过置换肠道菌群,而是通过应用不产毒CD菌株取代产毒CD菌株,从而预防产毒菌株导致的CD定殖和出现的临床症状。具体方法是口服不产毒CD菌株(a single M3 strain of nontoxigenicC.difficile,NTCD M3)[61-62],抑制产毒CD的生长,从而达到治疗CDI的目的。甲硝唑和万古霉素是治疗CD的一线用药,但有一定的复发率。相比之下,非达霉素可以减少CDI复发率,因此可能成为CDI的首选药物。FMT是近年来的研究热点,最近发表的欧洲会议共识推荐应用FMT治疗轻度或严重rCDI。
7 艰难梭菌的预防
患者和医务工作者都可能是CD无症状携带者,可在医院引起较为广泛的水平传播,导致CDI的发生,因此应及时、早期制定医院整体的感染控制计划。美国感染控制流行病学专业协会(Association for professionals in infection control & epidemology,APICE)[63]推荐几种监管措施:①仔细分辨高风险患者,包括最近使用抗菌药物、抗肿瘤化疗、年龄≥65 岁、最近住院、曾经在健康护理中心居住、既往患有CDI病史等。②提倡选择最优的检测策略,以期快速、准确地检测CD。③加强医务工作人员对CD的了解,对CD阳性结果采取及时的治疗和预防措施。
合理使用抗菌药物。抗菌药物滥用毫无疑问是导致CDI最常见的危险因素,目前陆续出现了对甲硝唑和万古霉素耐药的菌株,因此应重视CDI患者抗菌药物的应用。美国结肠和直肠外科医师协会推荐一旦发现CDI,应尽早停用相关抗菌药物,但应注意诊断个体化[64]。
加强感染情况的监测和对全体医务人员的教育。进入已知或怀疑为 CDI 患者房间的医务人员或探视者,应及时戴手套、穿隔离衣等。手卫生是预防院内感染的基础,应该保持手部卫生。医务人员手卫生消毒措施主要是皂液常规洗手和快速手消毒剂消毒,这对多数致病微生物均有明显清除效果,郭凤玲等[65]对比了5 种临床消毒方法,认为普通肥皂液、抗菌肥皂液六步洗手法能有效杀灭医务人员手部的CD。同时也应对患者进行宣传教育,使其了解勤洗手在预防疾病方面的重要性。使用一次性的物品可以预防CDI的传播。CDI患者使用过的物品应彻底消毒。
8 展 望
不同地区CDI的发病率不同,且治疗CDI存在较高的经济负担。尽管在药物治疗和感染监控等方面都有较大提高,但是CDI的并发症,如中毒性巨结肠等依然在持续增加,主要原因是治疗失败和感染复发,因此临床治疗方案的选择是临床医生应该密切关注的问题。rCDI的经济负担同样不容忽视,因为rCDI可导致住院时间延长、再住院等。欧美等国家都相继报道了C-CDI的发生,我国还没有系统的关于C-CDI的报道,这可能与我国的就医制度有关。关于C-CDI的发生是否只发生于社区还是与医院相关,目前还没有统一的说法,有待于进一步的关注和证实。
CDI 的治疗是近年来的研究热点,不断有新的药物和其他治疗方式被提出。FMT被推荐用于治疗成人CDI,因为有充足的证据表明应用FMT治疗CDI是有益的。在临床工作中,FMT的应用还存在一些实践性的问题有待解决和达成共识,但FMT具有非常高的应用前景。CDI已经越来越引起世界各国的关注,结合我国人口众多、抗菌药物不合理使用情况严重、人口老龄化加快、医疗卫生条件仍有待改善的基本情况,我国更应加强对艰难梭菌的诊治、预防工作。未来针对CDI的检测将向快速、特异和精准诊断的方向发展,以期及时早期治疗CDI,减轻患者痛苦及社会负担。
参考文献:
[1] Reigadas E, Alcala L, Marin M, et al. Clinical significance of direct cytotoxicity and toxigenic culture inClostridiumdifficileinfection[J]. Anaerobe, 2016, 37:38-42.
[2] Culligan EP, Sleator RD. Advances in the Microbiome: Applications toClostridiumdifficileInfection[J]. J Clin Med, 2016, 5(9):83-102.
[3] Nanwa N, Kendzerska T, Krahn M, et al. The economic impact ofClostridiumdifficileinfection: a systematic review[J]. Am J Gastroenterol, 2015, 110(4): 511-519.
[4] Bouza E, Alcala L, Reigadas E. Optimizing the diagnostic testing ofClostridiumdifficileinfection[J]. Expert Rev Anti Infect Ther, 2016, 14(9): 801-808.
[5] Alcala L, Reigadas E, Marin M, et al. Impact of clinical awareness and diagnostic tests on the underdiagnosis ofClostridiumdifficileinfection[J]. Eur J Clin Microbiol Infect Dis, 2015, 34(8): 1515-1525.
[6] Lessa FC, Mu Y, Bamberg WM, et al. Burden ofClostridiumdifficileinfection in the United States[J]. N Engl J Med, 2015, 372(9): 825-834.
[7] Ziakas PD, Joyce N, Zacharioudakis IM, et al. Prevalence and impact ofClostridiumdifficileinfection in elderly residents of long-term care facilities, 2011: A nationwide study[J]. Medicine (Baltimore), 2016, 95(31): 4187-4195.
[8] Huang H, Fang H, Weintraub A, et al. Distinct ribotypes and rates of antimicrobial drug resistance inClostridiumdifficilefrom Shanghai and Stockholm[J]. Clin Microbiol Infect, 2009, 15(12): 1170-1173.
[9] Tang C, Cui L, Xu Y, et al. The incidence and drug resistance ofClostridiumdifficileinfection in Mainland China: a systematic review and meta-analysis[J]. Sci Rep, 2016, 6:37865.
[10] Bauer MP, Notermans DW, Van Benthem BH, et al.Clostridiumdifficileinfection in Europe: a hospital-based survey[J]. Lancet, 2011, 377(9759): 63-73.
[11] Camacho-Ortiz A, Lopez-Barrera D, Hernandez-Garcia R, et al. First report ofClostridiumdifficileNAP1/027 in a Mexican hospital[J]. PLoS One, 2015, 10(4): e0122627.
[12] Tenover FC, Akerlund T, Gerding DN, et al. Comparison of strain typing results forClostridiumdifficileisolates from North America[J]. J Clin Microbiol, 2011, 49(5): 1831-1837.
[13] Davies KA, Longshaw CM, Davis GL, et al. Underdiagnosis ofClostridiumdifficileacross Europe: the European, multicentre, prospective, biannual, point-prevalence study ofClostridiumdifficileinfection in hospitalised patients with diarrhoea (EUCLID)[J]. Lancet Infect Dis, 2014, 14(12): 1208-1219.
[14] Cheng JW, Xiao M, Kudinha T, et al. The First TwoClostridiumdifficileRibotype 027/ST1 Isolates Identified in Beijing, China-an Emerging Problem or a Neglected Threat?[J]. Sci Rep, 2016, 6:18834.
[15] Kim KH, Fekety R, Batts DH, et al. Isolation ofClostridiumdifficilefrom the environment and contacts of patients with antibiotic-associated colitis[J]. J Infect Dis, 1981, 143(1): 42-50.
[16] Abt MC, Mckenney PT, Pamer EG.Clostridiumdifficilecolitis: pathogenesis and host defence[J]. Nat Rev Microbiol, 2016, 14(10): 609-620.
[17] Taur Y, Pamer EG. Harnessing microbiota to kill a pathogen: Fixing the microbiota to treatClostridiumdifficileinfections[J]. Nat Med, 2014, 20(3): 246-247.
[18] Rupnik M, Wilcox MH, Gerding DN.Clostridiumdifficileinfection: new developments in epidemiology and pathogenesis[J]. Nat Rev Microbiol, 2009, 7(7): 526-536.
[19] Voth DE, Ballard JD.Clostridiumdifficiletoxins: mechanism of action and role in disease[J]. Clin Microbiol Rev, 2005, 18(2): 247-263.
[20] Pruitt RN, Lacy DB. Toward a structural understanding ofClostridiumdifficiletoxins A and B[J]. Front Cell Infect Microbiol, 2012, 2:28.
[21] Burnham CA, Carroll KC. Diagnosis ofClostridiumdifficileinfection: an ongoing conundrum for clinicians and for clinical laboratories[J]. Clin Microbiol Rev, 2013, 26(3): 604-630.
[22] Shim JK, Johnson S, Samore MH, et al. Primary symptomless colonisation byClostridiumdifficileand decreased risk of subsequent diarrhoea[J]. Lancet, 1998, 351(9103): 633-636.
[23] Brouwer MS, Roberts AP, Hussain H, et al. Horizontal gene transfer converts non-toxigenicClostridiumdifficilestrains into toxin producers[J]. Nat Commun, 2013, 4:2601.
[24] O'connor JR, Johnson S, Gerding DN.Clostridiumdifficileinfection caused by the epidemic BI/NAP1/027 strain[J]. Gastroenterology, 2009, 136(6): 1913-1924.
[25] Khanna S, Pardi DS, Aronson SL, et al. The epidemiology of community-acquiredClostridiumdifficileinfection: a population-based study[J]. Am J Gastroenterol, 2012, 107(1): 89-95.
[26] Lteif L. The Daniel K. Inouye College of Pharmacy Scripts: Updates onClostridiumdifficileInfection: Advances in Laboratory Testing to Aid Diagnosis and Treatment[J]. Hawaii J Med Public Health, 2017, 76(2): 59-64.
[27] Penit A, Bemer P, Besson J, et al. Community-acquiredClostridiumdifficileinfections[J]. Med Mal Infect, 2016, 46(3): 131-139.
[28] Reigadas E, Alcala L, Marin M, et al. Missed diagnosis ofClostridiumdifficileinfection; a prospective evaluation of unselected stool samples[J]. J Infect, 2015, 70(3): 264-272.
[29] Garg S, Mirza YR, Girotra M, et al. Epidemiology ofClostridiumdifficile-associated disease (CDAD): a shift from hospital-acquired infection to long-term care facility-based infection[J]. Dig Dis Sci, 2013, 58(12): 3407-3412.
[30] Ohji G, Okumoto S, Nishimura S, et al.Clostridiumdifficileinfection at outpatient clinic without known risk factors - CDI can be antibiotic-unassociated diarrhea in outpatient setting[J]. International Journal Of Infectious Diseases, 2016, 45:145-145.
[31] Hunter JC, Mu Y, Dumyati GK, et al. Burden of Nursing Home-OnsetClostridiumdifficileInfection in the United States: Estimates of Incidence and Patient Outcomes[J]. Open Forum Infect Dis, 2016, 3(1): ofv196.
[32] Slimings C, Riley TV. Antibiotics and hospital-acquiredClostridiumdifficileinfection: update of systematic review and meta-analysis[J]. J Antimicrob Chemother, 2014, 69(4): 881-891.
[33] Surawicz CM.Clostridiumdifficileinfection: risk factors, diagnosis and management[J]. Curr Treat Options Gastroenterol, 2015, 13(1): 121-129.
[34] Mizusawa M, Doron S, Gorbach S.ClostridiumdifficileDiarrhea in the Elderly: Current Issues and Management Options[J]. Drugs Aging, 2015, 32(8): 639-647.
[35] Shorr AF, Zilberberg MD, Wang L, et al. Mortality and Costs inClostridiumdifficileInfection Among the Elderly in the United States[J]. Infect Control Hosp Epidemiol, 2016, 37(11): 1331-1336.
[36] Roughead EE, Chan EW, Choi NK, et al. Proton pump inhibitors and risk ofClostridiumdifficileinfection: a multi-country study using sequence symmetry analysis[J]. Expert Opin Drug Saf, 2016, 15(12): 1589-1595.
[37] Nissle K, Kopf D, Rosler A. Asymptomatic and yet C. difficile-toxin positive? Prevalence and risk factors of carriers of toxigenicClostridiumdifficileamong geriatric in-patients[J]. BMC Geriatr, 2016, 16(1): 185.
[38] Falcone M, Iraci F, Raponi G, et al. Nursing home residence is associated with spread ofClostridiumdifficileribotype 027 in central Italy[J]. J Hosp Infect, 2016, 94(2): 201-203.
[39] Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention ofClostridiumdifficileinfections[J]. Am J Gastroenterol, 2013, 108(4): 478-498.
[40] Planche TD, Davies KA, Coen PG, et al. Differences in outcome according toClostridiumdifficiletesting method: a prospective multicentre diagnostic validation study of C difficile infection[J]. Lancet Infect Dis, 2013, 13(11): 936-945.
[41] Murad YM, Perez J, Nokhbeh R, et al. Impact of polymerase chain reaction testing onClostridiumdifficileinfection rates in an acute health care facility[J]. Am J Infect Control, 2015, 43(4): 383-386.
[42] Planche T, Wilcox M. Reference assays forClostridiumdifficileinfection: one or two gold standards?[J]. J Clin Pathol, 2011, 64(1): 1-5.
[43] Cheng JW, Xiao M, Kudinha T, et al. The Role of Glutamate Dehydrogenase (GDH) Testing Assay in the Diagnosis ofClostridiumdifficileInfections: A High Sensitive Screening Test and an Essential Step in the Proposed Laboratory Diagnosis Workflow for Developing Countries like China[J]. PLoS One, 2015, 10(12): e0144604.
[44] Culbreath K, Ager E, Nemeyer RJ, et al. Evolution of testing algorithms at a university hospital for detection ofClostridiumdifficileinfections[J]. J Clin Microbiol, 2012, 50(9): 3073-3076.
[45] Shin BM, Lee EJ, Moon JW, et al. Evaluation of the VIDAS glutamate dehydrogenase assay for the detection ofClostridiumdifficile[J]. Anaerobe, 2016, 40:68-72.
[46] Planche T, Wilcox MH. Diagnostic pitfalls inClostridiumdifficileinfection[J]. Infect Dis Clin North Am, 2015, 29(1): 63-82.
[47] 陈日炳, 李小峰, 胡琴, 等. 血清中艰难梭菌毒素A&B检测在腹泻诊断中的应用[J]. 国际检验医学杂志, 2015, 36(24): 3641-3643.
[48] Alcala L. Laboratory tests for diagnosis ofClostridiumdifficileinfection: past, present, and future[J]. Enferm Infecc Microbiol Clin, 2013, 31(2): 65-67.
[49] Crobach MJ, Planche T, Eckert C, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document forClostridiumdifficileinfection[J]. Clin Microbiol Infect, 2016, 22 Suppl 4:S63-81.
[50] Martin JS, Monaghan TM, Wilcox MH.Clostridiumdifficileinfection: epidemiology, diagnosis and understanding transmission[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(4): 206-216.
[51] Wilcox MH. Preface:ClostridiumdifficileInfection[J]. Infect Dis Clin North Am, 2015, 29(1): xiii-xiv.
[52] Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document forClostridiumdifficileinfection[J]. Clin Microbiol Infect, 2014, 20 Suppl 2:1-26.
[53] Stevens VW, Nelson RE, Schwab-Daugherty EM, et al. Comparative Effectiveness of Vancomycin and Metronidazole for the Prevention of Recurrence and Death in Patients WithClostridiumdifficileInfection[J]. JAMA Intern Med, 2017, 177(4):546-553
[54] Kociolek LK, Gerding DN. Breakthroughs in the treatment and prevention ofClostridiumdifficileinfection[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(3): 150-160.
[55] Epstein L, Golan Y. Fidaxomicin, a new treatment forClostridiumdifficileinfections[J]. Drugs Today (Barc), 2012, 48(2): 101-108.
[56] Nathwani D, Cornely OA, Van Engen AK, et al. Cost-effectiveness analysis of fidaxomicin versus vancomycin inClostridiumdifficileinfection[J]. J Antimicrob Chemother, 2014, 69(11): 2901-2912.
[57] Wilcox MH, Gerding DN, Poxton IR, et al. Bezlotoxumab for Prevention of RecurrentClostridiumdifficileInfection[J]. N Engl J Med, 2017, 376(4): 305-317.
[58] Trubiano JA, Cheng AC, Korman TM, et al. Australasian Society of Infectious Diseases updated guidelines for the management ofClostridiumdifficileinfection in adults and children in Australia and New Zealand[J]. Intern Med J, 2016, 46(4): 479-493.
[59] Cammarota G, Ianiro G, Tilg H, et al. European consensus conference on faecal microbiota transplantation in clinical practice[J]. Gut, 2017, 66(4):569-580.
[60] Stallmach A.Clostridiumdifficileinfection : What is currently available for treatment?[J]. Internist (Berl), 2016, 57(12): 1182-1190.
[61] Villano SA, Seiberling M, Tatarowicz W, et al. Evaluation of an oral suspension of VP20621, spores of nontoxigenicClostridiumdifficilestrain M3, in healthy subjects[J]. Antimicrob Agents Chemother, 2012, 56(10): 5224-5229.
[62] Gerding DN, Meyer T, Lee C, et al. Administration of spores of nontoxigenicClostridiumdifficilestrain M3 for prevention of recurrentC.difficileinfection: a randomized clinical trial[J]. Jama, 2015, 313(17): 1719-1727.
[63] Carrico R,Archibald L,Bryant K,et al.Guide to the Elimination of Clostridium diffcile in Heal thcare Settings[J].APIC,2008,46(1):xvii-xviii.
[64] Steele SR, Mccormick J, Melton GB, et al. Practice parameters for the management ofClostridiumdifficileinfection[J]. Dis Colon Rectum, 2015, 58(1): 10-24.
[65] 郭凤玲, 温世宝, 胡旻, 等. 5种手卫生方法对艰难梭菌清除效果比较[J]. 中国消毒学杂志, 2015, 32(7): 737-738.
