介入栓塞联合射频消融治疗肝巨大局灶性结节性增生的疗效评价
2018-07-04王勋,王松,罗英,段峰,姜凯
王 勋,王 松,罗 英,段 峰,姜 凯
解放军总医院,北京 100853 1肝胆外科;2介入放射科
肝局灶性结节性增生(focal nodular hyperplasia,FNH)是一种少见的肝良性肿瘤,其病理特征为病灶中央可见星状瘢痕样纤维组织,形成间隔并向四周放射而分隔肿块;纤维组织底部可见异常变粗的动脉,纤维间隔内含有增生的胆管及血管。肝细胞形态正常,并围绕富于胆管和血管的纤维结缔组织间隔生长,间隔内有单核细胞浸润,并可见Kupffer细胞;失去正常肝小叶结构时,胆管往往失去正常形态,其发病率常低于1%[1]。由于其发病率较低,且与肝血管瘤(hepatic hemangioma)、肝细胞肝癌(hepatocellular carcinoma,HCC)、肝腺瘤(hepatocellular adenoma,HCA)等肝良、恶性肿瘤鉴别困难,常误诊。FNH不发生恶变,有时很难与高分化肝细胞癌、肝腺瘤或肝血管瘤相鉴别,是否需要外科手术也存在争议[2]。有学者建议手术指征为患者临床症状明显、病灶短期内显著增大或病灶内出血、与HCA及HCC等肿瘤难以鉴别;由于孕期激素水平变化可能会对肿瘤造成影响,对于诊断较为明确的育龄期女性也建议积极手术治疗[3]。传统观点认为,当肿瘤直径>5 cm且存在临床症状时,存在外科手术指征。
介入栓塞术和射频消融术作为目前肝实体肿瘤的重要治疗手段,已经在肝癌、肝血管瘤等实体肿瘤中被证实为安全、有效,并具有微创的优势[4-11]。本研究总结本院肝胆外科采用介入栓塞术联合腹腔镜辅助超声引导下射频消融术治疗肝巨大局灶性结节性增生的经验,并评价其可行性、安全性及有效性。
资料和方法
1 资料 收集2015年4月- 2017年6月本院肝胆外科收治的巨大FNH(最大径≥10 cm)7例的临床资料。所有患者均经穿刺活检证实为FNH。其中男性3例,女性4例,年龄19 ~ 45(30.3±8.8)岁。所有患者均为单发巨大FNH,最大径10 ~ 13(10.5±0.96) cm,且存在不同程度的腹胀或肝酶升高等临床症状。
2 手术适应证评估 1)经麻醉科评估后认为可耐受该手术;2)术前肝功能为Child-Pugh A级;3)患者及家属自愿选择该手术方式治疗FNH。排除标准:1)肝功能不佳,为Child-Pugh B-C级;2)经穿刺病理诊断不明确,不排除其他肿瘤性病变可能;3)病人家属拒绝该治疗方式。
3 手术方法 入院后完善术前准备后行肝动脉栓塞 (transcatheter arterial embolization,TAE)治 疗,采用改良Seldinger技术穿刺右侧股动脉,导入4F动脉鞘,插入4F导管依次行肠系膜上动脉、腹腔动脉造影后,观察病灶供血动脉、异常血窦显影形态范围、有无动静脉瘘、门静脉有无供血,据FNH染色范围估计栓塞剂用量。为避免异位栓塞,该组病例全部采用微导管行超选择插管。在路径图指引下,将3F同轴微导管超选择性插管至肝动脉FNH供血动脉分支进行栓塞,在注射碘油过程中,实时透视观察,防止碘油乳剂在正常组织中沉积。在栓塞剂流入缓慢时,注入明胶海绵颗粒10余粒。观察患者无不适,撤出导管,结束手术。在栓塞完成2 d后,行腹部CT平扫检查,观察栓塞效果,如瘤体填充满意,一般在栓塞完成后1周内行射频消融术;如不满意1周内再次按上述方法行栓塞治疗1次。射频消融仪为Cool-tipTM RF ablation system(Valleylab,USA),消融针选择集束射频消融针。行射频消融术时,患者全部采用平卧右臂水平外展体位,并行气管插管全麻术。手术要点:1)首先行体外超声探查,明确FNH与重要脉管及周围脏器之间关系;2)选择合适穿刺点,一般右肝FNH采用肋间隙为进针点,左肝FNH采用剑突下进针点,穿刺全程采用超声引导,避免损伤脉管及周围脏器;3)先消融FNH深部,以两根集束射频针交替向浅部移动,采取多角度穿刺,保证消融范围足够;4)如FNH与周围组织紧密相邻,则在腹腔镜下行浅部消融,以避免损伤,并彻底止血,处理可能存在的胆漏(图1A);5)腔镜下观察整个瘤体颜色变化,如不满意,可以补充消融,直至消融满意(图1B)。采用最大功率200 W,消融时间为55 ~ 130(86.4±23.6) min,消融后瘤体温度≥90℃。术中监测鼻温,最高温度不高于38℃。4 评价指标 1)介入栓塞的评价指标:对比栓塞术前后平扫CT影像,如栓塞剂完全填充瘤体认为满意,填充不全、存在缺损认为不满意;2)射频消融术评价标准:对比射频消融术后平扫CT与术前及栓塞术后影像,消融范围超出栓塞范围0.5 cm,并使瘤体缩小为满意,消融不全为不满意;3)术后随访:术后3个月及术后6个月影像检查发现无FNH残余及无复发为满意,有FNH残余及复发为不满意;4)术后并发症及不良反应:观察术后是否有肝功能异常,高热(≥38.5℃)、术区疼痛、肠瘘、胆道损伤、血红蛋白尿、肾功能损害、胆漏、腹腔感染、肝脓肿、腹腔出血。
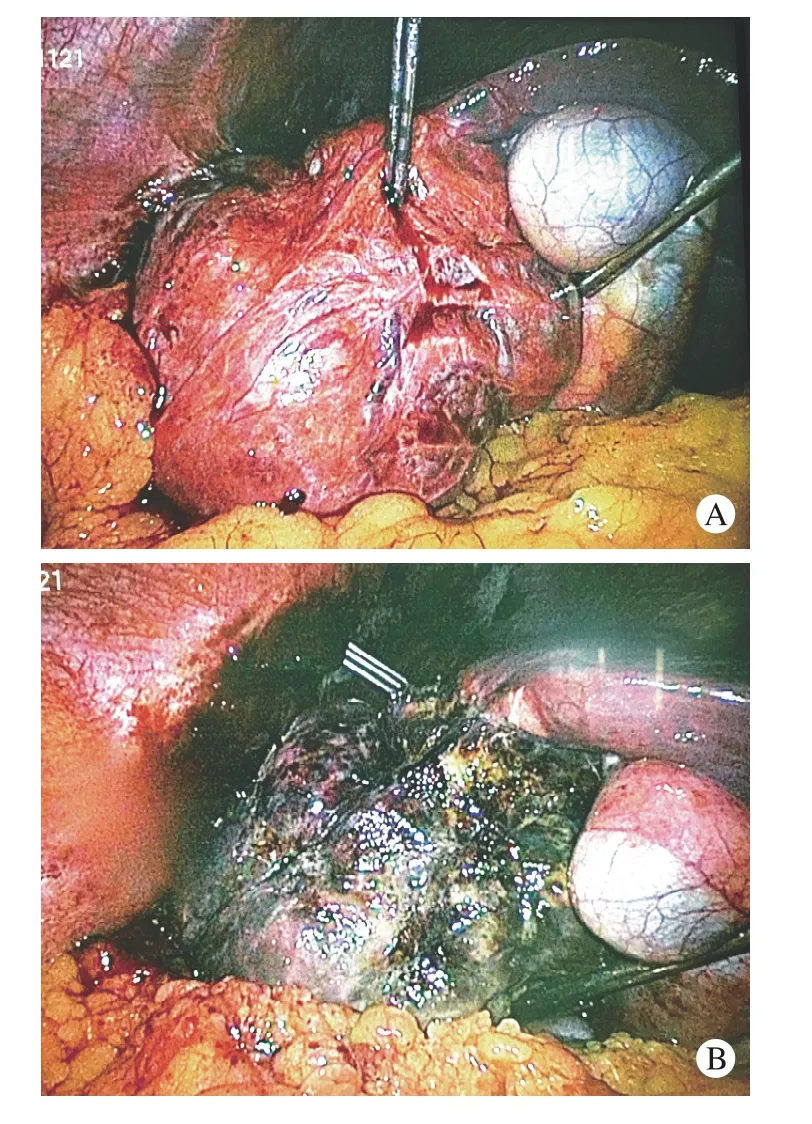
图 1 腹腔镜辅助射频消融术A:消融术前,TAE治疗后瘤体出现不完全坏死,表面存在大量纡曲血管; B:消融术后,瘤体完全坏死、碳化,体积缩小Fig. 1 Laparoscopic RFA for treatment of huge FNH A: Before RFA, inadequately necrosis and a large number of tortuous vessels could be seen in the lesion after TAE;B: After ablation, the tumor was completely necrotic,carbonized, and the volume reduced
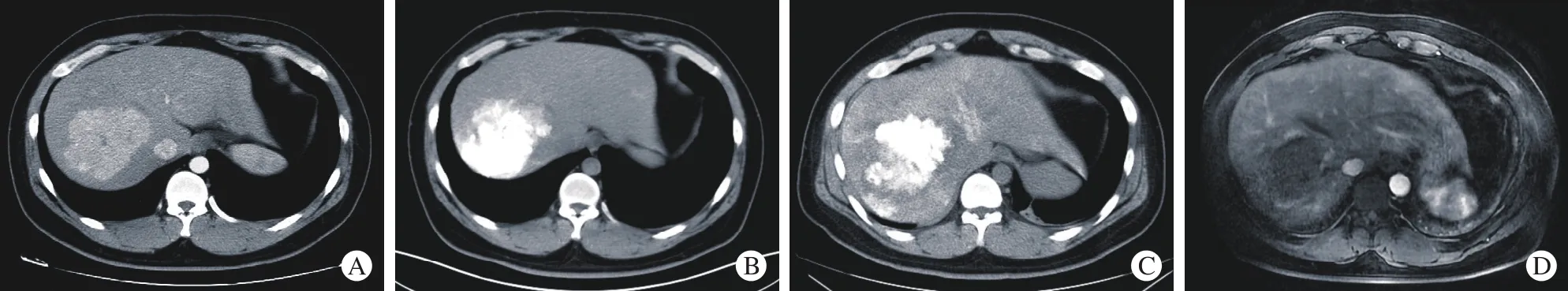
图2 介入栓塞术联合射频消融术治疗FNH影像表现A:术前增强CT示FNH为肝内富血供巨大占位性病变; B:介入栓塞术后CT平扫示FNH内碘油沉积满意; C:射频消融术后CT平扫示FNH边缘可见约0.5 cm低密度灶,瘤体较前略缩小; D:射频消融术后6个月后的MRI增强可见FNH完全坏死缩小,无动脉血供Fig. 2 Peri treatment imaging of one patient underwent TAE combined with RFA A: Preoperative enhanced CT examination manifestation: A huge rich blood-supply lesion; B: Plain CT scan after TAE: Satisfactory iodide deposition in FNH; C: Plain CT scan after RFA: Low-density lesions (about 0.5 cm) can be seen on the FNH margin, and the tumor is slightly smaller than before treatment; D: Enhanced Magnetic Resonance Imaging (MRI) at six months after RFA: Complete necrosis of FNH without arterial blood supply
结 果
1 围术期一般情况 7例均成功施行介入栓塞术联合腹腔镜辅助超声引导射频消融术,所有患者术中情况平稳,术中术后未出现出血、胆漏、血红蛋白尿、肾功能损害、肠瘘、腹腔感染等严重并发症。患者行介入栓塞术后2 ~ 3 d行腹部CT平扫检查,与术前增强影像学检查(图2A)对比,均见FNH内栓塞剂沉积满意(图2B);腹腔镜辅助超声引导肝肿瘤射频消融术,术后3 d再行腹部CT平扫检查(图2C),所有病例均满意,所有患者均在术后7 d内出院。见表1。
2 远期疗效随访 7例首次随访为术后3个月,二次随访为6个月,此后每半年随访1次。7例随访6 ~ 24个月,腹部增强影像学检查(图2D),所有病例均未见FNH残余或复发。
3 并发症及不良反应 所有患者术后2 d内均有谷丙转氨酶及谷草转氨酶升高,200 ~ 800 U/L,经药物保肝治疗1 ~ 3 d后下降至正常。2例出现术区明显疼痛,可能与瘤体与腹壁接近有关,经止疼治疗后好转。本组未出现术后高热、腹腔出血、胆漏、血红蛋白尿、肾功能损害、肠瘘、肝脓肿及腹腔感染等严重并发症。

表1 肝FNH患者一般资料Tab. 1 General information of patients with FNH
讨 论
FNH是一种少见的肝良性占位性病变,70%的FNH可经影像学检查发现,继而通过穿刺活检明确诊断[12]。有文献指出,FNH多发于育龄期女性[13]。FNH患者一般不出现肿块破裂、出血、感染及恶变,但病灶一旦出现迅速增生或破裂出血,可诱发不良反应[14]。多数FNH患者的临床症状不明显,少数患者伴有上腹不适等症状[15]。对于直径≥10 cm并且有一定临床症状的良性肿瘤患者,存在手术指征。本组患者肿瘤直径≥10 cm,全部存在不同程度的腹部不适或肝酶升高等相关表现。
FNH通常在患者体检时发现。文献报道,MRI诊断FNH的敏感性和特异性高于B超和CT[16],病理检测是诊断FNH的金标准。FNH的病理特征为病灶中央可见星状瘢痕样纤维组织,形成间隔并向四周放射而分隔肿块;纤维组织底部可见异常变粗的动脉,纤维间隔内含有增生的胆管及血管。肝细胞形态正常,并围绕富于胆管和血管的纤维结缔组织间隔生长,间隔内有单核细胞浸润,并可见Kupffer细胞;失去正常肝小叶结构,胆管往往失去正常形态。随着超声穿刺技术的发展,穿刺活检技术应用越来越广泛,对于高度怀疑FNH的患者,可以考虑采用穿刺活检来最终明确诊断。本组的所有患者都是经过两种以上影像学方法诊断为FNH后,又经细针穿刺活检病理检查明确诊断。
TAE是治疗肝肿瘤的常用手段[5]。TAE首先进行肝动脉插管造影,了解肝血管瘤血供,瘤体大小、数目、位置等,然后再超选择性插管到瘤体供血动脉支,将栓塞剂和血管硬化剂注入瘤体血窦,使其填充并滞留其中,起到破坏血窦内皮细胞和闭塞瘤体血窦的作用。但需要临床治疗的较大肝FNH多数为多支动脉供血,部分供血动脉在造影时不易被发现,且易形成侧支循环,导致肝FNH复发。肝肿瘤射频消融治疗的原理是通过射频电流产生足够的热量(消融电极周围温度可高于100℃),破坏瘤体内血管内皮细胞,导致广泛的血管损伤和血栓形成,进而使瘤体组织凝固、碳化,肿瘤缩小[17]。
射频消融时伴随着热沉降效应,理论上讲,液体流动量越大,热沉降效应越强,而FNH是动脉血供为主的富血供肿瘤样病变,单纯行射频消融治疗效果不佳。肝FNH的组织结构特点是瘤体内的血窦充满血液。消融电极发出射频波使组织产热,会破坏肿瘤内的红细胞。如果瘤体体积巨大,破坏的红细胞达到一定数量时则表现为溶血。在较大肿瘤的射频消融过程中,瘤体内的血液愈加丰富,消融时间越长,破坏的红细胞数量也越多。大量破损红细胞释放的血红蛋白通过肾时,将阻塞肾小管管腔,严重影响肾小管的滤过功能。同时,消融时患者体温升高、大量出汗,使有效循环血量锐减,导致肾灌注不足,亦可进一步加重急性肾损伤,严重者甚至发生急性肾功能衰竭[18]。
我们在射频消融术前,采用TAE的方法将瘤体内充满栓塞剂和血管硬化剂并滞留在瘤体内,减少瘤体内的血液含量,同时栓塞瘤体的主要供血动脉,降低血液流速,减轻射频消融时的热沉降效应,栓塞剂和血管硬化剂均可以提高瘤体热传导作用,大大提高了消融效率,并增加手术的安全性。在应用集束射频针持续长时间且最大功率消融的情况下,患者术中最高鼻温维持在38℃以下,无一例发生血红蛋白尿及肾损害表现。TAE和射频消融的时间间隔一般在1周以内,我们的目的是尽量避免瘤体内栓塞剂的弥散丢失,将TAE后短期内的肿瘤视为缺血的、高效热传导功能的肿瘤。我们在行射频消融手术时全部采用全麻的方式,首先在体外超声的引导下消融肿瘤深部,瘤体被栓塞剂完全填充后,在超声引导下呈明确的高回声结节,有效避免了原瘤体在超声下边界不清晰甚至难以辨别的问题,保证完全破坏FNH瘤体。我们一般采用两根集束射频消融针交替向浅部移动破坏瘤体。因为本组患者瘤体较大,一般肿瘤的浅部与周围脏器毗邻,所以瘤体的浅部在腹腔镜直视下完成,这样可以配合腹腔镜下注水、隔离、止血等操作,完成精准的一次性完全消融术。在消融手术中,我们采取大功率、长时间的消融方法,使瘤体完全坏死,最大程度使瘤体缩小,避免因不完全性坏死带来的继发感染及发热等症状。
本研究中,手术成功率、围术期安全性及长期随访结果都令人满意。说明腹腔镜辅助超声引导下射频消融术联合介入栓塞术治疗肝巨大局灶性结节性增生可行、安全且高效。
1 Vilgrain V, Uzan F, Brancatelli G, et al. Prevalence of hepatic hemangioma in patients with focal nodular hyperplasia: MR imaging analysis[J]. Radiology, 2003, 229(1): 75-79.
2 Hanaoka J, Shimada M, Utsunomiya T, et al. Huge focal nodular hyperplasia difficult to distinguish from well-differentiated hepatocellular carcinoma[J]. Hepatol Res, 2012, 42(7): 727-731.
3 孙超, 杨欣荣, 史颖弘, 等. 肝脏局灶性结节性增生的临床诊疗分析[J]. 中国临床医学, 2016, 23(5): 591-596.
4 European Association for The Study of the Liver, European Organisation for Research and Treatment of Cancer.. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2012, 56(4): 908-943.
5 高君, 范瑞芳, 杨家印, 等. 肝血管瘤的射频消融治疗(国内)专家共识[J]. 中华肝胆外科杂志, 2017, 23(5): 289-295.
6 Ji J, Gao J, Zhao L, et al. Computed Tomography-Guided Radiofrequency Ablation Following Transcatheter Arterial Embolization in Treatment of Large Hepatic Hemangiomas[J].Medicine (Baltimore), 2016, 95(15): e3402.
7 Wang S, Gao J, Yang M, et al. Intratumoral coagulation by radiofrequency ablation facilitated the laparoscopic resection of giant hepatic hemangioma : a surgical technique report of two cases[J].Oncotarget, 2017, 8(31): 52006-52011.
8 Ziemlewicz TJ, Wells SA, Lubner MA, et al. Microwave ablation of giant hepatic cavernous hemangiomas[J]. Cardiovasc Intervent Radiol, 2014, 37(5): 1299-1305.
9 Gao J, Ji J-S, Ding X-M, et al. Laparoscopic Radiofrequency Ablation for Large Subcapsular Hepatic Hemangiomas: Technical and Clinical Outcomes[J]. PLoS ONE, 2016, 11(2): e0149755.
10 Sun JH, Nie CH, Zhang YL, et al. Transcatheter Arterial Embolization Alone for Giant Hepatic Hemangioma[J]. PLoS ONE, 2015, 10(8): e0135158.
11 Szejnfeld D, Nunes TF, Fornazari VAV, et al. Transcatheter arterial embolization for unresectable symptomatic giant hepatic hemangiomas: single-center experience using a lipiodol-ethanol mixture[J]. Radiol Bras, 2015, 48(3): 154-157.
12 Bioulac-Sage P, Balabaud C, Bedossa P, et al. Pathological diagnosis of liver cell adenoma and focal nodular hyperplasia:Bordeaux update[J]. J Hepatol, 2007, 46(3): 521-527.
13 陈伶俐, 纪元, 许建芳, 等. 肝脏局灶结节性增生238例临床病理分析[J]. 中华病理学杂志, 2011, 40(1): 17-22.
14 Demarco MP, Shen P, Bradley RF, et al. Intraperitoneal hemorrhage in a patient with hepatic focal nodular hyperplasia[J]. Am Surg,2006, 72(6): 555-559.
15 Bioulac-Sage P, Rebouissou S, Sa Cunha A, et al. Clinical,morphologic, and molecular features defining so-called telangiectatic focal nodular hyperplasias of the liver[J]. Gastroenterology, 2005,128(5): 1211-1218.
16 Hussain SM, Terkivatan T, Zondervan PE, et al. Focal nodular hyperplasia: findings at state-of-the-art MR imaging, US, CT, and pathologic analysis[J]. Radiographics, 2004, 24(1): 3-17.
17 范瑞芳, 柴福录, 卫立辛, 等. 腹腔镜射频消融与外科切除治疗巨大肝脏海绵状血管瘤的临床对照研究[J]. 中华肝胆外科杂志, 2006, 12(10): 676-679.
18 van Tilborg AAJM, Dresselaars HF, Scheffer HJ, et al. RF Ablation of Giant Hemangiomas Inducing Acute Renal Failure: A Report of Two Cases[J]. Cardiovasc Intervent Radiol, 2016, 39(11):1644-1648.
