糖尿病对大鼠膀胱组织Piezos离子通道的影响
2018-07-04杨力军王福利袁建林秦荣良
张 昆,邝 芳,闫 飞,杨 波,杨力军,王福利,袁建林,秦荣良,刘 飞
(1.空军军医大学西京医院泌尿外科,陕西西安 710032;2.解放军第201医院泌尿外科,辽宁辽阳 111000;3.空军军医大学神经生物学教研室,陕西西安 710032)
Piezos离子通道是近年来发现的一种新型机械敏感性离子通道,可感受细胞膜所受机械力变化并迅速作出反应,将膜感受到的机械信号转化为电信号或化学信号[1],在2010年,COSTE等[2]研究发现,在哺乳动物中,该通道家族包含Piezo1和Piezo2蛋白,分别由FAM38A 和FAM38B基因编码。Piezo基因及其表达的蛋白与机体一些病理生理过程相关,如脱水遗传性口形红细胞增多症(dehydrated hereditary stomatocytosis,DHS)、戈登综合征(gordon syndrome,GS)、Marden-Walker syndrome(MWS)等[3]。Piezo离子通道存在于许多组织中,膀胱组织中存在大量Piezo1,支配膀胱的背根节中存在大量Piezo2,对膀胱感觉有明确的影响作用[4-5]。糖尿病性膀胱病(diabetic cystopathy,DCP)是糖尿病泌尿系统常见并发症之一,以膀胱充盈的感觉受损、膀胱容量增大、逼尿肌收缩力降低和剩余尿量增加为特征。目前,Piezos在DCP中表达情况少有文献报道,本实验以链尿佐菌(Streptozocin,STZ)诱导糖尿病大鼠模型,采用QPCR、Western blot和免疫荧光观察糖尿病大鼠膀胱组织中Piezos的基因表达及蛋白水平变化,为探索糖尿病膀胱感觉信号变化规律及其病理生理学机制提供理论依据。
1 材料与方法
1.1实验动物及主要实验仪器、试剂
1.1.1实验动物 斯泼累格·多雷(Sprague Dawley,SD)大鼠(第四军医大学实验动物中心提供),雄性,(250±20)g,18只,于动物中心购回适应性喂养1周后进行造模。
1.1.2主要实验仪器及试剂 STZ(Sigma),Rabbit Anti-Piezo1 antibody(abcam),Goat Anti-Rabbit IgG(earthox),Mouse Anti-c-Kit antibody(santacruz),Goat Anti-Mouse IgG(earthox),Super M-MLV反转录酶、高纯总RNA快速提取试剂盒和2×PowerTaqPCRMasterMix(BioTeke),RabbitAnti-Piezo1 antibody(Abcam),RabbitAnti-Piezo2 antibody(origene),羊抗兔IgG-HRP (wanleibio),激光共聚焦显微镜(Olympus FV1200)、荧光定量PCR仪(BIONEER),凝胶成像系统(北京六一)。
1.2糖尿病大鼠模型的建立及实验分组健康成年SD大鼠,体重(250±20)g,雄性,36只,随机分为正常对照组(normal control,NC)和糖尿病组(diabetes mellitus,DM),每组18只。实验前大鼠禁食24 h,DM组大鼠按60 mg/kg单次腹腔注射1%STZ溶液(pH=4.5),NC组大鼠腹腔注射等体积柠檬酸盐缓冲液,所有大鼠饲养期间自由摄食和饮水。STZ诱导1周后取尾静脉血,利用血糖仪检测大鼠血糖水平,血糖水平≥16.7 mmol/L定义为糖尿病大鼠。每周测1次血糖和体重。
1.3大鼠膀胱组织取材NC组和DM组于1、2、8周后每组各取6只SD大鼠,采取10%水合氯醛按0.3 mL/100 g体重麻醉,仰卧固定,生理盐水灌注后,耻骨上纵切口显露膀胱,去除输尿管及膀胱浆膜层后取出膀胱,反复用生理盐水清洗膀胱,用滤纸吸干膀胱表面水分,沿膀胱纵轴切取适量膀胱组织用4%多聚甲醛溶液固定,剩余膀胱组织液氮速冻后置于-80 ℃超低温冰箱保存备用。
1.4大鼠膀胱组织中Piezo1和c-kit免疫荧光观察膀胱组织经4%多聚甲醛溶液固定24 h后,蔗糖溶液梯度脱水,制作冰冻切片(10 μm),以0.01 moL/L PBS充分漂洗冷冻切片,10 min/次,共3次。室温23 ℃下,以3%牛血清蛋白(苏联albumin from bovine serum,BSA)溶液封闭处理切片,持续30 min。滴加一抗Rabbit Anti-Piezo1 antibody(1∶100)和Mouse Anti-c-kit antibody(1∶100),4 ℃下过夜。次日取出过夜标本,再次洗涤,加入二抗 Goat Anti-Rabbit IgG(1∶200)、Goat Anti-Mouse IgG(1∶500),室温孵育3 h,漂洗后,加入DAPI细胞核着色10 min,漂洗后用50%甘油封片。将切片置于激光共聚焦显微镜下,观察组织细胞形态及荧光表达情况。
1.5QPCR检测大鼠膀胱中Piezo1和Piezo2mRNA的表达使用总RNA提取试剂盒提取NC组和DM组膀胱组织的总RNA,以各组总RNA为模板,用Super M-MLV反转录酶得到cDNA,利用2×Power Taq PCR Master Mix试剂盒在反应体系(20 μL)下进行荧光定量PCR,其反应体系为:cDNA模板1 μL,上下游引物(10 μmoL/L)各0.5 μL,SYBR GREEN mastermix 10 μL,用ddH2O补足至20 μL,按试剂盒说明书PCR反应程序进行40个循环,然后仪器自动进行熔解曲线分析。每个样品以β-actin的mRNA 表达作为内参照,通过相对定量(2-ΔΔCt)法计算Piezo1和Piezo2在各样品中相对 mRNA的表达水平。靶基因和内参基因扩增的上下游引物序列(生工生物工程(上海)有限公司合成)(表1)。
表1QPCR引物序列及长度

基因引物序列长度(bp)Tm(℃)扩增(bp)Piezo1F:TGCCTCAGCCTCCTCTTC1855.3147R:CTTCAGGTCCAGCCTTGTA 1953.1Piezo2F:TAAGGAGTTCATCGGCAATA2053.5180R:AGGCAGCCAAACAGCAAT1856.2β-actinF:GGAGATTACTGCCCTGGCTCCTAGC2560.1R:GGCCGGACTCATCGTACTCCTGCTT2562.0155
1.6Westernblot检测大鼠膀胱中Piezo1和Piezo2蛋白分别称取NC组和DM组膀胱组织,放入装有适量裂解液的匀浆管中,提取全蛋白,按照BCA法测定蛋白浓度。根据目的蛋白分子量配置SDS-PAGE,每孔上样20 μL的蛋白样品进行SDS-PAGE 电泳,转印至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜。5%脱脂奶粉室温封闭 1 h,将抗Piezo1(1∶500)、Piezo2(1∶1 000),β-actin(1∶1 000)抗体工作液倒入杂交袋中,放入封闭好的PVDF膜,用压膜机封口,进行4 ℃孵育过夜,TBST漂洗5 min×4次,加入二抗羊抗兔IgG-HRP,37 ℃孵育45 min,TBST漂洗,ECL法底物发光。使用凝胶图象处理系统(Gel-Pro-Analyzer)分析目标条带的吸光度值,用目的蛋白灰度值/β-actin 灰度值代表目的蛋白的相对表达量。
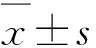
2 结 果
2.1免疫荧光观察分析激光共聚焦显微镜下观察,c-kit 抗体主要在黏膜下层和肌肉包膜外表达,黏膜下层可见较多梭形分布间质细胞表达,阳性呈绿色;Piezo1抗体遍布细胞表面,尿路上皮及肌细胞间信号较其它区域信号更强,阳性呈红色。由图1可见第1、2周时DM组红色信号较NC组强,第8周时两组红色信号强度无显著差异。绿色荧光信号在第1周时DM组和NC组无显著差异,第2、8周时DM组较NC组弱(图1)。

图1造模成功后第1、2、8周时利用免疫荧光双标法标记NC组和DM组
大鼠膀胱组织中Piezo1(红色)和c-kit(绿色)的表达情况
第1、2周时DM组红色信号较NC组强,第8周时两组红色信号强度无显著差异。绿色荧光信号在第1周时DM组和NC组无显著差异,第2、8周时DM组较NC组弱标尺20 μm。U: 尿路上皮;D:逼尿肌;↑ICCS。
2.2QPCR检测结果分析DM组大鼠膀胱中Piezo1和Piezo2在第1、2周表达水平明显高于NC组(P<0.01,P<0.05),第8周时NC组和DM组Piezo1和Piezo2的表达水平无显著性差异(P>0.05,图2)。

图2在第1、2、8周时,NC组和DM组大鼠膀胱组织中Piezo1和Piezo2的mRNA相对表达量
每个样品以β-actin的mRNA 表达作为内参照,通过相对定量(2-ΔΔCt)法计算Piezo1和Piezo2在各样品中相对 mRNA的表达水平。DM组大鼠膀胱中Piezo1(A)和Piezo2(A)在第1、2周表达水平明显高于NC组(P<0.01,P<0.05),第8周时NC组和DM组Piezo1和Piezo2表达水平无显著差异(P>0.05,n=3)。**P<0.01,*P<0.05。
2.3Westernblot结果分析DM组大鼠膀胱中Piezo1和Piezo2在第1、2周蛋白表达水平明显高于NC组(P<0.05),第8周时NC组和DM组Piezo1和Piezo2蛋白表达水平无显著性差异(P>0.05,图3)。
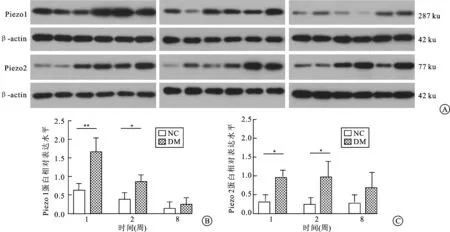
图3造模成功后第1、2、8周时Westernblot法测定Piezo1和Piezo2在NC组和DM组大鼠膀胱组织中蛋白表达水平条带及其柱状图
A:条带图; B、C:分别为两组大鼠膀胱组织中Piezo1 (B)和Piezo2(C)蛋白表达水平比较柱状图,DM组大鼠膀胱中Piezo1和Piezo2在第1、2周蛋白表达水平明显高于NC组(P<0.05),第8周时NC组和DM组Piezo1和Piezo2蛋白表达水平无显著性差异(P>0.05,n=3)。**P<0.01,*P<0.05。
3 讨 论
DCP初期临床症状多以刺激性症状为主,可表现为膀胱过度活动症,包括逼尿肌过度兴奋或膀胱感觉过敏诱发的尿急、尿频、夜尿增多和急迫性尿失禁,后期则以梗阻性症状为主,多与假性膀胱梗阻相关,症状包括尿量减少和尿流率降低,尿后滴沥,膀胱充盈感减弱和大量残余尿[6]。目前通过对糖尿病膀胱病变的病因学研究发现本病主要与神经因素、逼尿肌因素及其他因素有关,其中逼尿肌因素是近年来研究的热点,主要由于逼尿肌细胞内容物、相关酶类、离子通道、膜受体及神经递质的改变而导致逼尿肌结构及功能的损害[7]。近些年研究结果表明,膀胱尿路上皮不仅是尿路屏障,也可作为感受器发挥作用,膀胱尿路上皮上存在大量受体和离子通道,在膀胱受到损伤或炎症时,膀胱尿路上皮对痛觉等刺激的反应性发生改变,释放前列腺素等介质,影响膀胱传入神经,从而在DCP膀胱功能障碍中发挥作用[8]。Piezos作为机械敏感性受体,可将机械性刺激转变为电信号或化学,Piezo1在泌尿道存在表达,经机械刺激后可产生Ca2+内流和ATP释放,是泌尿道感知尿流和压力的重要机制[9],另外,Piezo1被大量激活后可促进膀胱黏膜增生,出现膀胱肥大[10],可认为是DCP产生膀胱肥大因素之一。
本研究用1%STZ诱导糖尿病大鼠模型,在造模成功第1、2周后,用QPCR和Western blot检测发现:DM组大鼠膀胱组织Piezo1的mRNA和蛋白表达水平较NC组增强,动物实验证实,在部分膀胱出口梗阻(partial bladder outlet obstruction,pBOO)初期,大鼠膀胱组织Piezo1显著增加,膀胱敏感性增加,出现尿频症状[4],这与本研究结果类似。对Piezo1和c-kit进行免疫荧光显示,第1、2周DM组Piezo1荧光信号明显高于NC组,尤其是在黏膜层;在造模成功第8周时,两组大鼠膀胱组织Piezo1荧光信号强度无明显差异。但是,c-kit免疫荧光信号则随患糖尿病时间逐渐减弱,而c-kit为间质细胞(interstitial cells of Cajal ICCs)特异标志物,目前研究证明膀胱中的ICCs是自主神经末梢与逼尿肌之间信号的有力转导,在膀胱黏膜下ICCs产生动作电位而诱导逼尿肌收缩。糖尿病会导致膀胱ICCs数量减少,从而动作电位产生减少,出现逼尿肌麻痹,对机械刺激敏感性下降,膀胱残余尿量增加[11],由以上结果可推断,在DCP第1、2周时,大鼠膀胱组织Piezo1表达水平显著升高,膀胱黏膜组织中Piezo1增多,使得尿路上皮对所受到的机械刺激更加敏感,弥补了因糖尿病初期ICCs功能降低所导致的逼尿肌麻痹现象。
Piezo2主要存在背根神经节,有文献指出,Piezo2在调节神经及运动功能中起重要作用[12-13],在DRG中干扰Piezo2表达可调节细胞的感觉阈值[14]。本研究采用QPCR和Western blot对膀胱中的Piezo2进行定量分析,发现Piezo2在正常膀胱组织中表达较少,在第1、2周时,糖尿病大鼠膀胱组织中Piezo2较正常组显著增加,8周时下降与正常对照组比较无显著差异。
目前关于Piezos的研究表明,Piezos在尿路上皮和肾上皮细胞确实存在,且可作为感受器感受组织所受机械力等作用[15],MAI等[4]研究指出在大鼠PBOO模型的膀胱组织中Piezo1可较正常组显著增加。我国学者研究指出Piezos广泛存在于肠道、牙周组织,通过免疫组织化学染色观察发现Piezo1在直肠组织内无表达,Piezo2在直肠黏膜内有一定表达,并在介导直肠感觉和排便过程中发挥重要作用[16]。但是Piezo1在牙周组织中要远多于Piezo2,参与牙周组织的感知功能[17]。本研究显示,DCP初期,Piezo1和Piezo2可显著增加,从而使膀胱对机械刺激更加敏感,产生尿频等症状;DCP后期,由于Piezo1和Piezo2与正常对照组无显著差异,膀胱对机械刺激敏感性下降,尿频症状减弱,膀胱残余尿量增加,这一现象可能与高血糖致膀胱组织损伤有关,而且有关DCP中Piezos的研究目前国内外尚未见文献报道,尚需进一步研究。
总之,DCP初期,大鼠膀胱组织中Piezo1和Piezo2可显著增加,增强膀胱对机械刺激的敏感性,是产生尿频症状的重要因素之一。
参考文献:
[1] GU Y,GU C.Physiological and pathological functions of mechanosensitive ion channels [J].Mol Neurobiol,2014,50(2):339-347.
[2] COSTE B,XIAO B,SANTOS JS,et al.Piezo proteins are pore-forming subunits of mechanically activated channels [J].Nature,2012,483(7388):176-181.
[3] VOLKERS L,MECHIOUKHI Y,COSTE B.Piezo channels:from structure to function [J].Pflügers Archiv-Europ J Physiol,2015,467(1):95-99.
[4] MAI M,YANO K,TOMITA K I,et al.Piezo1 expression increases in rat bladder after partial bladder outlet obstruction [J].Life Sciences,2016,166:1-7.
[5] COSTE B,MATHUR J,SCHMIDT M,et al.Piezo1 and Piezo2 are essential components of distinct mechanically-activated cation channels [J].Science,2010,330(6000):55-60.
[6] ARRELLANOVALDEZ F,URRUTIAOSORIO M,ARROYO C,et al.A comprehensive review of urologic complications in patients with diabetes [J].Springer Plus,2014,3(1):549.
[7] YUAN Z,TANG Z,HE C,et al.Diabetic cystopathy:A review [J].J Diab,2015,7(4):442-447.
[8] 鲁雄兵,何朝辉,曹石金,et al.糖尿病大鼠膀胱细胞凋亡的改变 [J].广州医学院学报,2011,39(6):8-11.
[9] MIYAMOTO T,MOCHIZUKI T,NAKAGOMI H,et al.Functional role for Piezo1 in stretch-evoked Ca2+influx and ATP release in urothelial cell cultures [J].J Biol Chem,2014,289(23):16565-16575.
[10] GUDIPATY SA,LINDBLOM J,LOFTUS PD,et al.Mechanical stretch triggers rapid epithelial cell division through Piezo1 [J].Nature,2017,543(7643):118-121.
[11] JUSZCZAK K.Not only diabetic polyneuropathy but also interstitial cells of Cajal dysfunction is a potential mechanism for diabetic cystopathy [J].Cent Europ J Urol,2014,67(4):375-376.
[12] MCMILLIN MJ,BECK AE,CHONG JX,et al.Mutations in PIEZO2 cause Gordon syndrome,Marden-Walker syndrome,and distal arthrogryposis type 5 [J].Am J Human Genetics,2014,94(5):734-744.
[13] COSTE B,HOUGE G,MURRAY MF,et al.Gain-of-function mutations in the mechanically activated ion channel PIEZO2 cause a subtype of Distal Arthrogryposis [J].Proceed National Acad Sci USA,2013,110(12):4667-4672.
[14] SCHNEIDER ER,MASTROTTO M,LAURSEN W J,et al.Neuronal mechanism for acute mechanosensitivity in tactile-foraging waterfowl [J].Proceed National Acad Sci USA,2014,111(41):14941-14946.
[15] PARPAITE T,COSTE B.Piezo channels [J].Curr Biol Cb,2017,27(7):R250.
[16] 李娟,林宏城,任东林.Piezos机械敏感性离子通道在直肠中的表达 [J].广东医学,2015,36(21):3359-3361.
[17] 康婷,黄世友,李鹏,等.Piezos离子通道在大鼠牙周组织中表达的实验研究 [J].牙体牙髓牙周病学杂志,2014,20(5):269-273.
