miR-519d/Twist1轴介导BrMC抑制SMMC-7721源性肝癌干样细胞体外致癌能力
2018-07-04罗祎敏曹晓诚崔迎红曹建国
罗祎敏,曹晓诚,李 翔,崔迎红,许 畅,陈 阿,曹建国
(1. 南华大学医学院病理学教研室,湖南 衡阳 421001;2. 湖南师范大学医学院药学系,湖南 长沙 410013;3. 湖南师范大学湖南省小分子靶向药物研制与创制重点实验室,湖南 长沙 410013)
大量研究证据表明,包括肝细胞癌在内的多种实体瘤存在极少量的具有致癌能力的肿瘤细胞,即肿瘤干细胞(cancer stem cells, CSCs)[1]。肿瘤干样细胞特性的增强涉及多种恶性肿瘤的起始、致癌能力、多药耐药、转移和复发[2]。现有的氟尿嘧啶、紫杉醇、顺铂等化疗药物对肝细胞癌的治疗效果不佳,主要是由于其严重的毒副作用和诱导CSCs生成[3]。因此,迫切需要研究和开发毒性小、靶向抑制或消除CSCs或肿瘤干样细胞致癌性质的新型制剂[4]。
微小RNA (miR)是一类~22-nt单链非编码RNA,在调节致癌途径中起关键作用[5]。有研究报道[6],人肝细胞癌miR-519d下调,过表达miR-519d抑制肝细胞癌细胞系QGY-7703生长。然而,miR-519d在维持肝癌干样细胞(liver cancer stem-like cells, LCSLCs)致癌能力中的生物学功能还有待进一步研究。
8-溴-7-甲氧基白杨素 (8-bromo-7-methoxychrysin, BrMC)是自主设计和合成的具有较白杨素更强抗肿瘤活性的新型类似物[4]。先前的研究证实,BrMC下调Twsit1蛋白表达,抑制SMMC-7721细胞系肝癌干细胞自我更新能力[4,7]。Yue等[5]报道,miR-519d通过Twist1和Wnt /β-连环蛋白信号通路,抑制胃癌上皮-间充质转化。本研究探讨BrMC是否通过上调miR-519d,下调Twist1表达,抑制SMMC-7721源性LCSLCs的体外致癌能力。
1 材料
1.1细胞株人肝细胞癌SMMC-7721细胞系购自中国科学院细胞库。
1.2试剂按照文献[8]描述的方法合成BrMC,终浓度0.1%二甲基亚砜(DMSO)的DMEM培养基溶解。胰岛素、鼠抗人β-actin抗体购自美国Sigma-Aldrich公司;重组人表皮生长因子(epidermal growth factor,EGF)、重组人成纤维细胞生长因子(fibroblast growth factor, FGF)、B27添加物、DMEM/F12培养基、牛血清白蛋白(bovine serum albumin,BSA)、LipofectamineTM2000试剂,均购自Invitrogen公司;兔抗人Twist1多克隆抗体购自美国Abcam公司;辣根过氧化酶标记兔抗鼠Ig G、山羊抗兔Ig G二抗购自碧云天生物技术研究所;增强化学发光检测试剂购自美国Amersham Pharmacia Biotech公司;miR-519d引物、U6引物、hsa-miR-519d模拟物、519d抑制物、乱序对照寡核苷酸、pcDNA3.1-Twist1(NM_000474)或对照质粒pcDNA3.1-LacZ,均购自广州锐博生物科技有限公司;TaqMan MicroRNA逆转录试剂盒 (Applied Biosystems,Thermo Fisher Scientific);SYBR®Premix Ex TaqTM(TaKaRa公司);双荧光素酶报告基因试剂盒(Promega公司);Bradford试剂盒(美国Bio-Rad Laboratories Hercules公司)。
1.3仪器HF 212 uv二氧化碳细胞培养箱(美国SHEL-LAB公司);YJ-875医用净化工作台(苏州净化设备公司);Allegra 64R高速冷冻离心机(美国Beckman Coulter公司);IX53倒置显微镜(日本Olympus公司);扫描仪(Ranon GIS-2008, 上海天能科技有限公司);DDY-5型稳压稳流电泳仪(北京六一仪器厂);转膜仪(美国Bio-Rad公司)。
2 方法
2.1球细胞培养用含生长因子(EGF和FGF)、胰岛素、B27添加物的无血清DMEM/F12培养基悬浮SMMC-7721细胞,每孔104个细胞,接种入超低黏附6孔板。悬浮培养6 d得到三维克隆性生长细胞球(≥30细胞);胰蛋白酶-EDTA消化,200×g离心10 min,机械分散获得球细胞。以104个细胞/孔密度再次接种入超低黏附6孔板,培养6 d,获得第2代球细胞作为LCSLCs,用于随后的实验研究。
2.2实时定量PCR用TRIzol试剂从细胞中提取总RNA。用TaqMan MicroRNA逆转录试剂盒进行RNA逆转录。根据制造商说明书操作步骤,以SYBR®Premix Ex TaqTM检测miR-519d和 U6表达。扩增条件如下:95℃变性15 s, 60℃复性/延伸60 s循环40次。所有样本一式3份,相对表达水平用2-ΔΔCt方法计算。
2.3细胞转染根据制造商的说明书步骤,使用LipofectamineTM2000试剂,以100 nmol·L-1终浓度将hsa-miR-519d模拟物或乱序对照寡核苷酸、pcDNA3.1-Twist1或对照质粒pcDNA3.1-LacZ转染SMMC-7721源性LCSLCs。
2.4球形成率测定用含生长因子(EGF和FGF)、胰岛素和B27添加物的无血清DMEM/F12培养基悬浮细胞,以1 000个细胞/孔接种入24孔超低黏附培养板,培养6 d,计数肿瘤球,球形成率,按照公式:每孔平均肿瘤球数/接种活细胞数(1 000)×100%计算。
2.5集落形成实验首先将含0.8% 琼脂糖和10%胎牛血清的DMEM/F12培养基0.5 mL加入到24孔板中,作为底层。然后,含1×107·L-1细胞、0.4%琼脂糖和20%胎牛血清的DMEM/F12培养基0.5 mL接种至底层之上。每4 d添加含20%胎牛血清的DMEM/F12培养基0.5 mL,孵育2周。在倒置显微镜下计数集落(≥20细胞)。琼脂集落形成率按照公式:每孔平均集落数/接种活细胞数(1 000)×100%计算。
2.6质粒构建及荧光素酶活性测定PCR扩增含有miR-519d结合位点的人野生型Twist1 mRNA 3′-UTR,并插入pMIR-REPORTTM荧光素酶报告质粒的SpeI / HindIII位点,以产生pMIR-Twist1-wt质粒。Twist1 3′-UTR中miR-519d的互补序列突变,命名为pMIR-Twist1-mut质粒。通过Lipofectamine 2000试剂将miR-519d模拟物和pMIR-Twist1-WT或pMIR-Twist1-MUT共转染LCSLCs。转染后48 h,裂解细胞,并使用双荧光素酶报告基因试剂盒测定相对荧光素酶活性。
2.7蛋白质印迹细胞用冰冷的PBS液洗涤2次,加入1.0 mL RIPA缓冲液冰上孵育20 min,13 200 r·min-1、4℃离心5 min制备全细胞裂解液,Bradford试剂盒测定蛋白质浓度。含50 μg蛋白的细胞裂解物在10% SDS-聚丙烯酰胺凝胶中电泳分离,转移至PVDF膜。以抗Twist 1和抗β-actin抗体作为一抗,使用ECL试剂盒检测印迹信号。
2.8BrMC处理参照文献[4]描述的方法,选用BrMC(终浓度1、3、10 μmol·L-1) 处理SMMC-7721源性LCSLCs 24 h。

3 结果
3.1SMMC-7721源性LCSLCsmiR-519d表达下调、Twist1表达上调与SMMC-7721细胞比较,SMMC-7721源性LCSLCs (SMMC-7721细胞系第2代球细胞)miR-519d表达下调(Fig 1A);同时,Twist1蛋白表达上调 (Fig 1B,P<0.05)。Fig 1C、1D球形成和琼脂集落形成实验的结果显示,SMMC-7721源性LCSLCs相比SMMC-7721细胞的球和琼脂集落形成率增高(P<0.05)。
3.2BrMC上调miR-519d表达、下调Twist1蛋白表达Fig 2A、2B实时定量PCR和蛋白质印迹分析结果证明,BrMC(1、3、10 μmol·L-1)剂量依赖性增高SMMC-7721源性LCSLCs miR-519d表达水平(P<0.05),并降低Twist1蛋白表达水平(P<0.05)。Fig 2C、2D表明,BrMC以浓度依赖方式抑制SMMC-7721源性LCSLCs球和琼脂集落形成能力(P<0.05)。

Fig 1 Comparison of expressions of miR-519d and Twist1 between SMMC-7721 cells and LCSLCs(n=3)
A: Expression of miR-519d assessed by qRT-PCR; B: Expression of Twist1 protein analyzed by Western blot; C: Sphere forming rate determined by sphere formation assay; D: Colony forming rate determined by colony formation assay in agar. SMMC: Human hepatocellular carcinoma SMMC-7721 cell line; LCSLC: The second-generation spheres derived from SMMC-7721 cell line.*P<0.05vsSMMC-7721 cells.

Fig 2 Effects of BrMC on expressions of miR-519d and Twist1 in SMMC-7721-derived LCSLCs(n=3)
A:Effect of various concentrations of BrMC (1.0, 3.0, 10.0 μmol·L-1) on expression of miR-519d assessed by qRT-PCR; B: Effect of various concentrations of BrMC (1.0, 3.0, 10.0 μmol·L-1) on expression of Twist1 protein analyzed by Western blot; C: Effect of various concentrations of BrMC (1.0, 3.0, 10.0 μmol·L-1) on sphere forming rate determined by sphere formation assay; D: Effect of various concentrations of BrMC (1.0, 3.0, 10.0 μmol·L-1) on colony forming rate determined by colony formation assay in Agar.*P<0.05vs0.0 μmol·L-1BrMC;#P<0.05vs1.0 μmol·L-1BrMC group.

Fig 3 Effects of co-transfected with miR-519d mimic and pmiR-Twist1-WT on expressions of miR-519d and Twist1 in SMMC-7721-derived LCSLCs (n=3)
A:Bioinformatics analysis of between miR-519d and Twist1 recognition sequences by miRanda (http://mircorna.org) revealed the miR-519d had a binding site with Twist1; B: miR-519d mimic decreased the luciferase activities in Twist1-WT+miR-519d mimic group, but did not affect luciferase activity by transfecting miR-519d mimic+Twist1-MUT group into SMMC-7721-derived LCSLCs; C: Effect of miR-519d mimic on expression of Twist1 protein analyzed by Western blot; D: Effect of miR-519d mimic on sphere forming rate determined by sphere formation assay; E: Effect of miR-519d mimic on colony forming rate determined by colony formation assay in agar.*P<0.05vstransfected with scrambled control oligos(miR-Control).
3.3Twist1是miR-519d在SMMC-7721源性LCSLCs中的靶基因在线预测软件miRanda(www.mircrorna.org)的生物信息学分析显示,Twist1是miR-519d的潜在靶标(Fig 3A)。含荧光素酶报告基因的野生型(pmiR-Twist1-WT)或突变型Twist1(pmiR-Twist1-MUT)3′UTR的质粒,分别与miR-519d模拟物共转染入SMMC-7721源性LCSLCs。结果表明,SMMC-7721源性LCSLCs中的pmiR-Twist1-WT-3′UTR的相对荧光素酶活性降低36%,但不影响突变体3′UTR的相对萤光素酶活性(Fig 3B)。本研究结果还发现,miR-519d模拟物转染的SMMC-7721源性LCSLCs Twist1蛋白水平降低(Fig 3C)。此外,miR-519d模拟物转染的SMMC-7721源性LCSLCs球和集落形成率下降(Fig 3D、3E)。
3.4miR-519d模拟物对BrMC调节miR-519d和Twist1表达作用的影响miR-519d功能获得实验结果显示,miR-519d模拟物转染协作BrMC (3 μmol·L-1)上调miR-519d表达(Fig 4A,P<0.05),下调Twist1蛋白表达(Fig 4B,P<0.05)。值得注意的是,miR-519d模拟物还能协作增强BrMC (3 μmol·L-1)抑制SMMC-7721源性LCSLCs球和琼脂集落形成效应 (Fig 4C、4D,P<0.05 )。
3.5TWIST1基因转导对BrMC调节miR-320和Twist1表达作用的影响TWIST1基因的功能获得实验结果证实,pcDNA3.1-Twist1不影响BrMC (3 μmol·L-1)上调miR-519d表达作用(Fig 5A);然而,有效地拮抗BrMC(3 μmol·L-1) 下调Twist1蛋白表达(Fig 5B,P<0.05)。此外,pcDNA3.1-Twist1减弱BrMC(3 μmol·L-1)抑制SMMC-7721源性LCSLCs球和琼脂集落形成效应(Fig 5C、5D,P<0.05)。
4 讨论
Cao等[1]报道,球形成法是分离和鉴别具有肝癌干细胞特性的LCSLCs特别有用的实验技术。我们先前的研究通过比较原代、第2代、第3代和第4代球细胞的球形成率,发现SMMC-7721细胞系第2代球细胞形成第3代球细胞时的球形成率最高,也就是说其具有最强的球形成潜能;此外,第2代球细胞较SMMC-7721细胞有更高表达肿瘤干细胞标志物(CD133、CD44、ALDH1),以及更强的裸鼠体内成瘤能力。所以,我们推测SMMC-7721细胞系第2代球细胞富集了肝癌干细胞,并定义其为LCSLCs[7]。
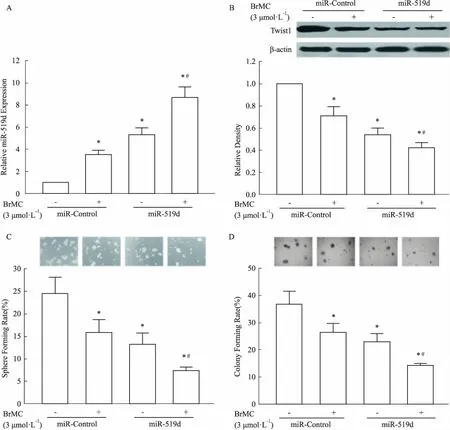
Fig 4 Effects of miR-519d mimic on expressions of miR-519d and Twist1 regulated by BrMC in SMMC-7721-derived LCSLCs(n=3)
A: Effect of miR-519d mimic on expression of miR-519d regulated by BrMC assessed by qRT-PCR; B: Effect of miR-519d mimic on expression of Twist1 protein regulated by BrMC analyzed by Western blot; C: Effect of miR-519d mimic on sphere forming rate regulated by BrMC determined by sphere formation assay; D: Effect of miR-519d mimic on colony forming rate regulated by BrMC determined by colony formation assay in agar.*P<0.05vsLCSLCs transfected with scrambled control oligos(miR-Control);#P<0.05vsLCSLCs transfected with scrambled control oligos(miR-Control) by treatment with 3.0 μmol·L-1BrMC.
本实验研究首先证明,相比SMMC-7721细胞,人肝细胞癌SMMC-7721源性LCSLCs miR-519d低表达,Twist1蛋白表达上调。其次,我们不仅证实miR-519d直接靶向Twist1的3′非翻译区,并调节Twist1蛋白表达;而且发现过表达miR-519d抑制SMMC-7721源性LCSLCs体外致癌能力。其三,过表达TWIST1不影响miR-519d表达水平,但有效增强SMMC-7721源性LCSLCs体外致癌能力。我们的结果与Yue等[5]的研究结果相似,建议miR-519d,靶向抑制TWIST1基因,是一种抑制LCSLCs致癌能力的肿瘤抑制基因。
在多种类型的肿瘤中,人们对miR-519d表达和功能进行了广泛的研究。如Zhou等[9]确定宫颈癌组织miR-519d表达降低,并且异位表达miR-519d,通过抑制Smad7表达抑制宫颈癌转移。Xie等[10]研究证明,过表达miR-519d靶向抑制MCL-1基因表达,增强耐药乳腺癌干细胞对顺铂敏感性。然而,迄今为止,还没有关于miR-519d对LCSLCs功能和特性作用的研究报道。
Twist是介导中胚层、成肌细胞和成骨细胞分化的转录因子[11]。在晚期肝细胞癌中,Twist蛋白水平升高导致预后差[12]。我们先前的研究表明,BrMC通过下调Twist表达,抑制肝癌干细胞自我更新[7]。最近几项研究表明,miRNA在恶性肿瘤调节TWIST1基因表达中起重要作用。Zhu等[12]证实,miR-186通过调节TWIST1,抑制卵巢癌细胞上皮-间充质转化,细胞周期G1期阻滞,并促进卵巢癌细胞凋亡。Li等[13]的研究确定TWIST1是miR-320直接靶基因。Yue等[5]证实,miR-519d通过Twist1和Wnt /β-连环蛋白信号通路,抑制胃癌上皮-间充质转化。本研究结果证实,miR-519d直接靶向Twist1 mRNA 3′非翻译区,并调节Twist1蛋白表达,TWIST1基因功能获得能有效对抗miR-519d抑制SMMC-7721源性LCSLCs体外致癌作用。

Fig 5 Effects of transduction of TWIST1 gene on expressions of miR-519d and Twist1 regulated by BrMC in SMMC-7721-derived LCSLCs(n=3)
A:Effect of transduction of TWIST1 gene on expression of miR-519d regulated by BrMC assessed by qRT-PCR; B: Effect of transduction of TWIST1 gene on expression of Twist1 protein regulated by BrMC analyzed by Western blot; C: Effect of transduction of TWIST1 gene on sphere forming rate regulated by BrMC determined by sphere formation assay; D: Effect of transduction of TWIST1 gene on colony forming rate regulated by BrMC determined by colony formation assay in agar.*P<0.05vsLCSLCs transducted with pcDNA3.1-LacZ;#P<0.05vsLCSLCs transducted with pcDNA3.1-LacZ by treatment with 3.0 μmol·L-1BrMC.
本实验研究还证实,新型白杨素类似物BrMC通过调控miR-519/Twist1信号轴,抑制SMMC-7721源性LCSLCs体外致癌能力,揭示了一种BrMC抗肿瘤作用新型分子机制。有关BrMC抑制CSCs或肿瘤干样细胞上皮-间充质转化和CSCs功能和特性作用已经有多篇报道[3-4,7,14]。在先前的研究中,我们亦证明BrMC优先抑制SMMC-7721源性LCSLCs增殖,对人胚肝L-02细胞存活力影响小[3]。我们新近报道,BrMC通过阻断STAT3/Twist信号轴,抑制SMMC-7721源性LCSLCs球形成和侵袭能力[4]。尽管BrMC如何通过STAT3和miR-519d及两者相互作用来调控Twist1表达,抑制LCSLCs干细胞特性还有待进一步研究,然而本文的研究结果清楚地阐释了BrMC通过上调miR-519d,下调Twsit1蛋白表达,抑制SMMC-7721源性LCSLCs体外致癌能力新的作用分子机制。
总之,我们的研究结果探索了白杨素新型类似物BrMC以微小RNAs为靶标,抑制肿瘤干细胞样细胞致癌能力的可能性。但是,有关白杨素类似物BrMC调控miR-519d/Twist1信号轴,抑制LCSLCs致癌能力的潜在临床应用价值仍然需要深入评价。
(致谢:本实验是在湖南师范大学医学院医药学实验中心完成的,感谢任凯群副教授、全梅芳实验师的帮助,特此致谢!)
[1] Cao L, Zhou Y, Zhai B, et al. Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines[J].BMCGastroenterol, 2011,11:71.
[2] Oishi N, Wang X W. Novel therapeutic strategies for targeting liver cancer stem cells[J].IntJBiolSci, 2011,7(5):517-35.
[3] Zou H, Cao X, Xiao Q, et al. Synergistic inhibition of characteristics of liver cancer stem-like cells with a combination of sorafenib and 8-bromo-7-methoxychrysin in SMMC-7721 cell line[J].OncolRep,2016,36(3):1731-8.
[4] Luo Y, Cui Y, Cao X, et al. 8-Bromo-7-methoxychrysin-blocked STAT3/Twist axis inhibits the stemness of cancer stem cell-like cell originated from SMMC-7721 cells[J].ActaBiochimBiophysSin(Shanghai), 2017,49(5):458-64.
[5] Yue H, Tang B, Zhao Y, et al. MIR-519d suppresses the gastric cancer epithelial-mesenchymal transition via Twist1 and inhibits Wnt/β-catenin signaling pathway[J].AmJTranslRes, 2017,9(8):3654-64.
[6] Hou Y Y, Cao W W, Li L, et al. MicroRNA-519d targets MKi67 and suppresses cell growth in the hepatocellular carcinoma cell line QGY-7703[J].CancerLett, 2011,307:182-90.
[7] Ren K Q, Cao X Z, Liu Z H, et al. 8-bromo-5-hydroxy-7-methoxychrysin targeting for inhibition of the properties of liver cancer stem cells by modulation of Twist signaling[J].IntJOncol,2013,43(5):1719-29.
[8] Zheng X, Meng W D, Xu Y Y, et al. Synthesis and anticancer effect of chrysin derivatives[J].BioorgMedChemLett, 2003,13(5):881-4.
[9] Zhou J Y, Zheng S R, Liu J, et al. MiR-519d facilitates the progression and metastasis of cervical cancer through direct targeting Smad7[J].CancerCellInt,2016,16:21.
[10] Xie Q, Wang S, Zhao Y,et al. MiR-519d impedes cisplatin-resistance in breast cancer stem cells by down-regulating the expression of MCL-1[J].Oncotarget,2017,8(13):22003-13.
[11] Lee K W, Yeo S Y, Sung C O, Kim S H. Twist1 is a key regulator of cancer-associated fibroblasts[J].CancerRes,2015,75:73-85.
[12] Zhu X, Shen H, Yin X, et al. miR-186 regulation of Twist1 and ovarian cancer sensitivity to cisplatin[J].Oncogene, 2016,35:323-32.
[13] Li C, Duan P, Wang J, et al. miR-320 inhibited ovarian cancer oncogenicity via targeting TWIST1 expression[J].AmJTranslRes,2017,9(8):3705-13.
[14] 曹晓正, 杨小红, 曹建国, 等. 8-溴-7-甲氧基白杨素逆转人宫颈癌SiHa细胞系球形成细胞上皮-间叶样表型转化[J]. 中国药理学通报,2014,30(5): 668-71.
[14] Cao X Z, Yang X H, Cao J G, Xiang H L. 8-bromo-5-hydroxy-7-methoxychrysin reverses of sphere-forming cells derived from cervical cancer SiHa cell line[J].ChinPharmacolBull, 2014,30(5):668-71.
